miR-483在视网膜母细胞瘤细胞中的表达及其作用机制
2019-07-25邵宏超
苏 杰,刘 岩,邵宏超
(华北理工大学附属医院眼科,河北 唐山 063000)
视网膜母细胞瘤(retinoblastoma,RB)是婴幼儿最常见的眼内恶性肿瘤,随着生活水平及诊疗技术的提高,RB的治疗也由以往的眼球摘除向尽可能保留眼球、提高生存率等方面转变。microRNA-483(miR-483)与肿瘤的发生关系密切,在肿瘤细胞增殖、分化、凋亡等过程中起到调控作用,但miR-483在RB中的作用尚不明确。本研究通过对RB Y79细胞株转染miR-483模拟物及抑制物,探讨miR-483在RB细胞中的表达及作用机制,为RB的治疗提供理论依据。
1 材料与方法
1.1 细胞、试剂与仪器RB Y79细胞株、正常视网膜细胞ARPE-19(深圳豪地华拓生物有限公司);RPMI-1640培养基、胎牛血清(美国Gibco公司),细胞自噬染色检测试剂盒(南京凯基生物科技有限公司),RNA提取试剂盒(美国Sigma公司),SYBR Green实时荧光定量聚合酶链反应试剂盒(美国Thermo公司);FACSCalibur流式细胞仪(美国BD Biosciences公司),低速离心机(长沙湘智离心机仪器有限公司),培养箱[赛默飞世尔科技(中国)有限公司]。
1.2 方法
1.2.1 细胞培养常规培养ARPE-19细胞和Y79细胞。Y79细胞悬浮生长,当细胞密度达到80%时,对细胞进行传代培养;取生长状态良好的细胞,以每孔5×105接种于6孔板,于37 ℃、含体积分数5%CO2的培养箱中培养过夜。
1.2.2 细胞转染取处于对数生长期、生长状态良好的Y79细胞,转染前2 h,换成无血清1640培养基,根据细胞转染的不同,分为miR-483 inhibitors组、miR-483 minics组和阴性对照组。miR-483 inhibitors组和miR-483 minics组细胞分别转染miR-483 inhibitors和miR-483 minics;细胞转染后于37 ℃、含体积分数5%CO2的培养箱中培养,4~6 h后吸出混合液换入正常培养基;于37 ℃、含体积分数5%的CO2培养箱中继续培养 24 h。采用聚合酶链反应检测各组细胞的转染情况,操作步骤严格按照试剂盒说明书进行。
1.2.3 反转录聚合酶链反应(reverse transcriptase polymerase chain reaction,RT-PCR)检测细胞中miR-483的表达取对数生长期ARPE-19细胞和Y79细胞,按试剂盒要求提取RNA,取10 μL总RNA,配制反应体系进行反转录,反应条件:42 ℃ 30 min;85 ℃ 10 min。再次配制反应体系,将已点好样的8连管板置于RT-PCR仪上进行反应,95 ℃ 3 min预变性;95 ℃ 12 s,62 ℃退火延伸40 s,共40个循环。
1.2.4 双染法流式细胞术检测各组细胞凋亡率取转染后的Y79细胞,2.5 g·L-1胰蛋白酶消化,终止消化后收集细胞,1 500 r·min-1离心 5 min,弃上清液,收集细胞;预冷磷酸缓冲液重悬细胞2次,1 500 r·min-1离心5 min,洗涤细胞;按膜联蛋白V-异硫氰酸荧光素/碘化丙啶(fluorescein isothiocyanate/ propidium lodide,Annexin-FITC/PI)细胞凋亡检测试剂盒操作说明书进行实验;加500 μL Binding Buffer悬浮细胞;加5 μL Annexin V-FITC混匀后,避光室温孵育15 min加入5 μL PI染色,轻摇混匀,避光条件下室温孵育10 min;流式细胞仪上机检测细胞凋亡情况,CELL Quest软件分析。
1.2.5 流式细胞术检测细胞周期取转染后的Y79细胞,用2.5 g·L-1不含乙二胺四乙酸的胰蛋白酶消化细胞,终止消化后收集细胞,1 000 r·min-1离心5 min,弃上清液,PBS重悬润洗2次;100 μL PBS重悬细胞,缓慢加入700 μL预冷的体积分数80%乙醇;4 ℃固定过夜;1 000 r·min-1离心 5 min,预冷PBS润洗2次;加入100 μL RNase(50 mg·L-1),37 ℃水浴30 min;加入50 mg·L-1PI 400 μL,4 ℃避光染色30 min;流式细胞仪上机检测各组细胞周期。

2 结果
2.1 miR-483在Y79细胞和ARPE-19细胞中的表达比较miR-483在Y79细胞和ARPE-19细胞中的相对表达量分别为1.83±0.73、1.29±0.32,miR-483在Y79细胞中的相对表达量高于ARPE-19细胞,差异有统计学意义(P<0.01)。
2.2 Y79细胞转染情况miR-483 inhibitors组、miR-483 minics组和阴性对照组Y79细胞中miR-483表达量分别为1.76±0.43、12.32±2.57、4.03±0.98,miR-483 inhibitors组Y79细胞中miR-483表达量低于阴性对照组,差异有统计学意义(P<0.05);miR-483 minics组Y79细胞中miR-483表达量高于阴性对照组,差异有统计学意义(P<0.01)。
2.3 Y79细胞转染后各组细胞凋亡率比较结果见图1。miR-483 inhibitors组、miR-483 minics组和阴性对照组Y79细胞凋亡率分别为(31.52±0.82)%、(23.34±0.35)%、(26.47±1.09)%,miR-483 inhibitors组Y79细胞凋亡率高于阴性对照组,差异有统计学意义(P<0.05);miR-483 minics组Y79细胞凋亡率低于阴性对照组,差异有统计学意义(P<0.05)。
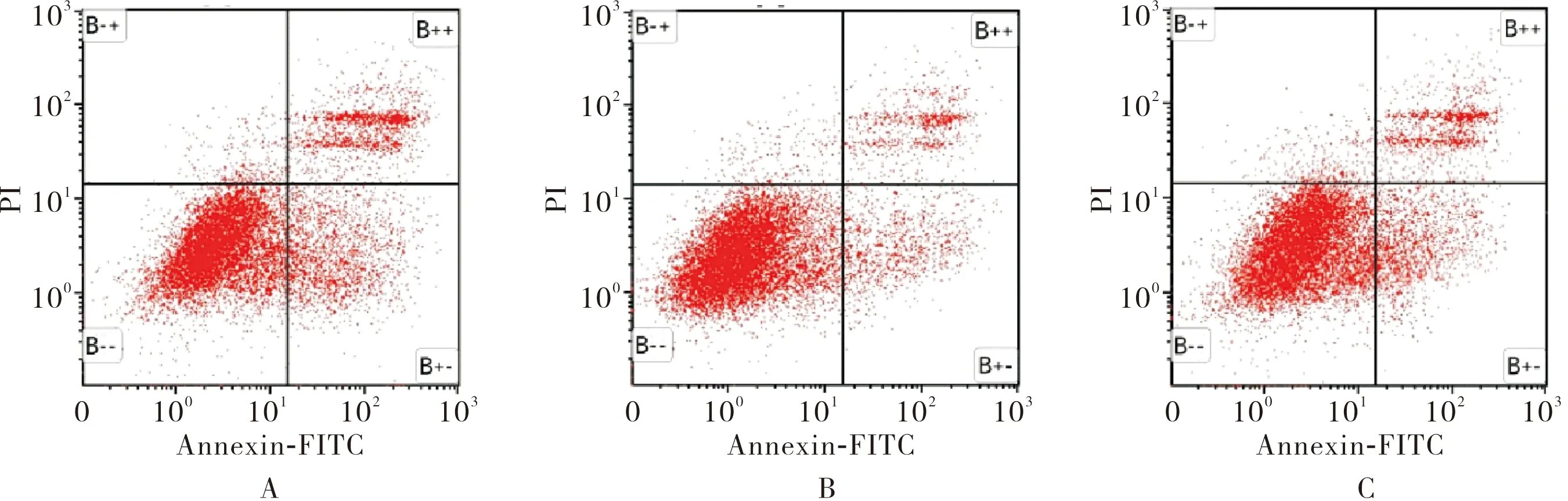
A:miR-483 inhibitors组;B:miR-483 mimics 组;C:阴性对照组。
图1 各组Y79细胞凋亡情况
Fig.1 Apoptosis of Y79 cells in each group
2.4 Y79细胞转染后各组细胞周期比较结果见图2。miR-483 inhibitors组、miR-483 minics组、阴性对照组Y79细胞G1期所占比例分别为(5.53±0.72)%、(58.88±1.21)%、(43.66±0.84)%;miR-483 inhibitors组Y79细胞G1期所占比例高于阴性对照组,差异有统计学意义(P<0.05);miR-483 minics组Y79细胞G1期所占比例低于阴性对照组,差异有统计学意义(P<0.05)。
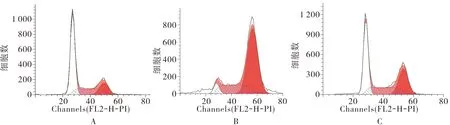
A:miR-483 mimics 组;B:miR-483 inhibitors组;C:阴性对照组。
图2 各组Y79细胞转染后细胞周期
Fig.2 Cell cycle of RB cell line Y79 after transfected in each group
3 讨论
RB是一种致盲率、致死率很高的原发于视网膜的恶性肿瘤,发病率为121 000~118 000[1]。放射治疗和化学治疗是最常用的RB保守治疗方法,但放射治疗可能会造成严重的并发症,化学治疗又可能诱导肿瘤耐药而导致治疗失败[2],因此,寻找一种安全可靠的治疗方法尤为重要。
MiR是一种微小核糖核酸,作为癌基因或抑癌基因在多种肿瘤的发生、发展中发挥重要作用。研究显示,miR-483与多种肿瘤的发生密切相关,其在肝癌[3]、肾上腺皮质癌[4]、结直肠癌[5]、胰腺癌[6]、胃癌[7]等肿瘤中表达升高,且发挥促癌作用。本研究通过RT-PCR法检测RB细胞Y79与正常视网膜细胞ARPE-19中miR-483的表达量,结果显示,Y79细胞中miR-483的表达量明显升高,提示miR-483可能对RB的生长起到促进作用。
ZHOU等[8]研究发现,下调miR-483-3p可抑制食管癌细胞的增殖、迁移,促进化学治疗药物诱导的细胞凋亡。ZHENG等[9]研究显示,上调miR-483-5p可促进鼻咽癌细胞增殖,抑制其凋亡。但目前尚无miR-483与RB关系的报道,本研究通过miR-483 minics瞬时转染Y79细胞后,流式细胞术检测细胞凋亡率及细胞周期,结果发现,转染miR-483 minics后,Y79细胞凋亡率降低,G1期所占比例增高,细胞周期G1期延长,抑制细胞凋亡;但转染miR-483 inhibitors后,细胞凋亡率升高,G1期所占比例下降,细胞周期G1期缩短,加速肿瘤细胞凋亡。提示下调miR-483可以抑制RB细胞增殖,阻滞细胞周期中G1/S期过渡,增加细胞凋亡,抑制RB生长。
综上所述,miR-483在RB细胞中高表达,下调miR-483可以抑制RB细胞生长。基因治疗可能成为未来肿瘤治疗的新方法,miR-483作为新的基因靶点,可能会在以后RB的临床治疗中发挥重要作用。
