注射用盐酸柔红霉素的质量评价
2019-07-25王强庞文哲李香荷高燕霞
王强 庞文哲 李香荷 高燕霞
(河北省药品检验研究院,石家庄 050000)
柔红霉素(daunorubicin)是蒽环类抗生素中一种非常重要的抗肿瘤药物。临床上主要用以治疗急性白血病。最早于1963年由意大利学者DiMarco等[1]从波赛链霉菌(Streptomyces peucetius)分离获得。国内于70年代从河北正定县土壤中亦获得同类放线菌并提取出同类物质[2]。
柔红霉素口服无效,只能静脉注射给药,因此仅注射剂一种剂型。注射用盐酸柔红霉素,为红色疏松冻干块状物或粉末,属于发疱性强刺激性化疗药,原研企业为意大利辉瑞公司(Pfizer Italia S.r.l)。药用机理[3]为通过拓扑同分异构酶插入脱氧核糖核酸(DNA),破坏其模板功能,干扰DNA和核糖核酸(RNA)的合成,又可以生成自由基,对细胞具有高度破坏性,对周围血管有强烈的刺激性。其主要不良反应为:骨髓抑制[4]、心脏毒性[5]及胃肠道反应[6]等。
中国药典2015年版二部[7]和美国药典(USP)40版[8]收载原料及其制剂,欧洲药典(EP)9.0[9]、英国药典(BP)2017[10]等主要国外药典仅收载原料标准。
注射用盐酸柔红霉素为国家食品药品监督管理总局的国家药品计划抽验品种。本文在完成法定标准检验的基础上,结合探索性研究对检验结果进行进一步分析,进而对国产注射用盐酸柔红霉素的质量现状进行评价,并从安全性和有效性角度对企业生产工艺和现行法定标准提出建议。
1 仪器与试药
1.1 仪器
LC-20AT液相色谱仪(日本岛津公司)。Mettler TOLEDO型电子天平(Mettler公司)。YB-2型澄明度检测仪(天大天发)。GWJ-16型微粒分析仪(天大天发)。
1.2 试药
盐酸柔红霉素(daunorubicin hydrochloride)对照品为USP对照品。盐酸多柔比星(doxorubicin hydrochloride)对照品、柔红霉酮(daunorubicinone)对照品均为EP对照品。
试剂均为分析纯,水为超纯水。
1.3 样品
17批次注射用盐酸柔红霉素均为2016年国家药品质量评价性抽验样品,涉及3家生产企业,企业覆盖率100%、批准文号覆盖率100%;抽样覆盖了全国9个省、自治区和直辖市,其中生产企业抽样3批、经营企业与流通环节抽样8批、使用单位抽样6批。抽样样品能代表本品种目前的生产和使用状况,对其进行检验和统计分析,结果应能较好地反映目前国产注射用盐酸柔红霉素的质量现状。
2 试验方法
2.1 法定标准检验
按照中国药典2015年版二部进行检验。
2.2 探索性研究
根据法定检验结果及发现的问题,围绕药品安全性、有效性和质量可控性,进一步开展有关物质、溶液的澄清度、甘露醇、包材相容性和稳定性等项目的探索性研究。
2.2.1 有关物质
参照现行标准有关物质测定方法,采用LC-MS定性,结合杂质对照品定位和原料药破坏试验,考察样品的杂质谱。
2.2.2 澄明度检查
针对现行标准中缺少溶液的澄清度检查项,通过与类似品种“注射用盐酸表柔比星”标准对比[11],建立溶液的澄清度检查方法。
2.2.3 甘露醇含量测定
国内生产企业均采用甘露醇为冻干骨架,拟通过HPLC法对各企业甘露醇添加量进行测定分析。
2.2.4 包材相容性考察
针对丁基胶塞可能对质量产生影响,开展包材相容性考察。样品分别采用正置和倒置的方式,进行为期60d的加速试验[温度(40±2)℃、湿度(75%±5%)],以10d为一周期,检测有关物质、不溶性微粒、溶液的澄清度等检测项目,考察包材对制剂质量的影响。
2.2.5 影响因素考察
参照中国药典2015年版通则9001原料药与制剂稳定性试验指导原则,考察高温(60℃)、高湿(25℃,92.5%)和光照(4500lx)条件下,分别对放置5d、10d样品的性状、酸度、不溶性微粒、有关物质、含量等指标变化情况。
3 结果与结论
3.1 现行质量标准检验及存在问题
3.1.1 检验总体结果
依据中国药典2015年版二部检验,17批次注射用盐酸柔红霉素全部合格,合格率100.0%。
对检验数据分析发现:有关物质测定结果体现出一定差异,B企业样品的最大单个杂质的量和杂质总量均较高,且离散程度最大,最大单个杂质的量为0.5%~0.7%,杂质总量为1.6%~1.9%。A、C企业样品最大单个杂质的量为0.3%~0.4%,杂质总量为0.7%~0.9%,见图1。初步分析认为可能与原料质量及稳定性有关,制剂的生产工艺及储存环境也是影响产品质量的风险点。
3.1.2 现行标准存在问题
(1)有关物质缺失对特定杂质的控制:现行质量标准中有关物质只控制了单个杂质和杂质总量,缺少对特定杂质的控制,尤其是降解物杂质的控制,使检验结果不能真实反映药品的内在质量。
(2)部分检验项目缺失:缺少对注射剂较为重要的溶液的澄清度检查。
3.2 探索性研究
3.2.1 有关物质
杂质与药品的安全性密切相关,为进一步明确杂质的结构及来源,开展了杂质检查的探索研究,进而对现行标准有关物质质控指标及限度的合理性予以评价。

图1 有关物质检测结果箱式图Fig.1 Boxplots of the related substances
(1)杂质谱的建立:采用中国药典2015年版二部的有关物质检查方法建立样品杂质谱。采用LCMS/MS测定并推测杂质的结构和归属。17批样品和3家企业提供的原料共检出10个杂质,其中杂质3、4和10含量较高,分别为0.2%~0.6%、0.1%~0.3%和0.3%~0.7%,为主要杂质。通过液相色谱、紫外光谱、质谱鉴别和杂质对照品比对,确认杂质3为多柔比星(doxorubicin,EP9.0杂质D),杂质4为柔红霉醇(daunorubicinol,EP9.0杂质B),杂质10为柔红霉酮(daunorubicinone,EP9.0杂质A)(下文采用EP的杂质命名,分别称杂质3、4、10为杂质D、B、A)。有关物质典型谱图见图2。
(2)主要杂质溯源:通过强制降解实验,分析主要影响因素及杂质来源,杂质来源见表1。结果显示:在强光、酸、碱、氧化和热条件下杂质A均有明显增加,为主要降解产物;杂质D和B在氧化的条件下有所增加,其他条件增加不明显。另外,在氧化、热、碱和光条件下,会产生新的杂质。提示相关企业应注重生产工艺的控制,如配液温度不当,pH值控制不当,均会导致杂质的增加。
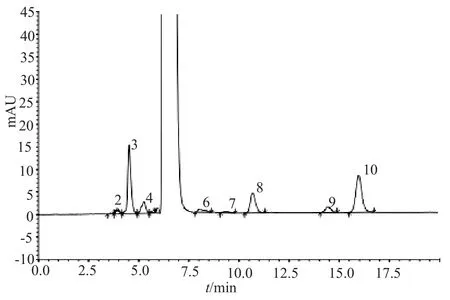
图2 注射用盐酸柔红霉素有关物质HPLC图Fig.2 HPLC Chromatogram of daunorubicin hydrochloride forinjection in related substances

表1 杂质来源与归属Tab.1 The impurity sources and results
(3)生产工艺对杂质的影响:对比各企业制剂与原料的杂质含量,结果表明,C企业制剂与原料杂质含量无明显差异。A和B企业的制剂与原料相比,杂质均有较大幅度提升,各杂质含量见表2。3家企业生产工艺流程基本相同,但产品质量存在差异,提示A和B企业可能存在工艺缺陷。同时,各企业制剂的稳定性也存在明显差异。B企业制剂的稳定性较差,在60d加速试验中,杂质的量增加明显,最大单个杂质的量从0.7%增加为2.1%,杂质总量由1.9%增至3.4%。鉴于原料药的质量直接影响制剂的质量。提示该企业原料生产也应进一步提高控制水平。
(4)杂质控制建议:探索性研究结果显示,17批样品的主要杂质均为杂质A、B和D。经二元相关分析,发现杂质A和D均与杂质总量呈正相关(P<0.01),杂质B与杂质总量未显示出相关性,提示杂质A和D是本品的主要杂质,建议在现行标准中增加对这两个杂质的控制。

表2 各企业制剂及原料杂质统计结果Tab.2 Impurity content of preparations and raw materials
国外药典中,EP9.0对杂质控制较为全面,探索性试验参照其进行检验,结果表明:17批次样品中,14批次样品合格,合格率82.4%,不合格率为17.6%。不合格产品均为B企业产品,主要为杂质A、D及其他单个杂质超出限度。
3.2.2 溶液的澄清度
溶液的澄清度是影响注射剂质量的重要因素,针对现行标准中缺少溶液的澄清度检查项,建立了检查方法。检查方法采用中国药典2015年版通则0902第一法(目视法)。参考类似品种“注射用盐酸表柔比星”,拟定为“按标示量,分别加水溶解成含盐酸柔红霉素2mg/mL的溶液,溶液应澄清”。采用拟定标准测定17批样品的澄清度,结果表明,17批次样品溶液的澄清度全部合格,均不超过0.5号浊度标准液的浊度,合格率100.0%。
3.2.3 甘露醇(赋形剂)含量测定
药用赋形剂对注射剂的稳定性、pH值、渗透性、生物利用度和透明度等指标具有重要影响,甚至能影响到药品的安全性。注射用盐酸柔红霉素为盐酸柔红霉素加适量甘露醇制成的无菌冻干品,甘露醇占装量的80%以上。通过HPLC法对各企业甘露醇添加量进行测定分析。对17批样品的测定结果表明,A企业样品甘露醇添加量为处方量的100.8%~102.5%,B企业为101.6%~103.0%,C企业为100.9%~102.7%。可见,各企业均能按照处方准确添加。
3.2.4 包材相容性
文献报道,抗生素针剂溶液的澄清度会受胶塞影响[12-13]。针对注射剂采用的胶塞可能对质量产生的影响,开展包材相容性考察。数据分析可知,样品与胶塞的接触对性状、溶液的澄清度基本无影响,有关物质基本保持不变,并未生成新的杂质。对不溶性微粒影响较大,倒置样品微粒数明显高于正置样品,但仍符合规定。
3.2.5 影响因素考察
注射用盐酸柔红霉素使用范围较广,但国内生产厂家较少,因此,经常涉及到大范围长途药物运输情况。为考察在运输和储存过程中环境变化对制剂质量的影响,开展稳定性试验。
在高温环境下,性状、酸度无明显变化,含量下降约2%~3%,杂质数及杂质含量均明显增加,在第5天,B企业样品的最大单个杂质和杂质总量分别达到2.1%和3.3%,均超过现行标准限度。进一步分析得知为柔红酶酮增加所致,可见温度对产品内在质量影响明显。
在光照条件下,外观、酸度无明显变化,药品含量下降不足1%,杂质含量略有上升,提示应注意避光保存,经10d试验,无不符合规定批次出现。
在高湿条件下,药品各项指标均无明显变化,可见产品包装密封性较好,湿度不会成为影响产品质量的主要因素。
综上所述,光照和温度会对产品的有关物质和含量产生不同程度的影响,说明应注意控制样品的储存条件。
4 讨论
本次药品评价性抽验结果显示,依照现行药典标准检验,全部17批样品均符合规定,国产注射用盐酸柔红霉素总体质量状况“较好”。
通过以上分析集合探索性研究可知,影响本品质量的主要因素有原料药的质量,制剂的生产工艺和温度的控制,提示应选用优质原料,优化生产工艺,严格控制生产过程及贮存过程中的温度控制,确保制剂临床使用的安全性和有效性。次要因素主要是包材质量,应重视胶塞对不溶性微粒的影响,提示在生产过程中应选用优质的包材。
此外,现行中国药典标准有待进一步完善。建议:(1)提高原料和注射剂的有关物质的控制水平,增加对降解杂质A和D的控制,并制定相关限度;(2)增加溶液的澄清度检查。
