花生芽白藜芦醇含量分析与原生质体制备条件的优化
2019-07-24康洁房玉杰
康洁,房玉杰
(商丘师范学院 生物与食品学院,河南 商丘,476000)
白藜芦醇是植物体内合成的具有抗氧化作用和抗肿瘤作用的一种酚类化合物[1],在花生、红葡萄和虎杖等植物体内含量较多,而花生发芽后,体内白藜芦醇含量增加多倍[2],但在花生芽不同部位含量不同[3].本实验室选择花生芽合成白藜芦醇最高部位,进行原生质体培养,以期获得白藜芦醇高效的生产方法.本实验从酶浓度和组合,酶作用时间和离心速度、洗涤液甘露醇浓度以及酶的pH值几个方面进行了研究,研究数据为原生质体的体外培养奠定了基础.
1 材料与方法
1.1 仪器与试剂
恒温培养箱(上海长城华美仪器化剂公司),普通光学显微镜、倒置相差显微镜(OLYMPUS),紫外分光光度计(上海精密仪器仪表有限公司),电热恒温鼓风干燥箱(上海和呈仪器制造有限公司),水浴锅(常州国华电器有限公司),低速离心机(上海安亭科学仪器厂),血细胞计数板(上海医用光学仪器厂).
主要试剂纤维素酶、果胶酶、半纤维素酶、甘露醇(天津市科密欧化学试剂有限公司).
1.2 材料准备
25 ℃恒温下避光培养花生芽,分析花生芽不同部位白藜芦醇含量[4],经紫外分光光度法检测,确定花生芽3 cm长的下胚轴白藜芦醇含量最高.取3 cm长的下胚轴,制备原生质体进行培养[5,6].
1.3 花生芽原生质体制备
1.3.1 原生质体洗涤液配制
1.3.2 酶液配制
称取适量酶固体溶于含有0.6 mol/L甘露醇洗涤液中,在50 ℃水浴保温5 min,使其充分溶解,分别配出2%纤维素酶、1%纤维素酶、0.5%纤维素酶、1%果胶酶、0.5%果胶酶、0.25%果胶酶、0.25%半纤维素酶,过滤除菌,放4 ℃冰箱备用.
1.3.3 原质体计数与活力测定方法
使用0.1 mm XB-K-25型血球计数板计算原生质体数.首先清洗血球计数板,并用吸水纸吸干残余水滴;在显微镜下将原生质体溶液滴在计数板盖玻片一侧,使之渗入并充满计数室;显微镜下计数中央大方格内的原生质体个数,计算出1mL悬液中原生体数,原生体产量按照如下公式计算[7]:
原生质体产量(细胞数/g)=1 mL悬浮液中的原生质体数×原生质体悬浮液总体积(mL)/材料总质量(g)
采用倒置相差显微镜下观察到的细胞形态判断活力.有活力的细胞个大、饱满、透光,活力小或死亡的细胞个小、干瘪、透光度差.取适量原生质体悬液做成水装片,不染色,直接在倒置相差显微镜下观察、拍照,并取同量的悬液计数板计数.原生质体的活力计算如下:
原生质体活力=(饱满透光原生质体数/原生质体总数)×100%
1.3.4 花生芽下胚轴原生质体制备条件优化
(1)酶浓度与组合的影响
两种酶液1∶1配比,设计7种组合方式,如表1,每种组合都用10 mL洗涤液与50 ul 1mol/L NaOH稀释,然后向各组加入0.9 g 3 cm花生芽下胚轴,放于25 ℃暗环境下酶解60 min,分别用300目尼龙网过滤,滤液用700 r/min 离心5 min,取沉淀,加3 mL洗涤液悬浮,重复离心一次,最后沉淀用洗涤液悬浮定容10 mL.按照1.3.3方法计数测活力.

表1 酶浓度与酶组合
(2)酶解时间的影响
采用酶组合中原生质体产量最高的一组,在25 ℃暗环境下酶解,设立时间 20 min,40 min,60 min,80 min,100 min,120 min,酶解液经300目尼龙网过滤,700 r/min离心5 min,取沉淀,加3 mL洗涤液悬浮,重复离心一次,得到的沉淀洗涤液悬浮定容10 mL.按1.3.3方法计数和测活力.
(3)离心速度的影响
在最佳酶组合与酶解时间下,设原生质体离心速度分别为500 r/min 、600 r/min 、700 r/min、800 r/min、900 r/min、1000 r/min,离心5min,取其沉淀,加相同适量洗涤液悬浮,重复离心一次.按1.3.3方法计数和测活力.
(4)甘露醇浓度的影响
将入0.9 g 3 cm花生芽下胚轴分别放入甘露醇浓度为0.4 mol/L、0.5 mol/L、0.6 mol/L、0.7 mol/L、0.8 mol/L、0.9 mol/L的洗涤液中,采用最佳酶液组合、最佳酶解时间和离心速度.酶解完成后,按1.3.3方法测原生质体产量和活力.
(5)pH值大小的影响
调酶解液pH分别为4、4.5、5、5.5、6、6.5,使用0.9 g 3 cm花生芽下胚轴,用最佳酶组合、酶解时间最佳离心速度和甘露醇浓度,按上述方法酶解、洗涤、离心,得到的沉淀悬浮、定容.按1.3.3方法测原生质体产量和活力.
2 结果分析
2.1 酶浓度与组合的影响结果
在不同酶浓度酶组合中的花生芽下胚轴,生产出的原生质体数和活力存在明显差异,如表2所示,同样条件下,在组合4中,1%的纤维素酶和0.5%的果胶酶共同作用,产量达到6.4×104cells/g 、细胞活力达91%,此时,显微镜下细胞表现出较大而圆.从表2中还可以看出,两种酶浓度组合一起,原生质体数量是增大的,但活力不够高,而且显微镜下表现出细胞个体较小、透光度差(如图1),说明酶作用强烈会影响细胞的生命活力.
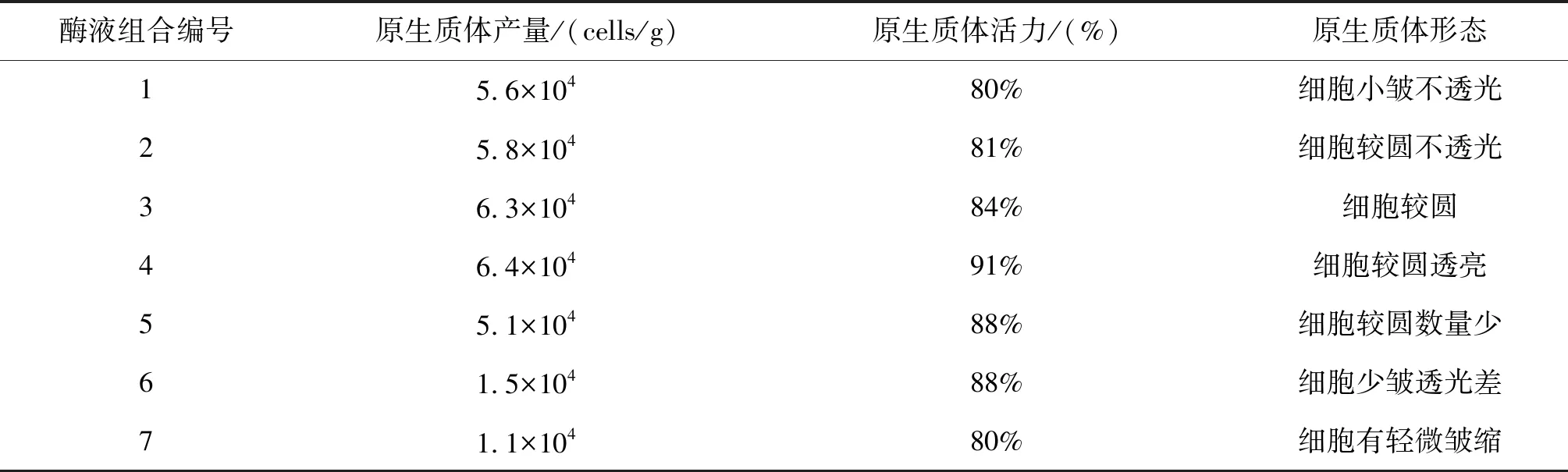
表2 酶浓度与酶组合对原生质体数量与活力的影响

图1 显微镜下细胞形态与数量图1a酶组合4;图1b酶组合6
2.2 酶解时间的影响结果
在2.1最佳酶组合条件下,作用温度一致,不同的作用时间,分离的原生质体结果如图2.在酶作用60 min时数量最多,达8×104cells/g,原生质体活力在酶作用60-80 min时段内,变化不明显,活力都比较高,而后,时间再延长,活力降低,且细胞数量也减少,这是因为酶作用需要合适的温度,温度过高,酶会失活.

图2 酶作用时间对原生质体数量与活力的影响
2.3 离心速度的影响结果
离心可使酶解液中的细胞沉淀下来,便于收集原生质体,但是离心速度过大,离心力会影响细胞活力[8].实验1.3.4通过不同转速的离心得到的原生质体结果如表3,在900 r/min 时,原生质体数量达15.8×104cells/g,而细胞活力只有72%,在离心速度600 r/min时,细胞活力达93%,但在700 r/min 、800 r/min时细胞活力与最大值差别不明显,而且此时细胞数量接近15.8×104cells/g最大值.提示取700 r/min 、800 r/min转速比较合适.

表3 离心速度对原质体产量与活力的影响
2.4 甘露醇浓度的影响结果
甘露醇与洗涤液混合使用,通过影响酶对细胞的渗透,影响原生质体的分离效果[9].实验1.3.4甘露醇的影响结果如图3.在甘露醇使用浓度0.6 mol/L时分离的原生质体细胞表现为大而圆,透光度好,生命活力较大,获得的数量最多.而细胞活力在甘露醇使用浓度0.6-0.8 mol/L之间,都较高,且表现平稳,在0.4 mol/L和0.9 mol/L时,无论分离的数量还是活力都下降.
2.5 pH值大小的影响结果
酶的活性对pH 值很敏感,从而产生对酶解效果的影响[10].同样的实验材料经不同pH值的酶液处理后,分离的原生质体数量和活力表现明显差异(如图4),pH值在5.5-6之间时,都有较好的分离效果,活力和数量都达到最高值.提示,混合使用纤维素酶和果胶酶时pH值调控在5.5-6之间最好.

图3 甘露醇对原生质体分离数量与活力的影响
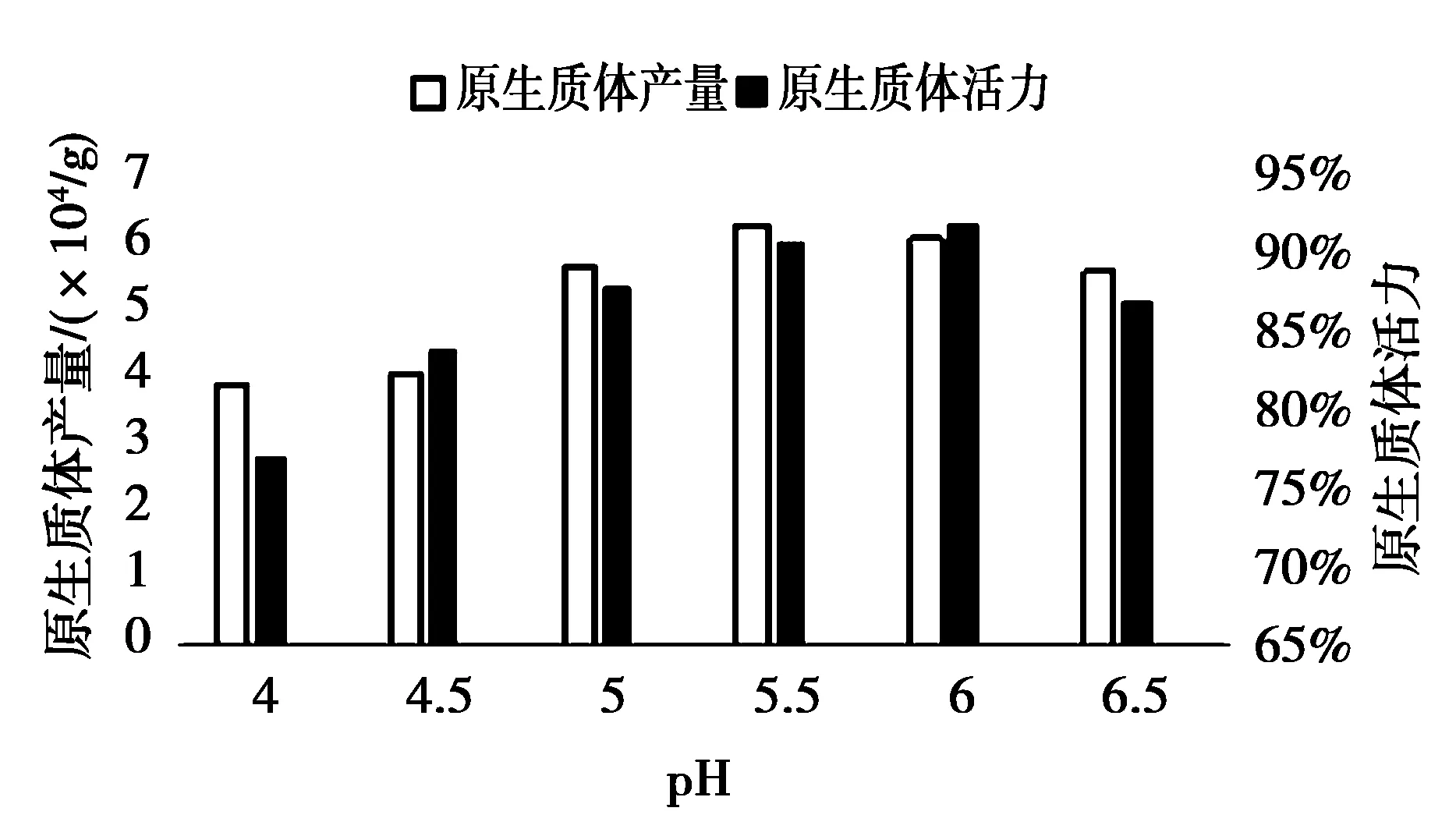
图4 酶液pH值对原生质体分离的影响
3 结论与讨论
体外培养,细胞要达到一定数量,彼此影响,才容易培养成功,但分离的细胞活力,也是决定培养成功与否的关键[11].足量和高活力的原生质体是后续培养的基础和保障,而原生质体的产率和活力又受多因素的影响,其中酶浓度和组合使用影响最大,酶的作用时间和pH值的影响也很显著,离心速度对分离的原生质体活力也有一定影响[12].本实验结果显示,混合使用纤维素酶和果胶酶,在纤维素酶1%、果胶酶0.5% 以1∶1组合时,原生质体产率和活力都最高,此时细胞表现出大而圆,透光度好,在这种组合条件下,采用60 min酶解时间,原生质体数量与活力最佳,如2.2对原生质体洗涤时,离心力会影响细胞活力,600 r/min时活力最大,随着离心力增加,活力逐渐减小,但收集的细胞数量会增加,所以,实际操作中选择中间转速,可以兼顾原生质体产量和活力.
酶解液的pH值通过影响酶的活力和通透性,从而影响原生质体的分离,图4显示出,混合酶作用pH值在在5.5-6之间时,原生质体产量和活力最佳.
花生芽下胚轴原生质体分离条件的优化,为花生芽下胚轴原生质体培养奠定了基础,本实验还会通过正交实验继续探讨多因素多水平对花生芽下胚轴原生质体分离的影响.
通过植物细胞培养高效获得特殊细胞成分,已在生物领域和医药领域取得很多的成果[13].从培养的花生芽细胞中提取白藜芦醇,会比从花生芽中提取节省大量的时间和养殖空间,提高生产效率,而且原生质体的分离,还会为花生的细胞融合、创造多产白藜芦醇花生品种奠定技术基础.
