植物多酚与蛋白质互作机制表征方法研究进展
2019-07-24李春翼田勇杨雅轩李苇舟赵吉春李富华明建
李春翼,田勇,杨雅轩,李苇舟,赵吉春,2,李富华,2,明建,2*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆,400715)
多酚化合物是植物细胞中一种具有苯环上连接多羟基基团结构的化学物质统称。由于多酚化合物对人体健康有一定的促进作用,特别是在预防慢性疾病方面具有较好的效果[1],已成为食品营养学研究的热点。科学研究证实,多酚化合物的多羟基能与蛋白质、多糖、生物碱、微生物、金属等结合[2-4]。在食品加工和人体消化过程中,多酚化合物能与蛋白质大分子发生相互作用,进而影响2类物质的功能活性和结构特征。因此,本文综述了多酚与蛋白质相互作用机制以及表征方法,以期为多酚/蛋白质复合体系在食品工业中的应用提供理论依据。
1 植物多酚与蛋白质相互作用机制
多酚与蛋白质相互作用通过可逆或不可逆的2种方式形成。多酚与蛋白质之间可逆相互作用主要是由氢键、疏水相互作用、静电相互作用或范德华力等非共价作用力形成[5-7];多酚与蛋白质的不可逆相互作用是由共价键作用力形成[8-9]。
1.1 非共价相互作用机制
研究证实,植酸和牛血清白蛋白(Bovine albumin, BSA)相互作用的结合力主要是静电[5]。β-乳球蛋白(β-lactoglobulin, β-LG)与芦丁(Rutin,R)相互作用主要是氢键和疏水相互作用[6]。范德华力和氢键在黄芩素与酪氨酶结合中起到主要作用[7]。多酚与蛋白质相互作用的非共价机制如图1所示[10]。
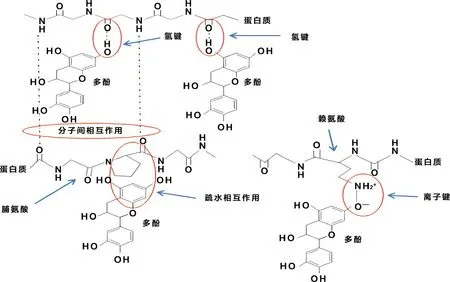
图1 多酚与蛋白质非共价相互作用机制[10]Fig.1 Mechanisms of non-covalent interactions between polyphenols and proteins
1.2 共价相互作用机制
共价相互作用是多酚与蛋白质相互作用中最重要的方式,因为它不可逆地影响2类物质的性质。PRODPRAN研究发现多酚与肌原纤维蛋白发生共价交联,使游离氨基含量较大程度地降低与肌球蛋白重链(myosin heavy chain, MHC)的条带强度,证实了多酚对大鲷鱼肌原纤维蛋白性质产生较大的影响[8]。SUI[9]也证实了花青素与大豆蛋白之间共价键的存在。目前,普遍认为多酚与蛋白质共价相互作用机制主要是邻醌形成机制:多酚化合物由于其高度反应性而易被氧化或自动氧化生成相应的邻醌或半醌,然后进一步与蛋白质的侧链赖氨酸或半胱氨酸残基等共价结合[11]。图2为多酚与蛋白质共价相互作用机制示意图[12]。
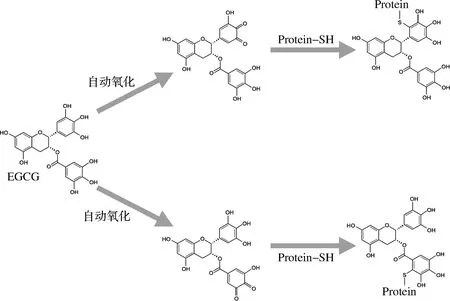
图2 EGCG通过自动氧化与蛋白质半胱氨酰巯基结合的机制[12]Fig.2 Proposed mechanism for EGCG binding to a protein cysteinyl thiol group through autoxidation
2 植物多酚与蛋白质互作机制的表征方法
由于多酚与蛋白质相互作用非常复杂,解析其作用机制必须借助光谱、质谱、显微等技术。通过获得的特征参数如特征光谱系数、结合常数、亲和力指数及空间结构变化等[13],解析多酚与蛋白质之间的互作机制。本文从光谱学、波谱学、量热技术、结构化学和其他技术对植物多酚和蛋白质互作机制表征的方法进行了分类阐述。
2.1 光谱学技术
2.1.1 荧光光谱法
荧光光谱法广泛应用于多酚与蛋白质相互作用的研究中,其中荧光猝灭法是确定多酚与蛋白质相互作用结合位点数与结合常数的一种简单适用技术手段[14]。由于苯丙氨酸(Phe)的量子产率很低,酪氨酸(Tyr)能被电离或在靠近羧基、氨基时其荧光几乎全部猝灭[15]。因此,一般利用色氨酸(Trp)为荧光探针来研究蛋白质分子的构象以及与小分子/阿魏酸(FA)/表没食子儿茶素没食子酸酯(EGCG)之间的相互作用。酪氨酸酶的荧光强度随着黄芩素的添加而减弱,猝灭类型为静态和动态猝灭[7]。3种多酚对β-LG荧光强度的淬灭能力为EGCG>绿原酸(CGA)>FA[15]。
2.1.2 傅里叶变换红外光谱法(fourier transform infrared spectroscopy, FT-IR)
蛋白质酰胺带的红外光谱可提供其二级结构信息,特征吸收带主要有酰胺I带、酰胺II带和酰胺III带,因酰胺I区域信号强而被广泛使用[17]。酰胺I带能给出蛋白质的α-螺旋(1 650~1 658 cm-1)、β-折叠(1 610~1 640 cm-1)、β-转角(1 660~1 695 cm-1)和无规卷曲(1 640~1 650 cm-1)等多种结构信息[18],其红外吸收峰的变化反映了蛋白质特定二级结构的变化。SUI研究认为大豆蛋白与花青素复合后[9],β-折叠含量显著下降,而β转角和无规卷曲含量显著增加,表明β-折叠转变为β-转角和无规卷曲。ZOU研究认为玉米醇溶蛋白(zein)与单宁(T)复合后[19],使蛋白在1 657 cm-1处的吸收峰与T在1 614 cm-1处的吸收峰发生了重叠,并且在3 356 cm-1处出现了新的吸收峰。
2.1.3 拉曼光谱法
拉曼光谱[20]因其具有简单、快速、可靠的优点,被广泛用于食品的分析检测中,其本质上属于分子光谱,拉曼谱线的长度、数目和位移大小与样品分子的振动和转动相关,因此拉曼光谱可获得分子的振动和转动信息,为物质鉴定及结构研究(如红外光谱)提供补充信息。LIU研究发现表面活性剂鼠李糖脂和复合物的拉曼光谱均观察不到较明显的峰[21],而姜黄素(curcumin, Cur)在1 625,1 599,1 428,1 316和1 248 cm-1处出现强峰,白藜芦醇在1 628,1 602,1 348,1 303,1 261,1 207,1 154,995 cm-1处有峰出现,这可能是由多酚浓度减少或者多酚与周围基质的相互作用引起的。XU等研究发现三价铁(5 μmol/L)的添加使丝蛋白(silk fibroin, SF)酰胺I带的峰值由1 660 cm-1变为1 670 cm-1[22]。当EGCG存在时,SF酰胺I带的峰值不受三价铁的影响,维持在1 660 cm-1处。
2.1.4 圆二色谱(circular dichroism, CD)
圆二色性是由左右圆偏振光吸附的差异引起的,在测量时,波长的函数为二色性时即可得到圆二光谱,蛋白质的远、近紫外CD谱可分别用于观测蛋白质二、三级结构变化[23-24]。β-LG与多酚结合后其二级结构由α螺旋向β结构转变,伴随着β-转角和无规则卷曲的轻微增加[16]。GUO等研究发现当黄芩素与酪氨酸酶的摩尔比为4∶1时[7],α-螺旋的含量下降了3.67%,β-链的含量增加了3.33%,而β-转角和无规线圈则无明显变化。
上述4种表征方法的优缺点及应用见表1。
2.2 波谱学技术
2.2.1 核磁共振光谱法(nuclear magnetic resonance spectroscopy, NMR)
NMR通过检测分子结构中标记的碳元素的化学位移,直接表明多酚与蛋白质是否发生结合作用或间接表明相关构象的改变[27]。多酚-蛋白质相互作用的所有结合位点都与特定NMR峰相关,13C-NMR为蛋白质配体之间竞争位点特异性分析研究的有力工具,NMR可精确识别结合位点信息,解释相互作用机理,分析相互作用构效关系,但也存在着检测灵敏度较低、需样量大、易受溶剂影响、对样品浓度和稳定性要求较高、图谱解析复杂等问题[28]。DELIUS[29]研究发现EGCG和表儿茶素-3-没食子酸酯(ECG)的半最大结合常数BC50分别为0.2和0.3 μmol/L,与唾液黏蛋白的结合力最强,其余4种多酚与黏液蛋白的结合力大小为:表没食子儿茶素(EGC)>表儿茶素(EC)>没食子酸甲酯(EG)>R。
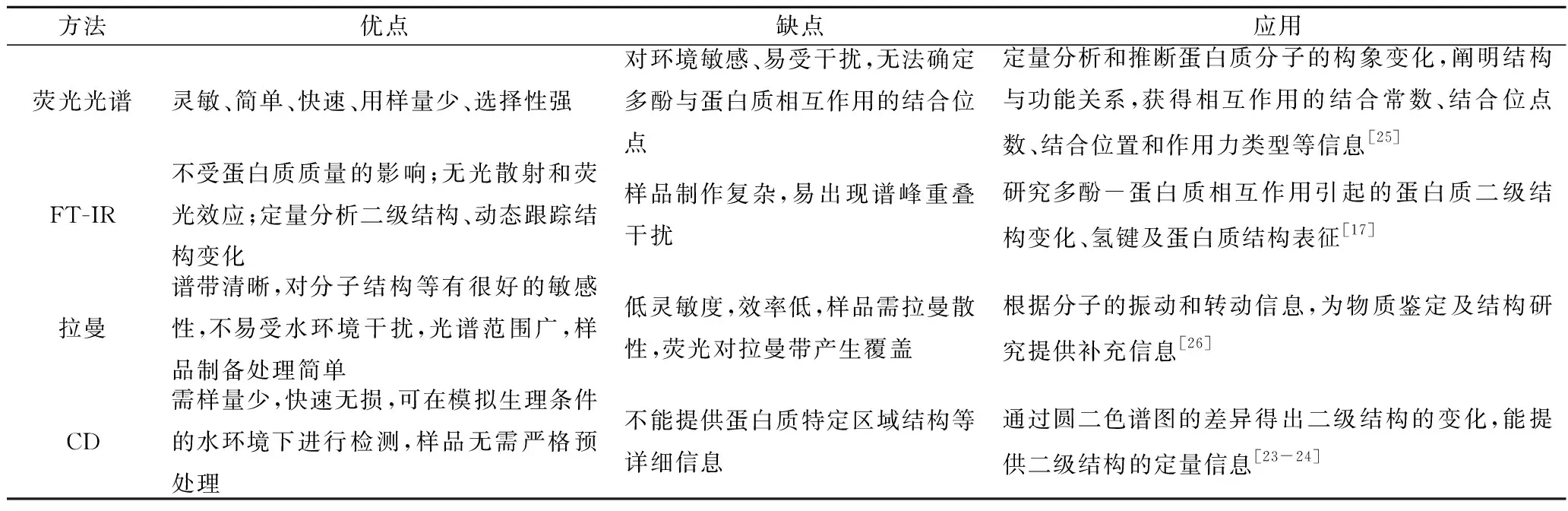
表1 多酚与蛋白质相互作用常见表征方法的优缺点及应用Table 1 Advantages, disadvantages and applications of common characterization methods of interaction between polyphenols and proteins
2.2.2 表面等离子共振(surface plasmon resonance, SPR)
SPR的原理是根据表面等离子体与消逝波发生共振,表面介质折射率不同会引起共振波长、共振峰位置以及共振角的不同,从而实现待测物的检测。SPR测定能够提供分子间相互作用的亲和常数和反应动力学,以及分子溶液中的活性浓度,且SPR具有高选择性,实时检测,需样量少,不需标记反应物,灵敏度高等优点,但商业化的仪器成本较高,检测极限较高,吞吐量较低[30-31]。其工作原理如图3所示[32]。
PARK等[33]使用SPR研究了从构树中提取的多酚化合物与冠状病毒蛋白酶动力学结合参数,结果表明木犀草素A显著地增加了SPR传感,且呈现剂量依赖效应。
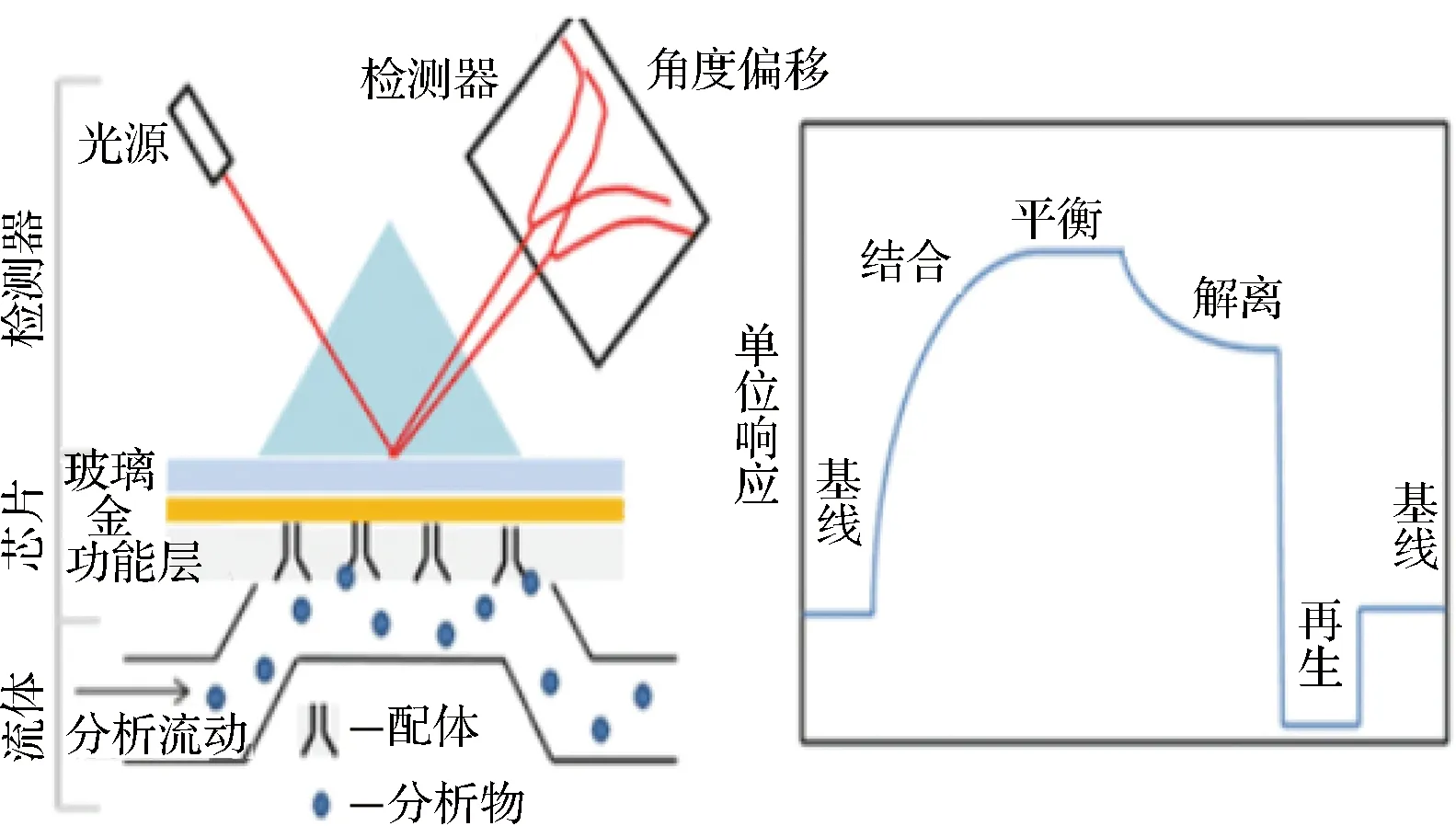
图3 SPR仪器的原理(左)和典型的SPR传感图(右)[32]Fig.3 The principle of SPR instrument (left) and typical SPR sensorgram showing the steps of an analytical cycle (right)
2.3 量热技术
2.3.1 等温滴定量热法(isothermal titration calorimetry, ITC)
ITC主要用于检测多酚与蛋白质相互作用过程中的热力学变化,可得到如亲和力、熵、焓、比热容以及化学计量学的信息,ITC可以直接和定量测量多酚与蛋白质之间的相互作用及其对多酚/蛋白质结构的影响[23]。其灵敏度高、重复性好,为在线无损检测,可一次性测定所有结合参数,不受沉淀影响,但加热效应弱、测试耗时、需样量大,难以确定大粒径蛋白质结合位点[34]。KASPCHAK等[5]探讨了加热和不同离子强度条件下BSA与植酸、T的相互作用,发现植酸与BSA相互作用主要受静电力支配,随着离子强度的增加,两者的结合下降,而温度表现出相反的效果;T与BSA的结合随着温度的增加而增加,离子强度的下降而增加。
2.3.2 差示扫描量热法(differential scanning calorimetry, DSC)
热分析被广泛用于聚合物的表征,当体系放热、吸热或者热容量发生改变时,DSC能获得涉及到的物理化学变化定性或定量信息,获得动力学数据。DSC分析具有灵敏度高,操作简单快速,适用性广,样品使用量少、无需前处理等优点,但也存在着成本高,当样品量少、材料不均匀时不能很好代表整体[35]等问题。SUN等[36]分别从3种茶(绿茶、黑茶和乌龙茶)中提取多酚,并将其加入到猪胰α-淀粉酶(PPA)中,DSC结果表明,3种茶多酚的加入使PPA的ΔH和变性温度降低,且随着茶多酚浓度的提高,PPA的热稳定性下降。对于8种多酚标品,T、ECG、EGCG和茶黄素-3,3’-二乙醇酸盐能使PPA的ΔH和变性温度变小,而茶黄素、茶黄素3’-没食子酸酯、EGC和EC对PPA的ΔH和变性温度无明显影响。
2.4 结构解析技术
2.4.1 原子力显微镜(atomic force microscope, AFM)
AFM是在扫描隧道显微镜基础上研制而成的一种扫描探针显微镜,通过探针与被测样品之间的微相互作用(原子力)获得物质超微结构及表面信息,进而对样品表面结构进行观察。AFM不仅可以测定物质在原子或分子水平上的表面特征,而且可以测定极微弱的相互作用(皮克牛顿/pN级),研究分子间的相互作用,常用于表征多酚与蛋白质的相互作用。AFM能提供三维表面图,样品制备简单、无需覆盖导电薄膜,成像和力分辨率高,但成像范围小、速度慢、受探头影响较大[37-38]。SUN等研究发现当Cur加入到zein与虫胶的复合颗粒中时[39],在复合颗粒的AFM图像中观察到明显不同的形态,三元体系表现出一种含多个直径范围(0.64~1.89 μm)的微球网络结构,表明Cur掺入形成了形状不规则的大尺寸聚集体。
2.4.2 扫描电子显微镜(scanning electron microscope, SEM)
目前SEM分辨力为6~10 nm,通过电子束射到样品表面产生次级电子,次级电子富集后转变成电信号,从而得到表面结构的立体扫描图像、微观形貌放大像、表面组成分布、晶体的晶向和晶格常数、发光性试样的结构缺陷等。在进行SEM观察时样品制备容易,耗时少,并可做综合分析,放大倍数范围广,场深大。但SEM的分辨率有限[40-41]。T与BSA的复合物是具有良好组织结构的大团聚体,经煮沸后呈现无孔隙穿孔的结构;而植酸-BSA复合物组织结构较差,呈现不均匀、脆的形态[5]。
2.4.3 激光扫描共聚焦显微镜(laser scanning confocal microscopy, LSCM)
LSCM[42]是一门20世纪末发展起来并逐渐得到广泛应用的技术,可对固定的组织或活体样本进行亚细胞水平结构分析。相较于常规的光学显微镜,LSCM的主要特点是通过共焦光学消除不需要的焦点外散射光,增强样品的焦点内区域的对比度。CLSM具有较高精度,能够3D成像,噪声比得到改进,且对试样无特殊要求,通过光散射减少图像模糊性,缺点是分辨率较SEM低,成本高[43-44]。ZOU等研究发现,在zein-单宁复合颗粒制备的乳液中能够观察到油滴周围的界面蛋白质网络[19]。
2.5 其他技术
2.5.1 分子对接
分子对接[45]是一种通过计算,从而实现模拟分子间相互识别的方法,可确定配体与靶结合位点的结合构象和最佳位置、方向。刚性对接速度快,柔性对接构象可转换,但难以选择正确的结合位点,对接软件的准确性不够,匹配算法和评分方案较难确定,且刚性对接缺乏实际应用,柔性对接耗时较长,需计算吞吐量[46]。R与β-LG有2个最可能的结合位点,位点1位于β-LG的内腔,主要作用力为疏水相互作用;位点2则位于边缘,具体示意图如图4所示[6]。LI等[47]为深入探讨4种黄酮类化合物(芹菜素、柚皮苷、山奈素和金雀异黄素)与β-LG的相互作用,发现β-LG与疏水配体有3个结合位点,因位点2生成的构象最稳定且能量最高,因此位点2被认为是β-LG与配体结合的最适位点。
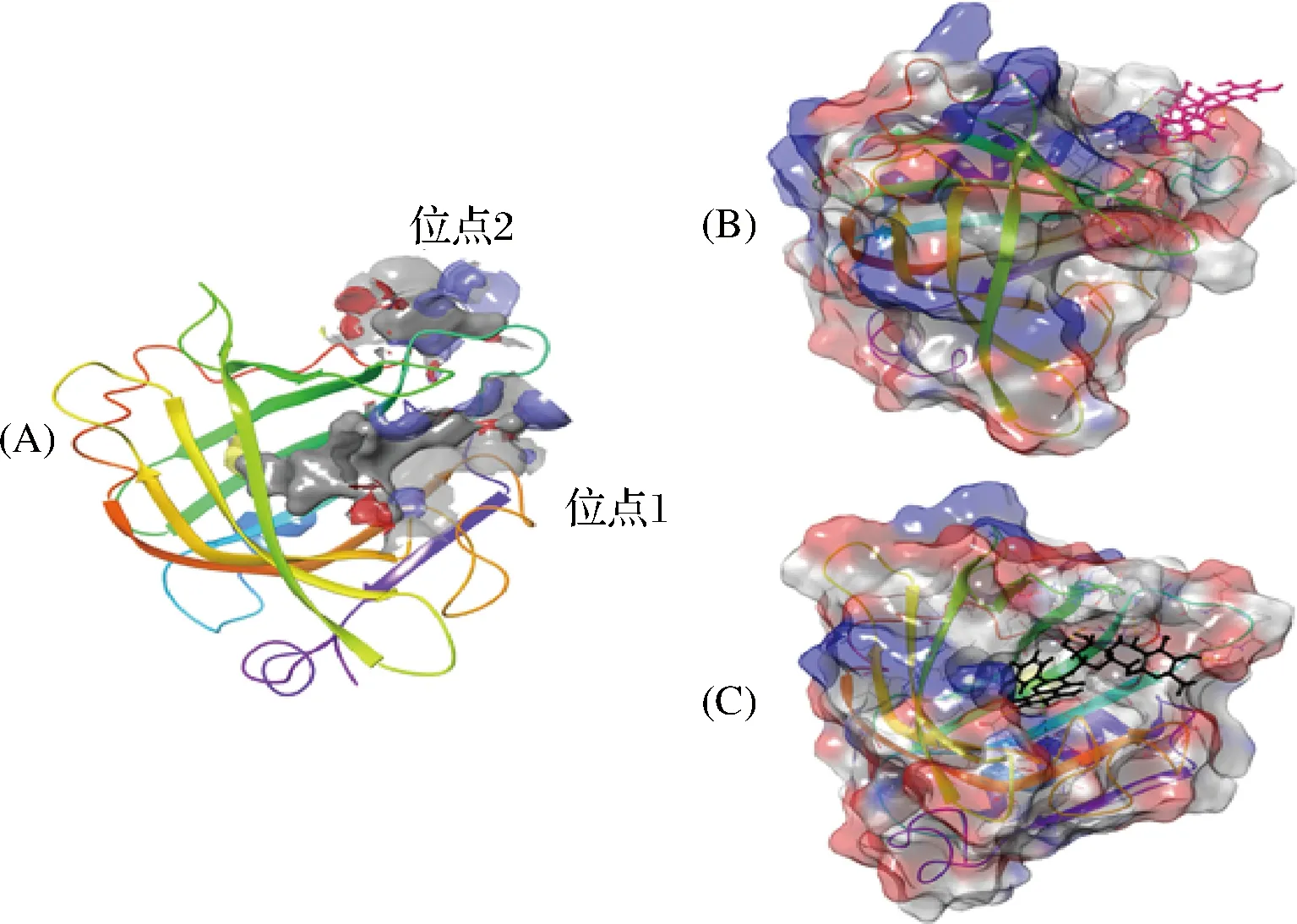
A-利用SiteMap预测结合位点1和2;B-位点2的曲面表示;C-位点1的曲面表示[6]图4 R与β-LG的分子对接Fig.4 Molecular docking of rutin with β-LG
2.5.2 分子动态(molecular dynamics, MD)模拟
分子动态模拟[48]能在原子水平上获取蛋白质的结构信息,且具有瞬时清晰度,能够得到构象变化、配体结合以及蛋白质折叠的信息。此外,分子动态模拟还可在原子水平上预测干扰(突变、磷酸化、质子化或配体的添加或去除)对生物分子的影响。缺点是识别最相关、最重要的信息具有挑战性,在模拟过程中共价键不会形成和断裂,因此应小心设置[49]。AL-SHABIB等研究R与β-LG互作的动力学性质[6],发现配体的均方根偏差(root mean square distance, RSMD)和旋转半径均表现为初始阶段的数据波动,最后达到稳定。可能是由于R进入β-LG的疏水腔引起了相应的数据起伏,当稳定的复合物形成时,数据则达到稳定状态。R与β-LG中的Glu62、Asp85和Asn90形成氢键,与Leu39、Val41和Ile84形成疏水相互作用。ZHANG等[50]研究7种黄酮类化合物(白杨素、山奈素、非瑟酮、高良姜素、染料木黄酮、槲皮素和芹菜素)与细胞周期蛋白依赖性激酶6/细胞周期D(CDK6/cyclin D)形成的复合物系统的稳定性时,发现前6种多酚的RSMD均小于0.35 nm,即适用于MD模拟分析,其中非瑟酮、槲皮素以及三奈素的RSMD(小于0.05 nm)波动均小于其他多酚。此外,芹菜素与蛋白形成的氢键数量高于其他多酚。3’,4’,7-三羟基黄酮(M15)与CDK6/cyclin D的MD模拟图如图5所示[50]。
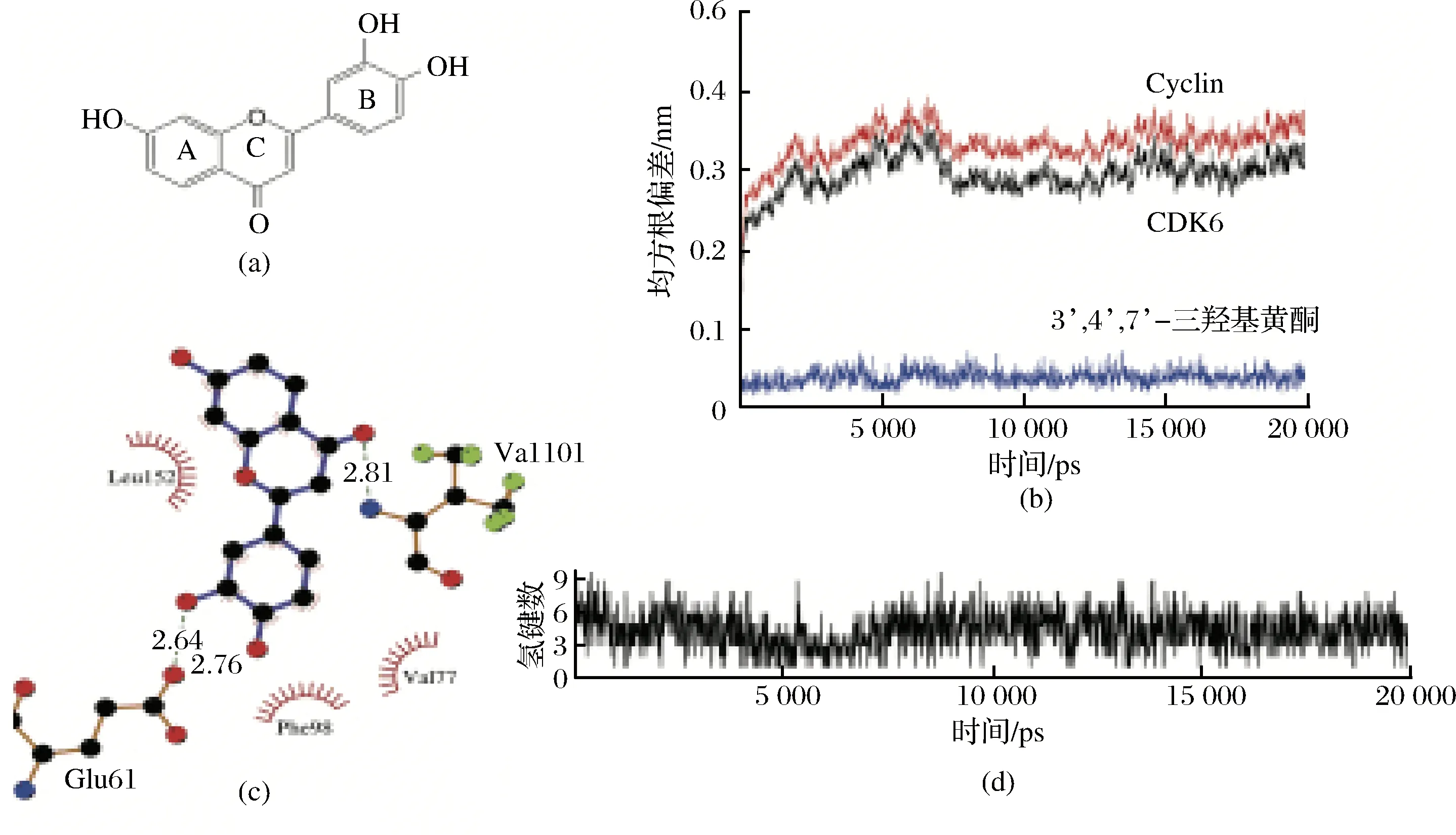
图5 (a)M15的化学结构;(b)M15-CDK6/cyclin D复合物的RMSD分布;(c)M15-CDK6/cyclin D相互作用图;(d)MD模拟期间氢键的数目[50]Fig.5 (a)Chemical structure of M15; (b)RMSD profile of M15-CDK6/cyclin D complex; (c)M15-CDK6/cyclin D interaction plot;(d)The number of hydrogen bonds during the MD simulation
3 展望
由于多酚对人体健康具有良好的促进作用,且与蛋白质大分子具有高度亲和力。深入研究多酚与蛋白质相互作用机制可以有助于改进富含蛋白质与酚类化合物的食品生产工艺条件和参数,提升产品的营养价值。鉴于目前研究多酚与蛋白质相互作用的技术手段各有优势,因此需将多种表征方法综合应用,例如,常采用荧光光谱法、紫外可见光谱和FT-IR等方法联合表征多酚与蛋白质相互作用,获得不同的物理化学参数,从不同角度解析多酚与蛋白质相互作用机制。与此同时,深入研究多酚与蛋白质相互作用还需要创新应用新的检测方法与技术,如液相色谱-质谱联用技术(LC-MS),更好地获得关于蛋白质与酚类化合物相互作用的详细信息。随着蛋白组学技术(蛋白质制备、分离、鉴定和相互作用等技术)的不断完善,必定会频繁地应用在多酚-蛋白质相互作用的研究中;同时,传统蛋白质化学技术与光谱技术的联合应用也具有较大的应用前景。
