伊拉克油田岩心酸化反应动力学参数研究
2019-07-24丁文刚
王 贵,丁文刚,唐 婧,陈 凯,陈 军
(中海油田服务股份有限公司油田生产研究院,天津 300459)
伊拉克X油田储层岩石属于含粉屑生物碎屑灰岩,岩石具颗粒结构,岩石主要成分为藻类化石、有孔虫化石、粉屑及0.031 3 mm~0.003 9 mm微晶方解石,微晶方解石具重结晶现象,溶孔为不规则状,少许铁泥质、有机质不均匀污染状分布,其中方解石含量高达95%以上,该储层岩心气测渗透率为0.1 mD~2.2 mD,最大孔喉半径0.332 μm~9.348 μm,其中微裂缝、溶孔、溶洞较为丰富,具有酸化储层改造措施物质基础。
笔者通过使用TEMCO公司CRS-500-35旋转岩盘实验仪对伊拉克X油田天然岩心进行酸岩反应动力学实验参数测定,通过对应速度常数、反应级数、H+有效传质系数等动力学参数研究,定量描述酸岩反应过程不同时刻、不同温度酸岩反应速度,确定酸的消耗时间及穿透距离,对酸压设计优化和酸液体系优选具有重要的指导意义。
1 实验部分
1.1 实验仪器及药品
实验仪器:CRS-500-35旋转岩盘实验仪(TEMCO公司)。实验材料:天然岩心(伊拉克X油田)、盐酸(分析纯)、氢氧化钠(分析纯)及酚酞指示剂等。
1.2 实验方法
1.2.1 反应动力学常数K等参数确定 碳酸盐岩油气层,其主要矿物成分为碳酸钙和碳酸钙镁。碳酸盐岩油气层通常用盐酸酸化,其酸岩反应方程式为:
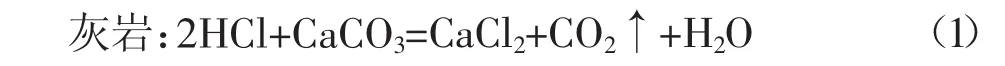
白云岩:

酸岩反应速度可用单位时间内酸液浓度降低值表示,根据质量作用定律:当温度、压力恒定时,化学反应速度与反应物浓度m次方的乘积成正比。由于酸岩反应为复相反应,岩石反应物浓度可视为定值。因此,酸岩反应速度可表示为:

式(3)中:J-反应速度,表示单位时间流到单位岩石面积上的物流量,mol/s·cm2;V-参加反应的酸液体积,L;S-岩盘反应表面积,cm2;K-反应速度常数,[(mol/L)-m·mol/s·cm2];C-t时刻酸液内部酸浓度,mol/L;m-反应级数,无因次。
对J=KCm式两边取对数,得:

因此,用lgJ和lgC作图得一直线,此直线斜率为m,截距为lgK,从而确定酸岩反应动力学方程[1]。
1.2.2 H+有效传质系数确定 酸岩反应时,氢离子的传递是对流扩散过程,根据对流扩散偏微分方程,利用边界条件求得其解析解为[2]:
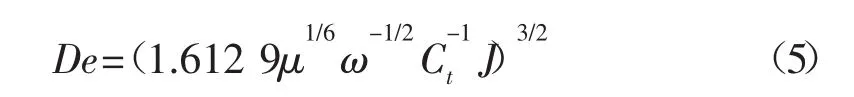
式(5)中:De-H+有效传质系数,cm2/s;μ-酸液平均运动黏度,cm2/s;ω-旋转角速度,s-1;Ct-时间为 t时酸液内部浓度,mol/L。
1.2.3 酸岩反应活化能确定 根据阿伦尼乌斯(Arrhenius)理论,反应速度常数和温度变化规律可表示为[3-5]:
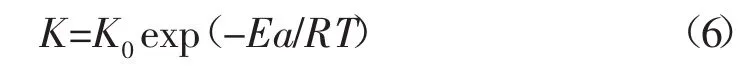
将其代入J=KCm得:

其中:K0-频率因子;Ea-反应活化能,kJ/mol;R-气体常数,8.314 J/mol·K;T-绝对温度,K。
对式(7)中 J=K0exp(-Ea/RT)Cm两边取自然对数可得:lnJ=ln(K0Cm)-(Ea/R)1/T。实验中,使用同一浓度酸液在不同温度下进行反应,得到不同温度下的反应速度,在半对数坐标中绘制lnJ~1/T关系曲线,曲线为一直线,直线斜率为-(Ea/R),截距为 ln(K0Cm),用图解法或用线性回归分析法即可确定Ea、K0值。
使用15%HCl对直径为2.54 cm的伊拉克X天然岩心进行酸岩反应实验。酸岩反应为固液非均相反应,理论上反应速度与压力无关,但是酸岩反应的生成物有CO2,低压条件下CO2在岩心表面生成并逸出,影响酸岩反应速度。根据CO2溶解方程,当压力大于7 MPa时,生成的CO2溶解在酸液中,酸岩反应成为固相液相反应,压力变化对反应速率不再产生大的影响,因此实验压力选择7 MPa。对于直径为2.54 cm的岩盘,经计算转速为500 r/min时,反应酸液的流动状态与施工排量为4 m3/min时注入液的流动状态相近,因此,实验在测定反应动力学参数时,岩盘转速设定为500 r/min。
2 结果与讨论
2.1 实验结果
使用CRS-500-35旋转岩盘实验仪,测试了15%盐酸与该天然岩心90℃、120℃、140℃温度下反应的相关参数,实验结果(见表1,表2,表3)。
使用上述实验方法,同时结合90℃、120℃及140℃的酸岩反应测试数据,对氢离子传质系数、反应动力学方程及反应活化能进行计算,结果(见表4,表5)。
2.2 结果分析
H+有效传质系数数据分析:通过实验可看出,无论是90℃,还是120℃,或者是140℃,随着酸岩反应时间不断推进,氢离子有效传质速率都是逐渐降低的,这是因为随着酸岩反应的进行,岩石表面氢离子逐渐消耗,氢离子扩散至岩石表面需要一定时间,且有部分反应产物在岩石表面富集,影响了氢离子扩散速度;随着温度上升,氢离子有效传质速率增加,尤其从120℃至140℃时,温度对氢离子有效传质速率影响更加显著。
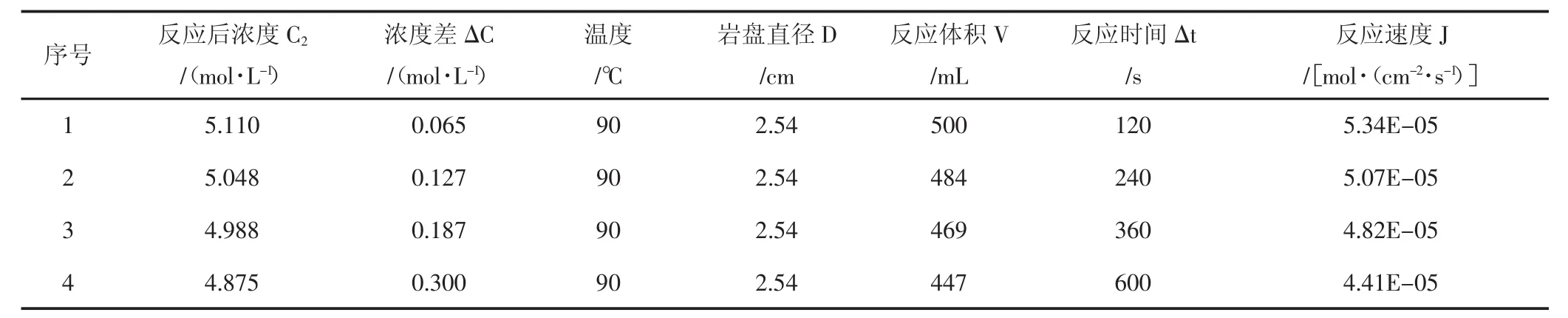
表1 90℃酸岩反应实验结果Tab.1 The date of acid-rock reaction of 90℃

表2 120℃酸岩反应实验结果Tab.2 The date of acid-rock reaction of 120℃
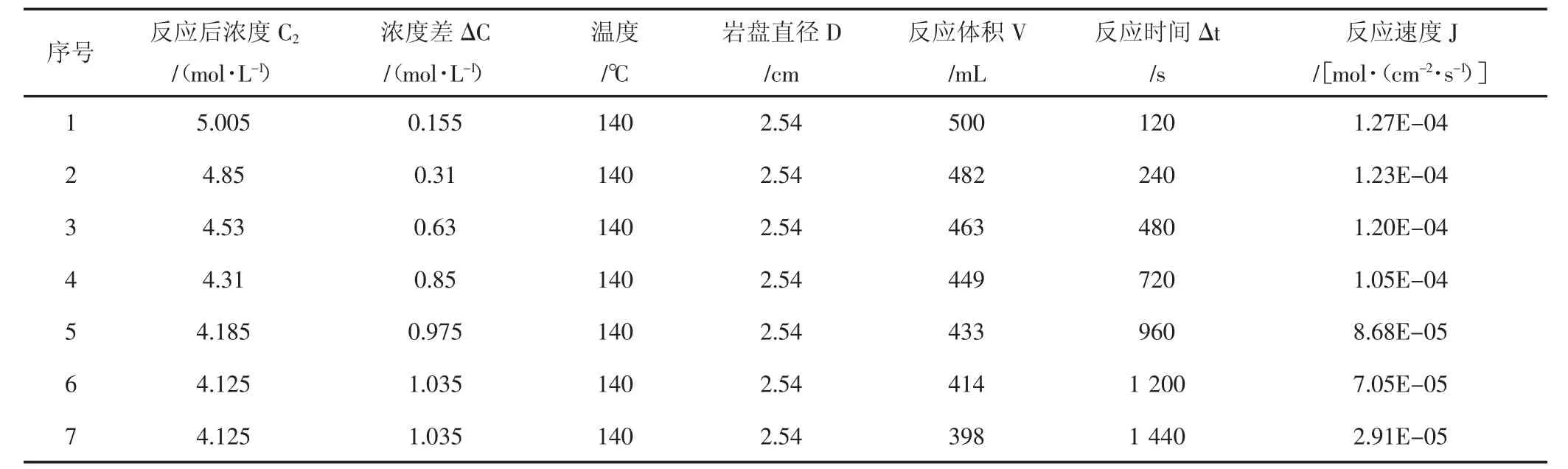
表3 140℃酸岩反应实验结果Tab.3 The date of acid-rock reaction of 140℃
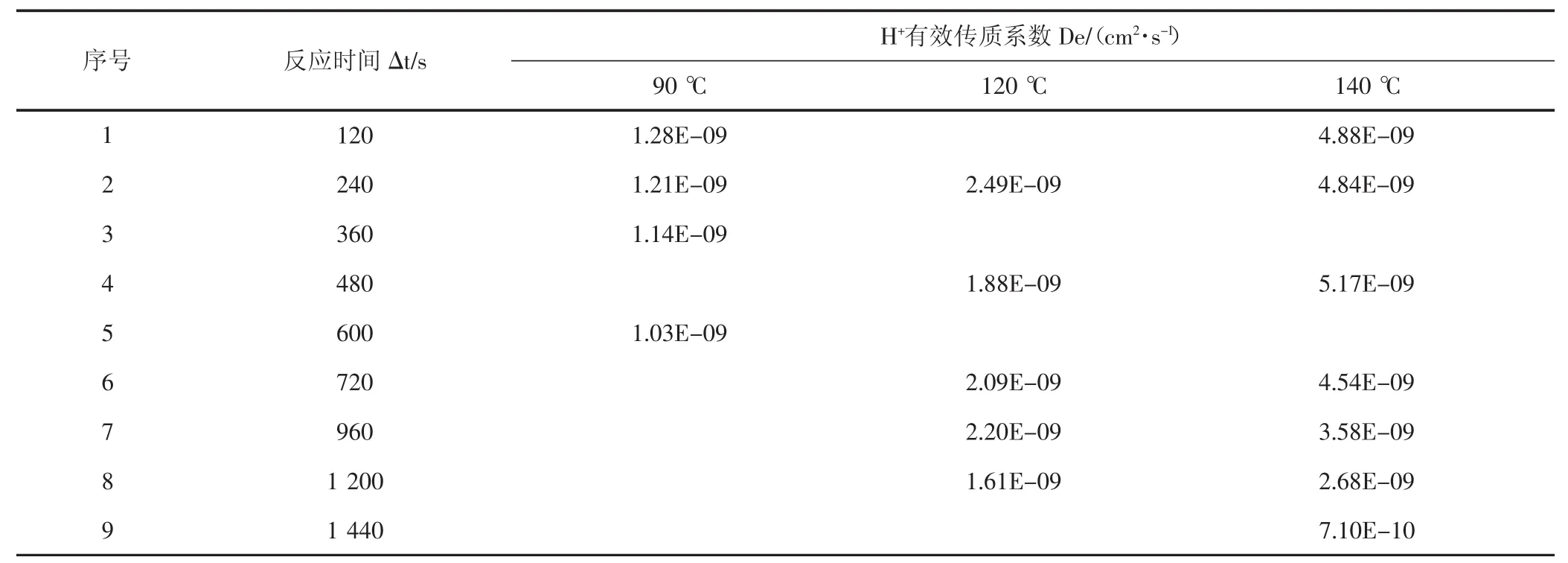
表4 H+有效传质系数Tab.4 H+effective mass transfer coefficient
反应速率常数K分析:反应速率常数K其数值与反应物浓度或压力无关,与温度、反应介质和催化剂等因素有关,是体现反应速率快慢和反应发生难易程度的动力学参数,从以上数据可知,随着温度升高,反应速率常数不断升高,反应速率加快。
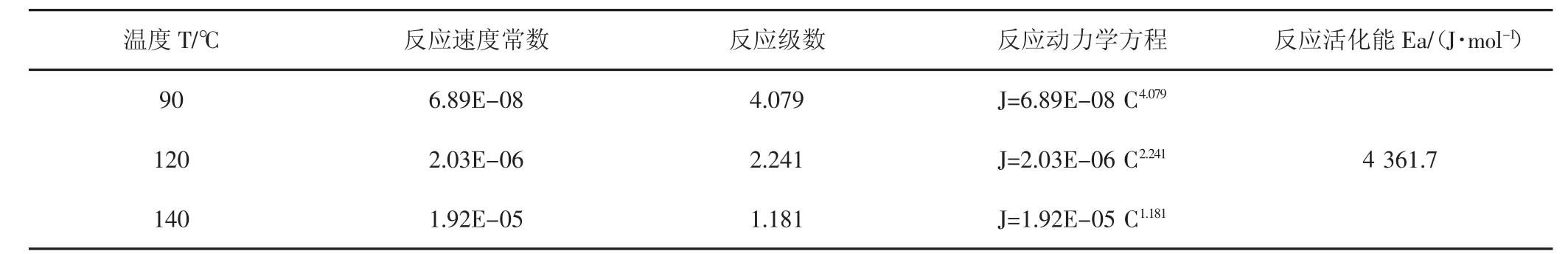
表5 酸盐反应动力学方程及反应活化能测试结果Tab.5 Acid reaction kinetic equation and reaction activation energy test results
反应级数m分析:反应级数m是反应速率方程中各反应物浓度项的指数代数和,其数值表示反应物浓度对反应速率的影响程度,从数据可知,随着温度升高,温度对酸岩反应难易的影响程度逐渐增加,而浓度对酸岩反应难易影响程度逐渐变小。
反应活化能分析:反应活化能是指活化分子的平均能量与反应物分子的平均能量之差,其大小可以体现反应速度的快慢和反应发生的难易程度。由实验结果可知15%盐酸与本天然岩心的反应活化能Ea为4 361.7 J/mol。
3 结论
(1)无论是90℃,还是120℃,或者是140℃,随着酸岩反应时间不断推进,氢离子有效传质速率都是逐渐降低的;随着温度升高,反应速率常数不断升高,反应速率加快。
(2)随着温度升高,温度对酸岩反应难易的影响程度逐渐增加,而浓度对酸岩反应难易影响程度逐渐变小;15%盐酸与伊拉克X油田天然岩心的反应活化能为4 361.7 J/mol。
