猪圆环病毒2型贵州部分流行株的全基因克隆及序列分析
2019-07-23
(贵州大学动物科学学院,贵州 贵阳 550025)
猪圆环病毒2型(Porce circovirus type 2,PCV2)为圆环病毒科,圆环病毒属的成员,是1种无囊膜单股环状负链DNA病毒,为已知的最小的动物病毒之一[1]。PCV2首先由Tischer于1974年在PK-15猪肾传代细胞系中分离获得,该病毒长期持续感染PK-15细胞,但不引起细胞病变(CPE)。PCV2具有致病性,与断奶仔猪多系统衰竭综合症(Postweaning multisystemic wasting syndrome,PMWS)密切相关,主要侵害6~12周龄断奶仔猪,以渐进性消瘦、呼吸困难急促和多系统病理损伤为主要特征,导致机体的免疫力低下或丧失,进而易引起其他病原的继发感染或混合感染[2]。20世纪90年代,PCV2感染作为PMWS病因在加拿大被报道后,世界很多国家证实有PCV2的存在和流行;我国自2000年发现猪群中存在PCV2感染以来,由PCV2感染所致的疾病被不断报道,给养猪业造成重大经济损失,严重威胁养猪业的健康发展[3]。PCV2基因组全长1 767 bp 或1 768 bp[4]。PCV2可分为 5个基因型:PCV-2a、PCV-2b、PCV-2c、PCV-2d、PCV-2e,有学者从无PMWS症状猪和有明显PMWS症状猪中均分离到了PCV-2,说明不同型PCV-2之间的毒力不同[5]。本研究对PCR检测PCV2为阳性的病料进行PCV2全基因组的克隆及序列分析,确定分离株的基因型,为贵州地区猪群中PCV2的基因分型及其变异情况提供参考,为进一步丰富贵州PCV2的分子流行病学和有效控制提供依据。
1 材料与方法
1.1 病料来自贵州省遵义、福泉、金沙、榕江、赫章等地区发病猪的组织及血样病料20份。
1.2 主要试剂PCR试剂(包括rTaq酶、dNTPs、10×PCR buffer等)、DL 2 000 Marker、pMD19-T Vector、HindⅢ、BamHⅠ 内切酶、DNA胶回收试剂、DNA/RNA Extraction Kit Ver.5.0、氨苄青霉素(Amp)、大肠杆菌DH5α等,均购自TaKaRa公司。
1.3 病料中PCV2的检测将病料研磨后液氮反复冻融3次,以12 000 r/min 离心10 min,取上清液;血样直接离心取血清。用TaKaRa MinBEST Viral DNA/RNA Extraction Kit Ver.5.0试剂盒提取核酸,利用实验室已建立的多重PCR方法对病料进行检测,多重PCR中PCV2的鉴定性引物根据GenBank中发表的PCV2毒株(登录号:KY806071)的ORF2基因设计,预期扩增片段大小为353 bp。引物序列为:PCV2-F:5’-CGCTGGAGAAGGAAAAAT GG-3’;PCV2-R:5’-AAGGGCTGGGTTATGGTATG-3’。7重PCR最佳反应体系为50 μL:金牌MiX(Green)30 μL,上、下游引物浓度均为10 μmoL/L,引物量PRRSV、PCV2、PPV、SIV各0.5 μL,PRV、JEV、CSFV各1 μL,DNA/cDNA模板PRRSV、PCV2、PPV、SIV、JEV各1 μL,PRV、CSFV各1.5 μL。反应条件为:95 ℃ 5 min;94 ℃ 45 s;54 ℃ 45 s;72 ℃ 45 s,共进行35个循环;72 ℃延伸 10 min。反应结束后取PCR产物6 μL于2% 1×TAE琼脂糖凝胶中电泳检测(110 V,35 min),用凝胶成像系统拍照记录。
1.4 PCV2全基因的扩增与克隆根据GenBank中发表的PCV2毒株全基因序列(登录号:KT719404)设计1对扩增PCV2全基因的引物。引物序列为:PCV2q-F:5’-CGGGATTCCGACCAGCGCACTTCG GCATG-3’;PCV2q-R:5’-CCAAGCTTGGAATACT TACAGCGCACTTCT-3’。其中上、下游引物中的下划线部分别是BamHⅠ和HindⅢ酶切位点,加粗部分是添加的保护性碱基,引物由英潍捷基(上海)贸易有限公司合成。采用引物PCV2q-F/R扩增检测出PCV2阳性病料的病毒核酸,预期扩增片段大小为1 767 bp。PCR扩增体系总体积25 μL:10×LA PCR Buffer 2.5 μL,dNTPs 2.0 μL,上、下游引物各1.0 μL,DNA模板2.0 μL,LATaq酶0.25 μL,用dd H2O补足25 μL。扩增程序为:95 ℃ 5 min;94 ℃ 60 s,59 ℃ 60 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。反应结束后,取PCR产物5 μL于1%琼脂糖凝胶中电泳检测(80 V,40 min),用凝胶成像系统拍照记录。将目的片段回收后与pMD19-T载体4 ℃连接过夜,连接产物转化至感受态细胞DH5α中,取100 μL均匀涂布于含有氨苄青霉素的LB琼脂培养基,37 ℃恒温箱中培养12~16 h,挑取单个白色菌落接种于含氨苄青霉素的LB液体培养基中,37 ℃振荡培养12 h,提取质粒,经PCR鉴定及BamHⅠ和HindⅢ酶切鉴定的阳性重组质粒送生工生物工程(上海)股份有限公司测序。
1.5 PCV2全基因的序列分析应用MegAlign、MEGA5.05软件对贵州PCV2 分离株全基因组序列与GenBank上已收录的国内外毒株进行比对分析,进行核苷酸同源性分析及构建遗传进化树。
2 结果
2.1 病料中PCV2的检测结果利用多重PCR对贵州遵义、福泉、金沙、榕江、赫章等地区的20份病料进行检测,结果在病料中扩增出约353 bp的特异性条带(见图1),与PCV2的目的片段相符。

图1 检测病料中PCV2扩增结果M:DL 2 000 Marker; 1:多重PCR阳性对照; 2~21:检测病料; 22:阴性对照
2.2 PCV2全基因的扩增与克隆以多重PCR检测出的PCV2阳性病料的核酸为模板,用PCV2全基因的引物PCV2q-F/PCV2q-R进行PCR扩增,结果扩增出约1 767 bp的目的条带,与预期片段大小相符(见图2)。将目的片段回收后与pMD19-T载体连接,连接产物转化至感受态细胞DH5α中,用氨苄青霉素抗性的LB琼脂平板进行阳性克隆筛选,提取质粒,经PCR鉴定及BamHⅠ和HindⅢ双酶切鉴定(见图3),获得了阳性重组质粒,将阳性重组质粒送生工生物工程(上海)股份有限公司测序。

图2 阳性病料中PCV2全基因组的PCR扩增结果 图3 PCV2全基因的双酶切鉴定结果 M:DL 2 000 Marker; 1:阴性对照; 2:遵义病料; 3~4:福泉病料; M:DL 5 000 Marker; 1:遵义病料; 2~3:福泉病料;5~6:金沙病料; 7~8:榕江病料; 9:赫章病料 4~5:金沙病料; 6~7:榕江病料; 8:赫章病料
2.3 PCV2全基因的序列分析将克隆测序成功的PCV2全基因序列与GenBank中其他已知毒株的序列进行比较,8条贵州不同地区的PCV2全基因序列长均为1 767 bp(见图3),分别命名为GZ-RJ1、GZ-RJ2、GZ-ZY1、GZ-ZY2、GZ-FQ1、GZ-FQ2、GZ-JS、GZ-HZ。8条序列间的核苷酸同源性为97.3%~99.9%,与GenBank中登录的贵州2012—2013年分离的4株PCV2分离株核苷酸序列之间的同源性为75.8%~96.4%,与PCV2a型分离株的核苷酸序列同源性为77.2%~95%,与PCV2b型分离株的同源性为74.9%~96.1%,与PCV2e型分离株的同源性为91%~94.1%,与PCV2d型分离株的核苷酸序列同源性较高,达94.3%~99.9%(见图4)。
为进一步分析贵州PCV2分离株与其他毒株在遗传进化上的关系,利用MEGA6软件建立了贵州PCV2分离株与其他国内外毒株的遗传进化树(见图5)。不同基因型的毒株各处于1个分支,此次扩增的8条贵州不同地区的PCV2全基因序列均与PCV2d型毒株处于同一个遗传进化分支,2012年分离的GZ-QZ1及GZ-RH1株也与 PCV2d型毒株处于同一遗传进化分支,而Kaiyang株与PCV2b型毒株处于同一遗传进化分支,GZ-CS1株与PCV2e型毒株处于同一遗传进化分支。

图4 PCV2全基因组的核苷酸同源性分析
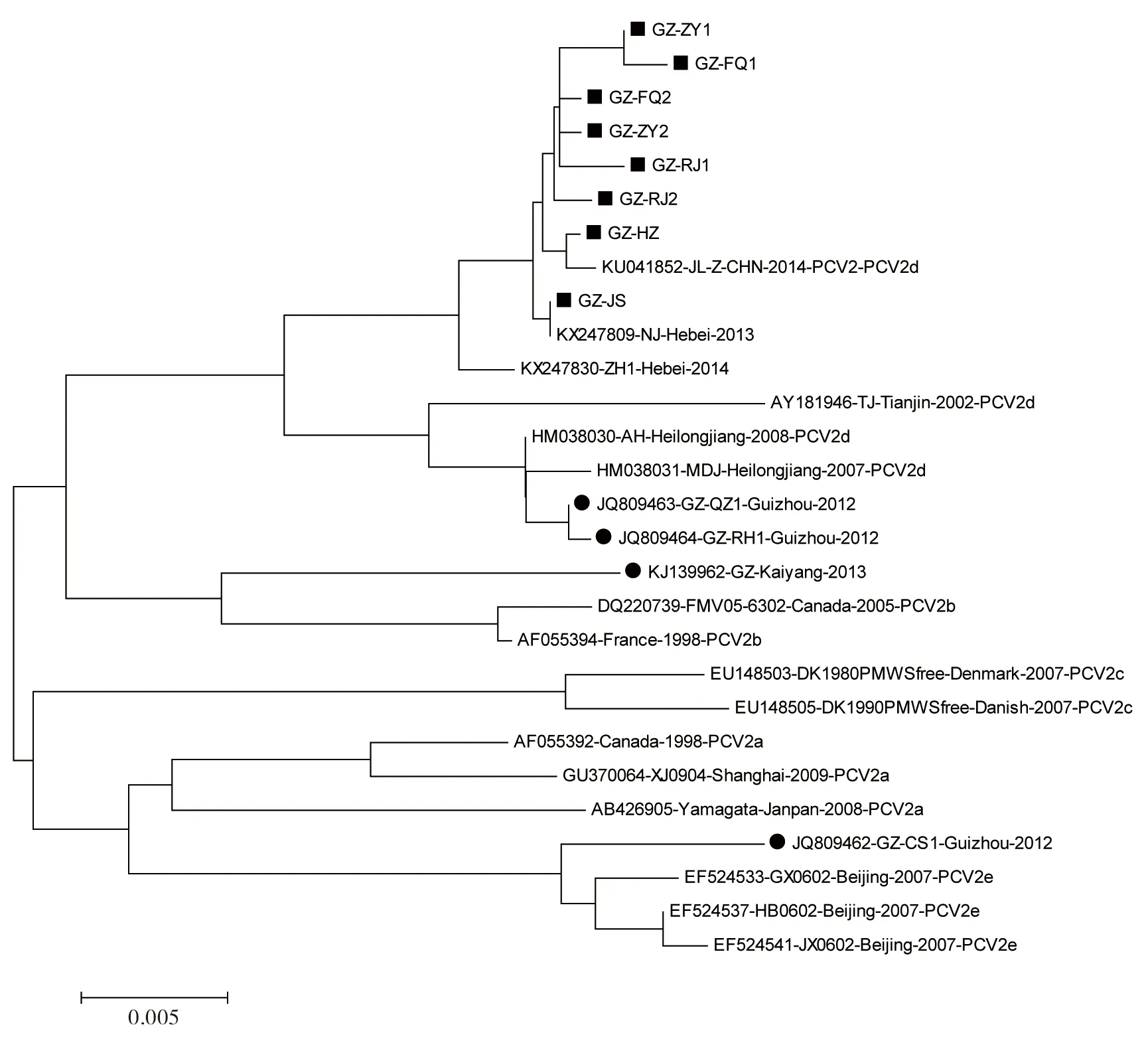
图5 贵州PCV2分离株全基因序列与国内外毒株的遗传进化树分析
3 结论与讨论
3.1猪圆环病毒病是近年来出现的影响世界养猪业的重要传染病之一,PCV2是引起该病的主要病原。PCV2的毒力虽然没有猪瘟病毒、高致病性猪蓝耳病病毒和伪狂犬病病毒强,但由于感染猪后使其免疫力降低,抗病能力下降,常出现混合感染和继发感染,还会产生严重的免疫抑制。
3.2我国于2000年首次证实国内猪群中存在PCV2感染,自此以后不断有相关研究PCV2的报道。郭抗抗等[6]对NCBI中登录的556个PCV2分离株全基因序列进行分析显示1999—2002年PCV2的优势流行毒株为PCV2a,从2003年开始PCV2b基因型逐渐成为优势流行毒株。PCV2c型毒株于1980、1987、1990年仅在丹麦有相关报道[7],PCV2d型毒株则是我国新出现的基因型[8]。刘钊[9]对来源不同的6株贵州地区PCV2毒株进行遗传进化分析,结果表明:MJBM2015、ASXX2015 株为 PCV2b 基因型,CSGS2012 株、GYYY2015 株为 PCV2a 基因型,ZYMT2015、GYXW2014 株为 PCV2d 基因型。徐国[10]等对贵州省猪血清中检测到的10株PCV-2进行全基因组克隆与序列分析,结果表明:8株为PCV2b型,2株为PCV2a型。徐镀涵[11]等为了解贵州省非免疫猪群PCV2感染情况,采用ELISA方法对贵州省7个市(州)714份血样进行检测,采用PCR方法对20头疑似断奶仔猪多系统衰竭综合症病死猪进行圆环病毒2型核酸检测,结果:PCV2感染抗体阳性率为45.94%;20头病死猪样本中检出PCV2核酸阳性18份,检出率为90.00%。
3.3本研究通过用实验室所建立的多重PCR方法对2018年贵州不同地区的临床样本进行检测,发现猪繁殖与呼吸综合征病毒、猪瘟病毒、猪伪狂犬病病毒等混合感染的情况较为多见。本次所克隆的8条贵州不同地区的PCV2全基因序列均属于PCV2d基因型,近年来贵州地区猪群PCV2d基因型的感染病例增多,而2012年分离的GZ-QZ1、GZ-RH1株也与PCV2d型毒株处于同一遗传进化分支。李涛[12]等对3株PCV2贵州流行株全基因序列分析,系统进化树结果显示:3株PCV2贵州流行株归属PCV2d分支,说明PCV2d基因型已成为贵州地区的主导基因型。
