B超和CT检查对肾上腺皮质大腺瘤的诊断价值
2019-07-23许小伍
李 滟 许小伍
随着影像技术的提高,肾上腺肿瘤的检出率有显著升高趋势,而肾上腺皮质腺瘤是发生于肾上腺皮质最常见的良性肿瘤。小腺瘤因常有明显临床特征,影像学特征明显,而大于4.0 cm的大腺瘤[1]大多临床体征不明显,常常是体检或其他原因检查无意中发现,影像表现多种多样,定位及定性诊断困难,常误诊为肾上腺或腹膜后的恶性肿瘤,且直径大于4.0 cm的肾上腺肿瘤具有较高的恶性潜能[2]。因此,笔者回顾性分析13例经病理确诊的大腺瘤,探讨B超和CT在肾上腺皮质大腺瘤中的影像表现,旨在提高对肾上腺大腺瘤的认识。
1 资料与方法
1.1 一般资料 2012年8月-2016年7月经本院B超及CT检查并经术后病理证实的肾上腺皮质大腺瘤13例,其中男8例,女5例,年龄36~67岁。临床表现2例以双侧下肢浮肿,低血钾入院,其他11例肿瘤以体检或其他检查发现,生化检查无异常,均为B超首次发现后行CT检查。
1.2 检查方法 超声使用Philips HD 11型及IU 22型彩色多普勒超声诊断仪,探头频率3~12 MHz或5~12 MHz。常用平卧位肾上腺区斜切位扫描,右肾上腺区以肝脏为透声窗,左肾上腺区以脾脏为透声窗,深吸气后屏气有助于图像显示清晰。CT采用Siemens双排或Philips16排螺旋CT机,Siemens双排扫描参数110 kV、72 mAs,旋转速度0.8 s,扫描层厚10 mm,层距10 mm,重建层厚6 mm,矩阵512×512;Philips 16排CT扫描参数为120 kV、250 mAs,旋转速度0.5~0.75 s,准直器16×1.5 mm,螺距0.938,扫描层厚5 mm,矩阵512×512。检查前30 min患者均口服水对比剂500~1000 mL,扫描范围包括双侧肾上腺及肾脏,采用高压注射器经肘静脉快速团注80 mL非离子型对比剂碘海醇(浓度为300 mgI/mL),注射速度为2.5~3.0 mL/s。首先进行双肾及肾上腺平扫,然后进行皮质期、髓质期及排泄期扫描,时间分别为30 s、60 s、180 s。
1.3 图像分析 超声及CT检查分别由超声科和影像科2名高年资医师共同完成及分析。重点观察肿瘤的直径(取病变最大长径)、形态、包膜、回声强度及均匀度,密度、边界及内部血流情况、内部成分(有无脂质、钙化、囊变、坏死、出血及纤维分隔)及与周围组织受压情况,分别在平扫、皮质期、髓质期及排泄期测量感兴趣区(ROI)的CT值(在病变最大长径层面测量)。ROI测量时应选取增强的实性部分,避开肿块边缘及其内不强化的囊变坏死区,观察供血动脉,患侧肾上腺是否显示以及对侧肾上腺形态,并与病理对照分析。
2 结 果
13例肾上腺大腺瘤均为单发,其中9例位于右侧,4例位于左侧。肿瘤直径4.0~11.9 cm,10例呈圆形或椭圆形,3例有分叶,均有包膜,周围脏器均有不同程度受压改变。2例肿块与肾上腺内肢相连,11例患侧肾上腺显示不清。对侧肾上腺形态均正常。见图1-4。
2.1 声像图表现 2例为高回声,3例为低回声,8例为混杂不均匀回声,呈等-低、等-高回声,2例病灶内可见团状强回声并后方声影。CDFI:4例内可见少许血流信号,9例无血流信号。
2.2 CT表现 3例密度均匀,10例密度不均匀,6例可检出脂肪密度,3例有钙化,位于病灶边缘,呈斑点状、弧形钙化。平扫CT值-82~43 HU,动态增强扫描呈渐进性强化,强化范围扩大,排泄期病灶强化程度减低,皮质期CT值约-76~95 HU,髓质期CT值约-74~102 HU,排泄期CT值约-81~77 HU。7例肿块内可见纤维分隔并强化,4例病灶可见供血动脉,分别为右侧肾上腺动脉、左肾动脉及腹主动脉供血,5例强化显著的肿块中央部分坏死,坏死边界不清。
2.3 病理学表现 2例以致密细胞成分为主,11例以透明细胞成分为主。5例囊变,其中1例合并出血。6例含脂质成分。1例误诊为髓样脂肪瘤,1例误诊为嗜铬细胞瘤,11例诊断为肾上腺大腺瘤。
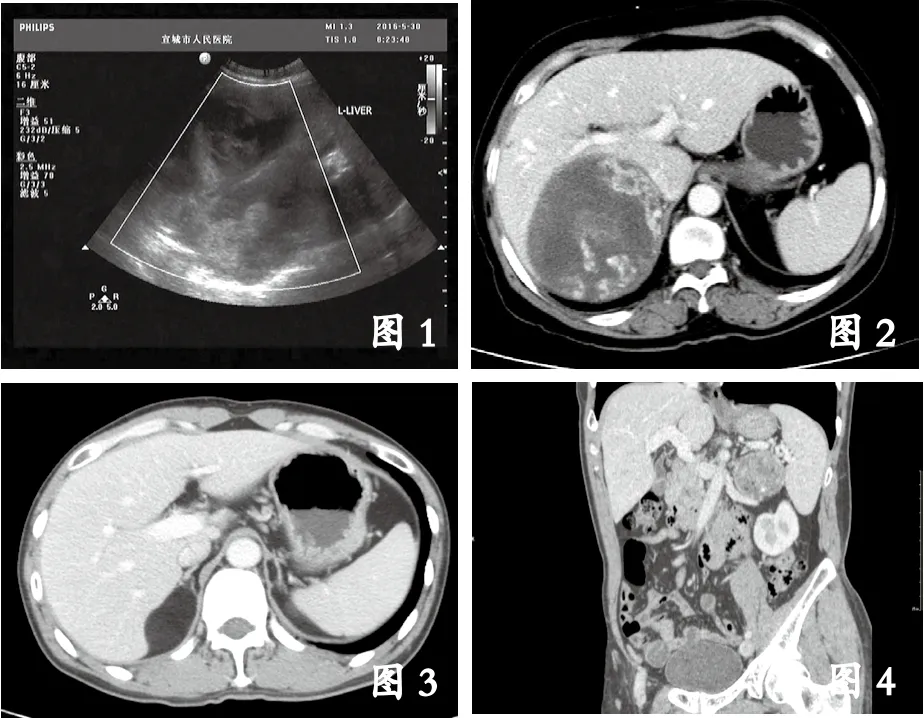
注:图1-2:女性,68岁,右侧肾上腺区混杂回声,与肝脏分界不清,CT增强示肿瘤边缘絮状显著强化。图3:男性,38岁,右侧肾上腺区域极低密度肿块,包膜轻度强化,中央部分无强化。图4:男性,55岁,冠状面重建左侧肾上腺区域不均匀中等程度强化,有脂肪分布,邻近脏器受压。
3 讨 论
3.1 肾上腺大腺瘤的诊断方法 肾上腺大腺瘤是肾上腺常见良性肿瘤,而无功能性腺瘤的失检发生率为2%~9%,既往的文献报道对于<3 cm的腺瘤具有较高的特征性,小腺瘤质地均匀,增强扫描表现为快进快出的特点,而大腺瘤发病率相对较低,以无功能性腺瘤为主,常常合并钙化、出血、囊变及坏死,影像表现多样,常误诊为其他肿瘤。在高分辨率超声、CT薄层扫描逐步应用于临床,影像学检查可清晰显示肾上腺肿瘤局部解剖关系并提供准确定位,定位诊断常不难,定性诊断误诊率较高,本组资料误诊率达到15.4%,需要引起临床工作的重视。病理上肿瘤细胞胞质富含脂肪,间质部分具有丰富血管,但是10%~40%肿瘤含有脂肪较少。本组资料均在超声检查后继续行CT检查,超声及CT检查均检出大腺瘤有完整的包膜,病灶回声均匀仅5例,不均匀占8例,声像图表现为肾上腺区域圆形、分叶状肿瘤,边界尚清,CDFI示部分肿瘤内可见少许血流信号,肿瘤较大时常有出血、坏死及囊变,姚金朋等[1]认为肾上腺大腺瘤肿瘤组织成分复杂,常表现为质地不均,本组中5例发生坏死,边界不清。本组中3例发现钙化,钙化见于肿瘤边缘,呈斑点状分布,声像图表现为高回声后方伴有声影衰减。
3.2 肾上腺大腺瘤定位诊断常与肿瘤体积大小有关 ①肿瘤体积较大时,周围脏器及血管受压移位,肿瘤与周围脏器脂肪间隙消失,周围解剖结构发生改变,增加定位诊断难度。超声具有无创、灵活,重复性强的优势,是首选的初步筛查诊断方法。单琨等[3]认为超声对肾上腺肿瘤定位优于CT,定性较低,与超声可实时、动态观察肿瘤与肝肾等实性脏器活动的关系有关,但是腹膜后肿瘤生长固定,很难与肾上腺来源肿瘤区分开来。本组中1例右侧大腺瘤(见图1)超声误诊为肝脏来源肿瘤,但CT扫描发现右侧肾上腺结构消失,肝脏呈弧形受压改变,CT扫描通过增强及多方位重建可以清晰判断肿瘤的来源,利于肿瘤定位、定性诊断。有学者[4]认为测定肿物脂肪含量可鉴别肾上腺肿瘤的良恶性,腺瘤内含有较多的类脂颗粒或空泡变性,细胞内脂质含量可通过B超及CT评估,在肿瘤体积较小时特异度及敏感度较高,肿瘤体积较大时特异度及敏感度低,与其他肾上腺肿瘤有重叠交叉。本组中6例检出脂肪成分,但部分肾上腺皮质腺癌也可以含有脂肪成分,仅依靠脂肪成分来定性可能出现误诊。平扫CT值<10 HU对于大腺瘤诊断具有高度特异性及敏感性,甚至有学者提出平扫CT值<10 HU可以诊断肾上腺腺瘤,但是本组中1例误诊为髓样脂肪瘤,病灶大部分呈脂肪样密度改变,而超声提示高回声结节(见图3),术后病理提示细胞成分以致密细胞为主,是否为特异性改变还需要通过大样本核实。②大约30%的大腺瘤是乏脂性的,本组资料与之符合。定性需要通过增强扫描,肿物增强通常表现为轻度均匀或不均匀强化,也可表现为周边部强化,髓质期强化程度增大,且向中央部分延伸,与肿瘤内富含血窦相关,平衡期强化程度减弱,强化范围进一步扩大,部分病灶且可见散在纤维分隔影,本组中8例病灶出现此征象,与王夕富等[5]认为的肾上腺腺瘤造影剂廓清速度高一致,作者认为此征象为较特异征象。Koo HJ等[6]认为15 min延时扫描绝对造影剂廓清率≥60%及相对造影剂廓清率≥40%作为肾上腺大腺瘤诊断重要方法,其敏感度及特异度达到84%、92%和79%、75%,但是选取病灶的ROI面积要超过肿块的1/2,会增加肾上腺大腺瘤的特异性及敏感性。个别腺瘤由于透明细胞内无脂质,强化特点类似肾透明细胞癌强化方式[7],本组中1例病灶平扫CT值达40 HU,在动脉期明显强化,强化阈值超过50 HU,平衡期强化程度明显减低,误诊为嗜铬细胞瘤,与肾上腺腺瘤内富含血管有关,MR化学位移成像可能对腺瘤含脂特征有优势,可有助于大腺瘤的诊断。③本组中4例病灶行CTA血管重建,可清晰发现肿瘤的供血动脉及灶内小血管。笔者发现肿瘤的大小可能与血管生成有直接关系,特别是体积较大血供来源表现多样化,除肾上腺动脉直接供血外,尚存在其他供血动脉,本组中可见肾动脉、腹主动脉参与瘤体供血。本组中2例病灶直径大于6.1 cm的瘤体均出现肾上腺外供血动脉,可能与肿瘤生长过快,肾上腺动脉本身供血不能满足肿瘤的生长相关。
总之,肾上腺大腺瘤的影像表现为单侧单发,形态规则。在诊断肿瘤的大小、形态及包膜,B超与CT表现相仿,但CT对钙化、肿瘤内分隔及强化特点有优势。超声灵活、无创作为肾上腺腺瘤的首选,但瘤体较大且与邻近组织关系密切的病变定位、定性难度较大。而平扫CT值小于10 HU,增强扫描呈皮、髓质期充填样、渐进性、不均匀强化,平衡期强化减弱,CT可明确肿瘤的供血情形。有序、合理利用超声及CT检查,可以提高肾上腺大腺瘤的准确率。
