以分泌性中耳炎为首发症状的肉芽肿性多血管炎的临床分析
2019-07-23郝香月郑茵易英龙孝斌
郝香月 郑茵 易英 龙孝斌
肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA )既往称为韦格纳肉芽肿(Wegener’s granulomatosis,WG),是一种免疫介导的坏死性肉芽肿性血管炎,主要累及上、下呼吸道和肾脏。该病临床表现多样,典型的GPA常以头颈部症状为首诊表现。以耳部为首发症状者约占33%[1],且症状缺乏特异性,故易被耳鼻喉科医生误诊、漏诊而延误治疗。现对近年来诊治的2例以分泌性中耳炎为首发症状的肉芽肿性多血管炎的临床资料分析报告如下。
1 临床资料
病例1,患者男,40岁,因“左耳听力下降伴耳鸣2月余”于2012年5月22日入院。患者入院前2个月无明显诱因出现左耳听力下降,伴间歇性低调耳鸣。查体见左耳鼓膜完整、增厚、淡红色充血;纯音测听示左耳言语频率平均气导听阈为43 dB HL,气骨导差为33 dB;左耳鼓室导抗图为B型;颞骨CT检查示左侧鼓膜较对侧稍厚,中耳腔积液,左侧乳突小房内可见液性密度影,未见明确骨质破坏(图1);鼻内镜、胸片、心电图、实验室检查均未见明显异常。诊断为“分泌性中耳炎(左)”。在全麻下行左耳改良乳突根治术,术中见左侧乳突气房内含粘性分泌物,乳突、鼓窦、鼓窦入口粘膜增生、肥厚。术后中耳病变组织病理检查示慢性炎症。术后予以抗感染治疗,患者左耳听力稍提高,耳鸣无改善。出院2个月后,患者因“发热4日”再次入院,体温波动于38.0~39.0 ℃,伴鼻塞、涕中带血、咳嗽、咳痰、头痛、盗汗等症状。血常规:白细胞计数15.59×109/L,中性粒细胞百分比80.7%;血沉69 mm/h;超敏C反应蛋白91.7 mg/L。胸部CT显示双肺多发小斑片状、条片状密度增高影,考虑炎症(图2)。给予抗感染、止咳化痰、退热等治疗后,患者仍反复发热。入院后3天行CT引导下经皮肺穿刺活检术,病理结果示肉芽肿形成。因怀疑GPA可能,查胞浆型抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,c-ANCA)阳性,抗蛋白酶3抗体(PR3-ANCA)3+。鼻内镜检查示鼻腔粘膜糜烂,触之易出血,表面有干血痂,左侧咽鼓管圆枕肿大;鼻腔黏膜病理检查可见血管炎及肉芽肿形成,符合肉芽肿性多血管炎改变(图3)。确诊为GPA,转入风湿免疫科予以糖皮质激素冲击(甲强龙0.5 g/d,连用3 d,随后逐渐减量至40 mg/d维持)联合环磷酰胺(1 g/次,每月一次)治疗,同时予改善循环、抗骨质疏松、保护胃黏膜等对症治疗。患者症状好转,肺部病变较前吸收减小,炎症指标恢复正常。出院后继续予激素及免疫抑制剂治疗,门诊定期复诊。患者于2013年1月5日因“头痛、声嘶、饮水呛咳5日”再次入院。查体见悬雍垂偏向右侧,左侧软腭抬升减弱、咽反射消失、舌后1/3味觉减退。电子喉镜示左侧声带麻痹。胸部CT见双下肺病变增大,多个空洞样病变。颅脑MRI、颅脑磁共振血管成像(MRA)、心电图、脑电图未见异常。炎性指标升高,胞浆型抗中性粒细胞胞浆抗体(c-ANCA)阳性,抗蛋白酶3抗体(PR3-ANCA)3+;脑脊液压力升高、蛋白升高。考虑为肉芽肿性多血管炎并神经系统浸润,给予激素、免疫抑制剂、抗感染治疗,并行甲氨蝶呤、地塞米松鞘内注射。患者症状好转后出院。半年后患者再次因“发热、咳嗽1日”入院,痰培养提示曲霉菌属真菌生长。考虑韦格纳肉芽肿并肺部真菌感染,予抗真菌药、抗生素、糖皮质激素等治疗。患者病情仍控制不佳并持续恶化,出现感染性休克、多器官功能障碍,最终抢救无效死亡。
病例2,患者男,32岁,因“右耳闷胀伴听力下降1月”入院。患者1个月前无明显诱因出现右耳闷胀感,伴右耳听力渐进性下降,时有低调嗡嗡样耳鸣。在外院按“分泌性中耳炎”口服药物治疗2周后,出现右耳痛、眩晕、鼻塞、流脓涕、涕中带血、发热,于外院住院治疗,耳内镜见右侧鼓膜充血、肿胀,结构不清。纯音测听示右耳言语频率平均气导听阈为88.3 dB HL,平均骨导听阈为56.7 dB HL;右耳鼓室导抗图为B型。头颅CT见右侧中耳乳突炎;双侧筛窦、蝶窦、上颌窦、右侧额窦炎。胸部X片示左肺门可疑类圆形透亮区,考虑伪影可能。尿常规:隐血2+,葡萄糖3+,蛋白1+。予右侧鼓膜切开术,术中情况不详,术后中耳病变组织活检示炎性病变。术后患者症状无缓解,遂转入我科继续治疗。患者入院后反复发热,体温波动于36.6~39.5 ℃,逐渐出现咳嗽、咳痰、咯血、上腹痛、乏力等症状。血常规:白细胞9.9×109/L,中性粒细胞百分比79.3%;超敏C反应蛋白164 mg/L。尿常规:隐血3+,葡萄糖1+,蛋白1+。查体见右侧外耳道淡黄色分泌物,右侧鼓膜紧张部穿孔,松弛部充血,结构不清。头颈部磁共振示右侧中耳乳突炎;右侧咽鼓管圆枕肿大;全组副鼻窦炎(图4)。胸部CT示双肺多发结节(图5)。鼻腔粘膜病理检查可见血管纤维素性坏死,淋巴细胞、浆细胞及中性粒细胞浸润(图6)。考虑全身性疾病,请风湿免疫科会诊,完善ANCA检测,结果示c-ANCA阳性,PR3-ANCA阳性,确诊为GPA。转入风湿免疫科予以糖皮质激素冲击(甲强龙0.5 g/d,连用3 d,随后逐渐减量至40 mg/d维持)联合环磷酰胺(1g/次,每月一次)及丙种球蛋白治疗,同时予对症支持治疗。患者目前已确诊9个月,于当地医院规律治疗中。
2 讨论
韦格纳肉芽肿(Wegener’s granulomatosis,WG)在1936年首次由Friedrich Wegener详细描述,并于2011年由美国风湿病学会、美国肾脏病学会及欧洲风湿病学会联合更名为“肉芽肿性多血管炎(granulomatosis with polyangiitis,GPA )”[2]。GPA的临床表现复杂多样,可累及全身各个系统和器官,但63%~73%的GPA患者的首发症状与头颈部器官受累有关[3]。因此,耳鼻喉科医生对肉芽肿性多血管炎的初诊起关键性作用。
鼻腔及鼻窦是头颈部最常见的受累部位,但6%~56%的GPA患者存在耳部症状[4],且耳部不适可为GPA唯一及最初表现。分泌性中耳炎是GPA最常见的耳部表现,其原因可能为鼻腔、鼻咽部及咽鼓管的肉芽组织增生导致咽鼓管功能障碍。此外,中耳黏膜和乳突气房受累可引起慢性化脓性中耳炎;耳蜗血管炎、耳蜗免疫复合物沉积、肉芽组织压迫耳蜗神经可导致感音神经性或混合性听力下降;当免疫复合物沉积在前庭或中枢神经系统发生多神经炎时,患者可出现眩晕;8%~10%的GPA患者可出现面瘫[5]。文中2例患者首诊时仅有听力下降、耳鸣、耳闷等耳部症状且症状缺乏特异性,故初诊时诊断为分泌性中耳炎,治疗后症状无明显好转,随着病情进展,患者耳部症状加重且逐渐累及鼻腔、鼻窦、呼吸道、胃肠道并出现全身症状。可见,GPA早期易误诊为分泌性中耳炎。
当怀疑患者可能是GPA时,应尽快完善组织病理学检查及实验室检查。病理检查是GPA确诊的重要依据,其特征主要为坏死性肉芽肿和血管炎,两者既可同时出现也可单独存在。常见的取活检部位包括鼻、肺、肾及皮肤等处的病变组织,中耳标本因组织量少通常为慢性非特异性炎症表现,鼻腔、鼻窦因其取样范围广泛是头颈部取材的最佳部位。然而,多达50%的活检标本结果可能是非诊断性的,必要时可重复活检或行肺、肾活检。本文2例病例中,1例通过鼻部和肺部活检确诊,另外1例仅通过鼻部活检确诊。2例患者中耳组织活检均为慢性炎症病变,因此在中耳术后未诊断为GPA,这也是导致误诊的原因之一。GPA患者常规实验室检查结果无特异性,表现为炎性指标升高。抗中性粒细胞胞浆抗体(ANCA)是一种以中性粒细胞和单核细胞胞浆成份为靶抗原的自身抗体,是GPA的特异性血清标志物。应用间接免疫荧光法(IIF)可将ANCA分为:胞浆型ANCA(c-ANCA)和核周型ANCA(p-ANCA),前者的靶抗原主要是蛋白酶3(PR3),而后者的靶抗原以髓过氧化物酶(MPO)为常见。c-ANCA诊断GPA的特异性高达80%~100%,其滴度与疾病的活动度相关。抗蛋白酶3抗体(PR3-ANCA)是GPA的特异性抗体。利用IIF和ELISA(酶联免疫吸附试验)同时检测c-ANCA和PR3-ANCA可将诊断GPA的特异度及敏感性分别提高到超过98%和90%[6]。文中2例患者c-ANCA及PR3-ANCA均为阳性。因此,将组织病理学检查和c-ANCA、PR3-ANCA检测相结合可为GPA的早期诊断提供主要依据。
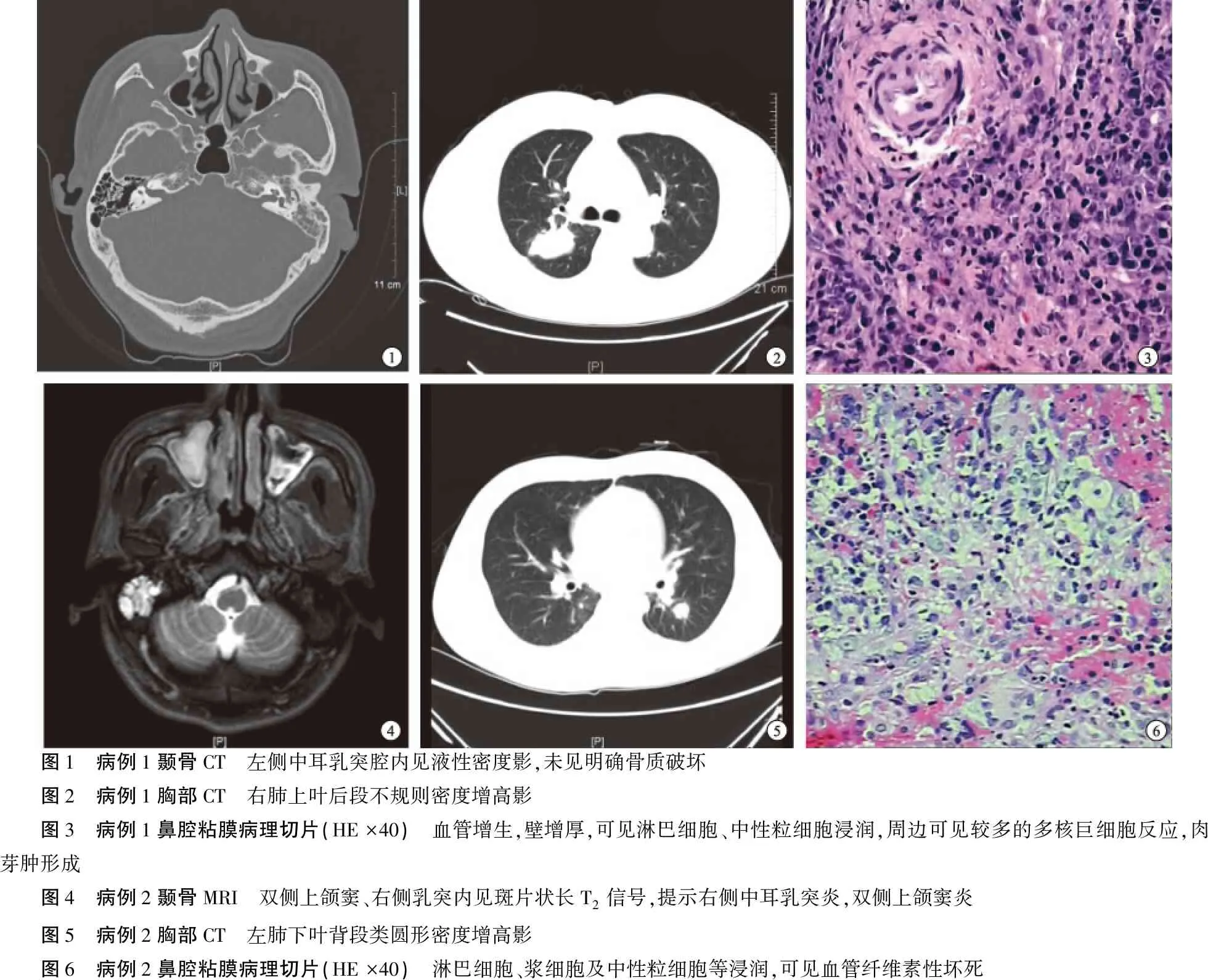
图1 病例1颞骨CT 左侧中耳乳突腔内见液性密度影,未见明确骨质破坏 图2 病例1胸部CT 右肺上叶后段不规则密度增高影 图3 病例1鼻腔粘膜病理切片(HE ×40) 血管增生,壁增厚,可见淋巴细胞、中性粒细胞浸润,周边可见较多的多核巨细胞反应,肉芽肿形成 图4 病例2颞骨MRI 双侧上颌窦、右侧乳突内见斑片状长T2信号,提示右侧中耳乳突炎,双侧上颌窦炎 图5 病例2胸部CT 左肺下叶背段类圆形密度增高影 图6 病例2鼻腔粘膜病理切片(HE ×40) 淋巴细胞、浆细胞及中性粒细胞等浸润,可见血管纤维素性坏死
GPA患者的预后很差,若不及时治疗,82%的患者会在1年内死亡,规范治疗提高了GPA的生存率,超过90%的患者可得到缓解[5]。循证医学显示糖皮质激素联合环磷酰胺治疗GPA有显著疗效,应作为主要治疗方案。目前越来越多的生物制剂如抗TNF-α、大剂量丙种球蛋白等也开始用于治疗GPA。对于中耳受累的患者,除了以诊断为目的外,不推荐进行手术干预。文中2例患者由于早期诊断不明确,都曾行中耳手术治疗,治疗效果不明显且病情持续进展。根据患者的临床表现、影像学检查、ANCA检测、组织病理学检查,该2例患者最后确诊为GPA,主要予糖皮质激素联合环磷酰胺治疗,病例2患者病情平稳;而病例1患者随访过程中出现肉芽肿性多血管炎并神经系统浸润,左侧迷走神经和舌咽神经受累及肺部曲霉菌感染,最终治疗无效死亡。虽然糖皮质激素和环磷酰胺治疗极大地改善了GPA患者的预后,但是继发感染成为了GPA患者死亡的主要原因之一[7]。GPA患者行免疫抑制剂治疗后易感染曲霉菌,而后期的抗真菌治疗很少成功[8]。因此,如何平衡复发与长期维持治疗带来的副作用是亟需解决的问题。
综上所述,以分泌性中耳炎为首发症状的GPA在临床上误诊率高,因此耳鼻喉科医师须提高对该病的认识。临床症状、影像学检查、ANCA检测、病理检查有助于该病的早期诊断,规范化、个体化的治疗将有效地控制病情进展,改善患者预后。
