液氨和过氧化氢预处理对稻草酶解效果的影响机制
2019-07-23赵相君彭何欢马中青
赵相君,李 琮,彭何欢,赵 超,马中青
液氨和过氧化氢预处理对稻草酶解效果的影响机制
赵相君,李 琮,彭何欢,赵 超,马中青※
(浙江农林大学工程学院,浙江省竹资源与高效利用协同创新中心,杭州 311300)
稻草是一种重要的木质纤维素资源,可以作为纤维素乙醇转化的原料。该试验通过高温过氧化氢(高温HP)、低温过氧化氢(低温HP)和液氨预处理(liquid ammonia treatment,LAT)3种预处理方式来克服生物质原料的酶解顽抗性,促进稻草酶解转化为可发酵单糖。对预处理后的稻草进行酶解试验,利用高效液相色谱法(high performance liquid chromatography,HPLC)定量测定了酶解液中的单糖含量,通过酶解转化率和单糖产量对预处理效果进行了分析比较。试验结果表明高温HP、低温HP和LAT 3种预处理方式均有效提升酶解率,其中LAT预处理的酶解促进作用效果最佳,高温HP预处理次之。稻草在120 ℃、预处理时间为60 min、30% H2O2水溶液与原料质量比为0.75∶1的高温HP预处理下,在纤维素酶添加量为15 U/g时葡聚糖和木聚糖的酶解率分别为61.55%和47.82%,每千克干基稻草原料经144 h酶解可生产单糖334.5 g。稻草在90 ℃、含水率60%、驻留时间为5 min、液氨与原料比例为1∶1的LAT预处理下,在纤维素酶添加量为15 U/g时,葡聚糖和木聚糖的72 h酶解率分别为88.62%和79.29%,每千克干基稻草原料经144 h酶解可生产单糖554.1 g,是未处理原料的2.9倍,总糖回收率达到90%。综上所述,LAT预处理稻草的酶解率显著高于其他单一预处理方法,该研究结果可为稻草制取燃料乙醇提供基础数据。
酶;乙醇;秸秆;液氨预处理;酶解;过氧化氢;纤维素乙醇
0 引 言
生物质能源材料能够促进国家能源安全,降低温室效应,植物生物质材料因为蕴含着大量的有机碳,因此成为生物质能源的重要组成部分。纤维素乙醇是其代表性产品,它以木质纤维素为原料,通过生物化学平台进行转化。虽然纤维素乙醇转化技术的研究已超过30 a,但产业化仍存在着困难,主要原因是木质纤维素原料存在很强的水解顽抗性(biomass recalcitrance)[1]。产生水解顽抗性的原因主要是纤维素被木质素包裹[2]、纤维素存在大范围的结晶区、半纤维素缠绕并覆盖微纤表面、纤维素与木质素间存在强结合键的LCCs(lignin- carbohydrate complexes)混合体等,使得水解酶无法有效地接触到纤维素,导致水解效率低下。目前主要采用预处理的方式来克服水解顽抗性,预处理被学者称为打开低成本纤维素乙醇的钥匙[3-4]。理想的预处理方法应该是尽可能地移除木质素,并尽量少地改变聚糖和保持纤维素的微纤结构[5]。中国秸秆资源丰富,年产秸秆资源总量为7.4亿t,其中水稻秸秆占有比例最大,约占总量的30.5%[6],产量相当可观。
稻草预处理的方法主要有稀酸法[7]、碱法(含氨水法)[8-10]、水热法[11]、蒸汽爆破法[12]、微波法[13]、氨爆法(ammonia fiber expansion, AFEX)[14]、离子液体法[15]等,其中不少研究者采用组合使用预处理方法或采用二步法[8-9,12]。从前述文献中的酶解效果来看,1)采用组合预处理或二步法的效果最佳,如采用氨水-稀硫酸两步法预处理,葡聚糖在添加15 FPU/(g葡聚糖)纤维素酶后72 h酶解率为90.8%[9];2)添加碱性介质的预处理效果较好,如AFEX预处理后葡聚糖和木聚糖的168 h酶解率分别为80.6%和89.6%[14],Na2CO3-Na2SO3预处理后总糖得率为74.5%[16],氨水浸泡法预处理的葡聚糖转化率为71.1%[10];3)其他预处理方式也有明显的效果,如水热法在180 ℃下30 min预处理后葡聚糖转化率不低于85%[11],离子液体法预处理后葡聚糖和木聚糖转化率分别为80%和30%[15]。由于酶解率受酶解时间、酶制剂添加量、酶解底物浓度等因素影响,不同学者采用的标准并不统一,所以难以进行准确的优劣排序。同时,预处理过程原料可能存在较大的损失,如碱法、稀酸法、水热法都可能导致15%至50%的固体损失,并造成木糖降解导致总糖损失,因此采用质量平衡法进行评价更为合理[17]。
氨是一种价格低廉的碱性原料,用于预处理主要有氨水法[18]、ARP法[19]和AFEX法[20]。AFEX用于草本植物具有显著的酶解促进效果,除用于稻草外,还用于玉米叶[21]、高粱秸秆[22]、青贮玉米[23]、芒[24]、柳枝稷[25]等原料。液氨处理法(liquid ammonia treatment,LAT)借鉴了AFEX法,并作了改进,将氨的爆破式释放改为缓慢释放,降低了工艺控制难度与处理成本,并拓展了预处理温度范围。H2O2是一种廉价的强氧化剂,用作预处理时它通常与碱性试剂共同使用[26],有助于更好地移除木质素,从而提升酶解效果。单纯使用H2O2,也有不错的效果,如预处理湿磨后的甘蔗渣,可使酶解率提升1.4倍[27]。
本研究采用高温HP、低温HP和LAT 3种方法对稻草进行预处理,并通过酶解率、单糖得率和质量平衡法进行预处理效果比较。试验中采用的试剂成本低且环境友好,预处理设备要求不高,易于实现低成本的乙醇生产。
1 材料与方法
1.1 试验材料
水稻秸秆取自浙江省临安市清凉峰镇(30.15°N、118.97°E),采收期是9月份。试验采用去除稻谷后地上部分的整株植物,将稻草切割成约1~2 cm长条状,在不高于40 ℃温度下,烘干至含水率低于15%,用微型植物粉碎机(FZ102,天津泰斯特)粉碎成50~100目的粉末。用水分分析仪(MA35,Sartorius)测量混合均匀后稻草粉末的含水率,再将试验材料装入塑料袋密封好,贮藏于-20 ℃冰箱里存放以备用。用于高效液相色谱(high performance liquid chromatography,HPLC)分析的葡萄糖、木糖等标准对照品均采购自Sigma-Aldrich公司(上海),纯度为99%以上。纤维素酶(NS50013)(含木聚糖酶活性)、-葡萄糖苷酶(NS50010)由诺维信公司(中国)提供,测得纤维素酶制剂的活性为76 U/mL,葡萄糖苷酶活性为252 U/mL。
1.2 试验方法
试验分析的方法参照美国的国家可再生能源实验室(national renewable energy laboratory,NREL)制订的试验规程(laboratory analytical procedure,LAP),其中酶解反应量由原10改为15 mL,酶添加量由原来60 FPU/g改为15 FPU/g,详见文献[1]。
1.2.1 组分含量测定
试验原料中碳水化合物组分由LAP002方法测定,酸不溶性木质素(Klason木质素)由LAP003方法测定,详见文献[1]。LAP002和LAP003采用二步酸解法,在一次试验中完成。酸水解的具体步骤是用分析天平(AL204,Mettler Toledo)先准确称量已知含水率并去除抽提物的生物质原料0.3 g(干基),加入质量分数72%硫酸3 mL,在30 ℃水浴中保持2 h,加去离子水84 mL(稀释至质量分数4%硫酸),放入灭菌锅中121 ℃保持1 h。经真空过滤后将滤纸上的固形物烘干至恒定质量。用HPLC法(色谱分析柱为美国Bio-Rad生产的AminexHPX-87H醇酸柱)测定各种单糖的浓度,并计算出葡聚糖(纤维素)、木聚糖、阿拉伯聚糖等含量,由滤纸上的固形物经灰分分析后确定不溶性木质素含量。灰分按照方法LAP005[1]测定,先测出试验原料的含水率,称1 g左右放入已测质量的有盖陶瓷坩锅中,置入箱式电阻炉中程序缓慢升温,约2 h升至(575±1)℃,保持此温度4 h后,冷却至105 ℃左右移入干燥器,待冷却至室温后称取质量,计算出灰分含量。
1.2.2 HP预处理
将已知水分的生物质原料与30%的H2O2水溶液按不同质量比例(0:1、0.5:1、0.75:1、1:1、1.5:1和2:1)混合,搅拌均匀,将混合材料装入蓝盖玻璃瓶中(盖紧瓶盖),再将其分别加热至60和120 ℃,各保温60 min, 处理后的原料置于40 ℃的烘箱中干燥。60 ℃预处理采用水浴法加热,120 ℃预处理采用灭菌锅加热。处理后的原料经干燥后称量其质量并测定含水率,计算预处理后原料得率,再将处理后的原料放入-20 ℃的冰箱冷藏备用。部分样品进行酸解试验,分析聚糖损失和木质素降解量。过氧化氢预处理优化的工艺参数选择有:预处理温度、驻留时间、生物质原料与H2O2质量比例等。
1.2.3 LAT预处理
称取已知含水率的生物质原料,干燥至含水率为15%,搅拌均匀后放入改装过的反应釜(GCF- 1L20/350,大连自控设备厂)中,并将反应釜抽真空;将液氨注入称量小钢瓶,称量并确定本次试验用量,加热小钢瓶至50 ℃左右(提升氨的压力),然后将氨注入反应釜中;加热反应釜至设定的温度,保留一定时间,快速冷却反应釜并释放氨气。取出处理后的原料置于通风柜中室温干燥12 h。干燥后测量其质量和含水率,计算预处理后原料得率,再将处理后的原料放入–20 ℃的冰箱冷藏备用,部分原料进行酸解试验确定聚糖损失和木质素移除率。LAT预处理优化的工艺参数选择有:预处理的温度、驻留时间、含水率、以及生物质与液氨的比例等[28]。
1.2.4 酶水解
酶水解试验按照LAP009规程:用分析天平称取0.15 g葡聚糖当量(1%的葡聚糖底物浓度)的原料放入20 mL的酶解瓶(预处理后原料的葡聚糖含量参照未预处理原料),然后加入蒸馏水、柠檬酸钠缓冲溶液(平衡后pH值为4.8)、抗生素(四环素和环己酰亚胺),预混合1 h左右再添加纤维素酶、-葡萄糖苷酶。纤维素酶的添加量为15 FPU/g、-葡萄糖苷酶64 pNPGU/g。酶解条件设定温度为50 ℃,摇床转速为150 r/min。酶解取样的时间为24 、72和144 h。
高效液相色谱(HPLC)分析样品取样:取1 mL酶解样品,放入离心管,置于加热器(设置温度100℃)中加热20 min,使酶蛋白变性完全失效,然后放入冰箱(-20 ℃)冷却5 min,再放入离心机(5424,Eppendorf AG)在15 000 r/min转速下离心5 min,用一次性针头过滤器(0.22m)过滤(聚醚砜膜)后装入HPLC分析瓶,放入5 ℃冷藏或-20 ℃冷冻备分析。
1.2.5 糖的定量分析
酶解液或酸解液中的单糖定量分析采用HPLC法,色谱仪为Agilent Technologies 1200 Series(安捷伦公司,带自动进样器G1329A),采用示差折光检测器检测。采用BioRad公司的HPX-87H色谱柱,流动相为0.005 mol/L稀硫酸,流速为0.60 mL/min,柱温为50 ℃。
1.2.6 酶解率及总糖回收量计算
酶解率为实际获得单糖含量与原料中聚糖理论上可转换的同类单糖含量之比,如葡聚糖的酶解率可通过公式(1)计算得到。
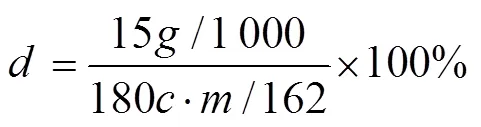
式(1)中的分子为酶解所获得葡萄糖含量,为HPLC测得的酶解液中葡萄糖的质量浓度,g/L;公式(1)中的分母为理论上原料中的葡聚糖转化为葡萄糖的量,为加入原料的干基质量,为原料成分分析(酸解法)葡聚糖含量百分数,%。 总糖回收量为1 000 g干基原料经酶解后产生的葡萄糖和木糖质量和,g。
2 结果与讨论
2.1 原料组分分析
稻草原料与经HP预处理和LAT预处理后的干基组分比较如表1所示。葡聚糖在LAT预处理过程中几乎没有损失,在低温HP预处理中损失少于5%,而在高温HP预处理中损失约18%。木聚糖在LAT预处理过程中也几乎没有损失,而在低温HP预处理中损失约11%,在高温HP预处理中损失约33%。不溶性木质素的移除率以LAT预处理为最佳,预处理过程中减少不溶性木质素约10%。
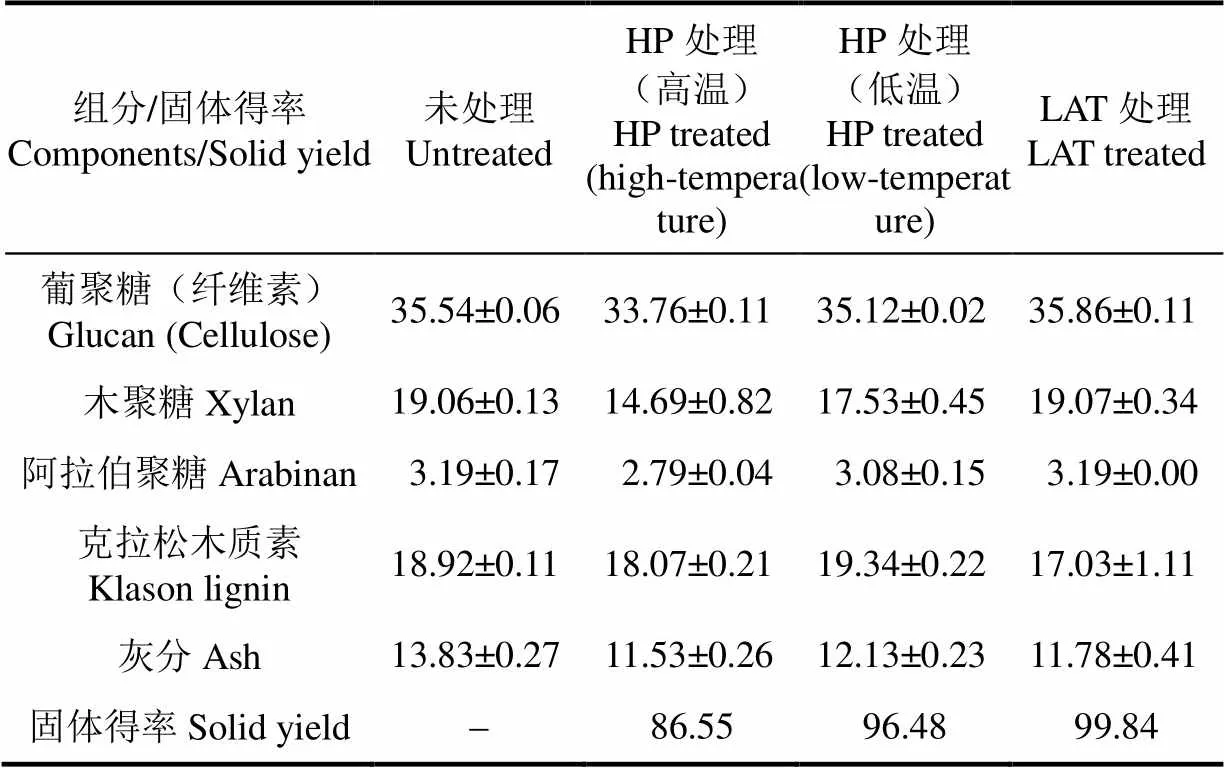
表1 生物质的组分分析(干基)
2.2 高温HP预处理对酶解效果的影响
高温HP预处理中H2O2添加量对酶解效果的影响如图1所示,横坐标为30%的H2O2水溶液与原材料质量之比(0:1表示未经预处理),纵坐标左侧为葡聚糖/木聚糖经酶解24、72 h转化为葡萄糖/木糖的转化率,右侧为每千克干基原料经144 h酶解可转化为葡萄糖和木糖的总量,称为总糖回收量(未计算阿拉伯糖等其他单糖)。H2O2添加量的变化范围为质量比0.5∶1~2∶1,其他预处理条件为驻留时间为60 min,预处理温度为120 ℃。结果表明,采用0.75∶1时,葡聚糖和木聚糖的转化率在24、72 h均有最大值,其72 h转化率分别为61.55%、47.82%,较未作预处理时的40.24%、14.45%分别提高了0.53倍和2.3倍。经此优化条件下预处理,每千克干基稻草经144 h酶解后可转化单糖368.5 g,是未经预处理原料的1.8倍。H2O2添加量对酶解效果的影响较为显著,过高的添加量(超过1.0∶1)导致酶解率快速下降。从组分分析中可知,主要原因之一是预处理中大量的葡聚糖与木聚糖降解造成的,添加比例越高其降解量越大[29]。
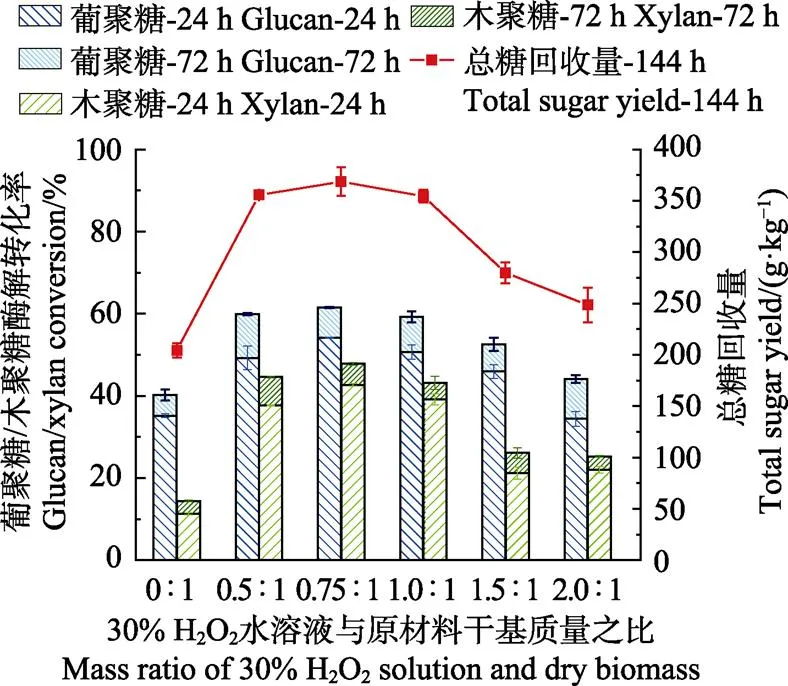
注:24、72、144 h分别为不同的酶解时间,下同。
2.3 低温HP预处理对酶解效果的影响
低温HP预处理中H2O2添加量对酶解效果的影响如图2所示。H2O2添加量的变化范围为质量比0.5∶1~2∶1,其他预处理条件为驻留时间为60 min,预处理温度为60 ℃。结果表明,采用0.5∶1或1.0∶1时,葡聚糖和木聚糖的转化率较高(两者接近)。在1.0∶1时,葡聚糖和木聚糖的72 h转化率分别为52.87%、22.70%,较未作预处理时的40.24%、14.45%分别提高了0.25倍和0.57倍。经此优化条件下预处理,每千克干基稻草经144 h酶解后可转化单糖284.0 g,是未经预处理原料的1.4倍。低温HP预处理能有效提高酶解率,但H2O2添加量对酶解效果的影响不显著。与高温HP预处理相比,低温预处理的酶解率偏低。
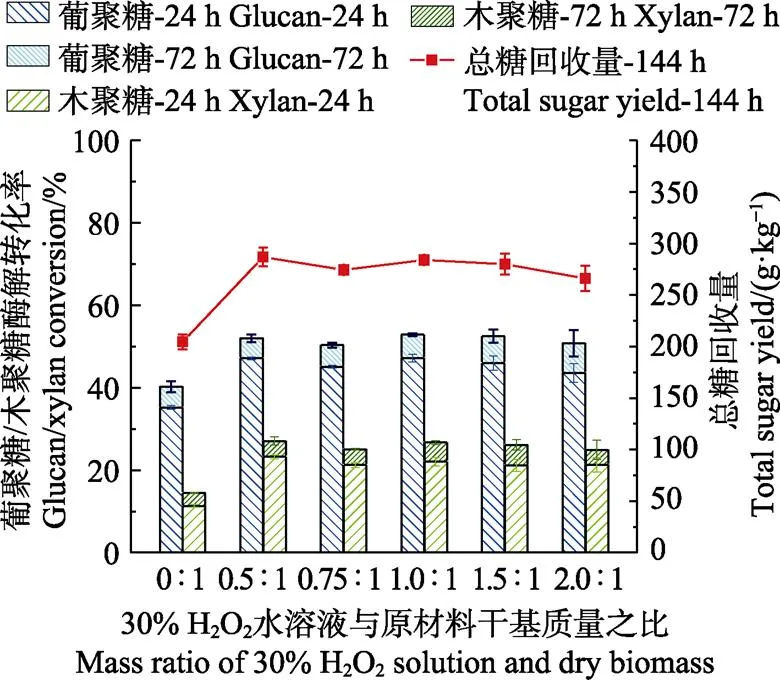
图2 H2O2添加量对低温HP预处理稻草的酶解转化率的影响
2.4 LAT预处理对酶解效果的影响
LAT预处理温度对酶解率的影响如图3所示,横坐标为预处理温度,其他预处理条件为原料含水率60%、液氨与原料质量比为1:1、预处理驻留时间为5 min。结果表明,在70~170 ℃范围内,葡聚糖的酶解转化率随着预处理温度升高而增加,至90 ℃时转化率达到最大值,而后随温度升高转化率略有下降,到170 ℃时又有所增加。90 ℃时24 h取样的葡聚糖酶解率为80.45%,与未经预处理的31.75%相比提高了1.53倍。木聚糖的酶解转化率随温度变化趋势与葡聚糖相似,也在温度为90 ℃时达到最高值。未经处理原料的木聚糖转化率为11.84%,温度为90 ℃时的木聚糖转化为率73.83%,提高了5.24倍。酶解72 h时葡聚糖和木聚糖转化率分别为88.62%和79.29%,未处理材料转化率分别为37.48和14.81%,分别提高了1.36倍和4.35倍。经此优化条件下预处理,每千克干基稻草经144 h酶解后可转化单糖555.0 g(未考虑预处理中的固体损失),是未经预处理原料产糖量190.6 g的2.9倍,是高温HP预处理后产糖量的1.5倍。LAT预处理的酶解效果显著高于HP预处理,而且在预处理过程中几乎没有聚糖损失,故其非常适用于稻草的预处理。Zhao等[30]通过对LAT预处理后的芦竹的表观形貌变化分析可知,LAT预处理后芦竹纤维组织表面产生了大量的裂隙,减少了生物质的水解顽抗性,纤维素酶的可及度大幅度提升,有利于酶解率的提升。
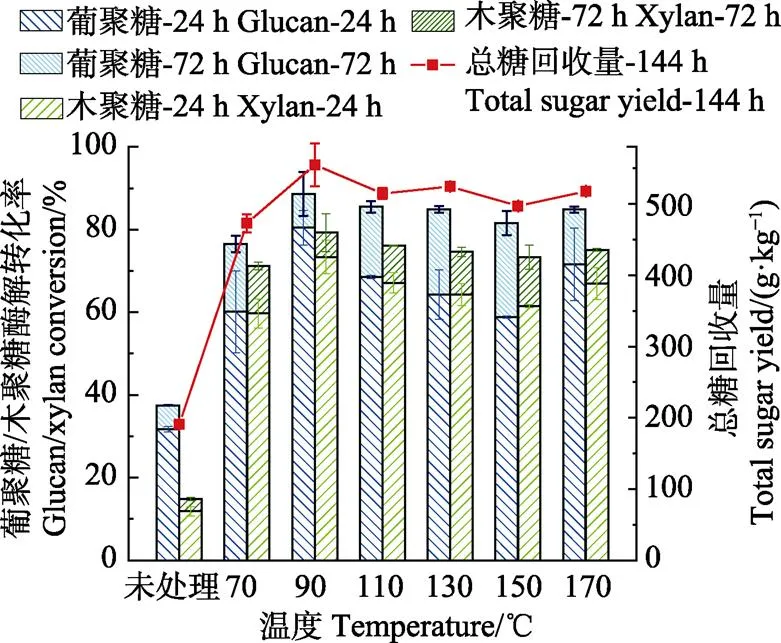
图3 不同预处理温度对稻草中葡聚糖/木聚糖酶解转化率的影响
2.5 LAT预处理和高温HP预处理效果比较
HP高温预处理与酶解的质量转化流程图如图4所示。采用的预处理条件为:预处理温度120℃、预处理时间为60 min、H2O2与原料质量比为0.75:1,纤维素酶添加量为15 FPU/g(以葡萄糖计),预处理的固体得率为86.55%。每千克预处理后稻草(干基)经144 h酶解后可获得单糖386.5 g(不包括阿拉伯糖、半乳糖等),考虑固体得率后其实际获得单糖334.5 g。而未作预处理的单糖获得量为204.5 g,预处理后单糖得率是未处理原料的1.6倍。预处理后酶解所得葡萄糖占总糖量的70.4%,而未作预处理原料酶解所得葡萄糖占82.5%,该预处理方式较大地促进了木聚糖的酶解。
液氨预处理与酶解的质量转化流程图如图5所示。采用的预处理条件为:预处理温度90 ℃、含水率60%、驻留时间为5 min、液氨与原料质量比例为1∶1,预处理后固体得率为99.84%。酶解过程中纤维素酶添加量为15 FPU/g (以葡萄糖计),1 000 g干基稻草经144 h酶解后可获得单糖554.1 g,而未作预处理的单糖获得量为190.6 g,预处理后单糖产量是未处理原料的2.9倍。预处理后酶解所得葡萄糖占总糖量的67.2%,与高温HP预处理获得的比例接近。该预处理条件下可获得木糖占总糖量约三分之一,防止预处理过程中木糖降解和在后续发酵过程中使木糖充分转化为乙醇,是纤维素乙醇研究与生产中的重要课题。
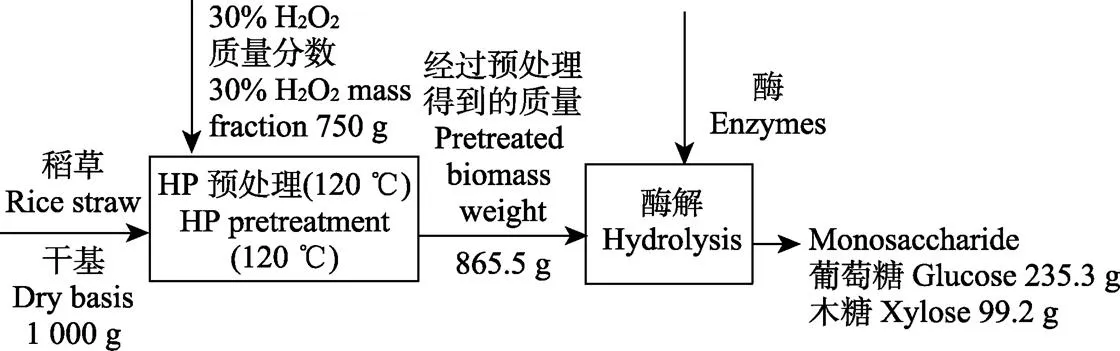
图4 稻草高温HP预处理与酶解过程质量转化流程图
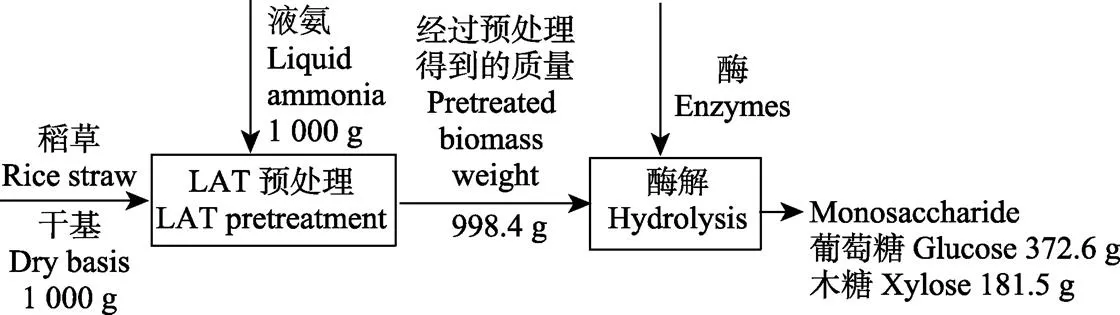
图5 稻草LAT预处理与酶解过程质量转化流程图
在高温HP、低温HP和LAT预处理3种预处理方法中,三者对稻草的酶解促进作用效果明显,而以LAT预处理为最佳。LAT预处理稻草后,经酶解144 h后葡聚糖和木聚糖的转化率分别为94.35%和84.24%,每千克稻草可获得单糖总量544.1 g,总糖回收率达到90%。
AFEX预处理后144 h酶解葡聚糖与木聚糖的转化率分别为80.6%和89.6%(6%葡聚糖含量的底物浓度)[14],LAT对稻草预处理后葡聚糖转化率与总糖回收率超过AFEX。LAT预处理后葡聚糖72 h酶解转化率为88.62%,高于氨水浸泡的71.1%[9]、Na2CO3-Na2SO3法的82.7%[16]、热水法的85%[10]、微波/碱法的60%[7]、离子液体法的80%[15],与稀酸-汽爆组合法73.5%~93.1%[11]、氨水-稀酸两步法89.0%[8]接近。LAT预处理后木聚糖72 h酶解转化率为79.29%,仅低于AFEX预处理[14]。由于预处理过程中原料会损失,很多研究者在酶解转化率或单糖回收率中未考虑损失量,而LAT预处理的固体回收率接近100%,不会引起聚糖降解,既保证了单糖得率,又不会产生后续发酵过程中的抑制剂,是一个显著的优势。
3 结 论
通过对稻草高温HP、低温HP、LAT预处理后的酶解效果开展比较研究,结论如下。这3种预处理方法均有显著的酶解促进作用,其顺序为:LAT预处理>高温HP>低温HP。稻草在120℃、预处理时间为60 min、H2O2与原料质量比为0.75:1的高温HP预处理下,在纤维素酶添加量为15 FPU/(g葡聚糖)条件的酶解率分别为61.55%、47.82%,每千克干基稻草原料经144 h酶解可生产单糖334.5 g。稻草在90 ℃、含水率60%、驻留时间为5 min、液氨与原料比例为1:1的LAT预处理下,在纤维素酶添加量为15 FPU/(g葡聚糖)时,葡萄糖和木糖的72 h酶解转化率分别为88.62%和79.29%,每千克干基稻草原料经144 h酶解可生产单糖554.1 g,是未处理原料的2.9倍,总糖回收率达到90%。LAT预处理在用于稻草的预处理中,酶解率和单糖回收率高于其他单一预处理方法,本文研究结果可为稻草制取燃料乙醇提供基础数据。
[1] Zhao C, Shao Q J, Ma Z Q, et al. Physical and chemical characterizations of corn stalk resulting from hydrogen peroxide presoaking prior to ammonia fiber expansion pretreatment[J]. Industrial Crops and Products, 2016, 83: 86—93.
[2] 吴丹焱, 辛善志,刘标,等. 基于木质素部分脱除及其含量对生物质热解特性的影响[J]. 农业工程学报, 2018, 34(1): 193—197. Wu Danyan, Xin Shanzhi, Liu Biao, et al. Influence of lignin content on pyrolysis characteristics ofbiomass based on part of lignin removal[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE),2018, 34(1): 193—197. (in Chinese with English abstract)
[3] Blummel M, Teymouri F, Moore J, et al. Ammonia fiber expansion (AFEX) as spin off technology from 2nd generation biofuel for upgrading cereal straws and stovers for livestock feed[J]. Animal Feed Science and Technology, 2018, 236: 178—186.
[4] Yu H, Guo J, Chen Y F, et al. Efficient utilization of hemicellulose and cellulose in alkali liquor-pretreated corncob for bioethanol production at high solid loading by Spathaspora passalidarum U1-58[J]. Bioresource Technology, 2017, 232: 168—175.
[5] Amiri H, Karimi K, Zilouei H. Organosolv pretreatment of rice straw for efficient acetone, butanol, and ethanol production[J]. Bioresource Technology, 2014, 152: 450—456.
[6] 刘晓永, 李书田. 中国秸秆养分资源及还田的时空分布特征[J]. 农业工程学报, 2017, 33(21): 1—19. Liu Xiaoyong, Li Shutian. Temporal and spatial distribution characteristics of crop straw nutrient resources and returning to farmland in China[J]. Transactions of the Chinese Society for Agricultural Engineering (Transactions of the CSAE), 2017, 33(21): 1—19. (in Chinese with English abstract)
[7] Zhu S D, Huang W J, Huang W X, et al. Pretreatment of rice straw for ethanol production by a two-step process using dilute sulfuric acid and sulfomethylation reagent[J]. Applied Energy, 2015,145: 190—196.
[8] Kim I, Lee B, Song D S, et al. Effects of ammonium carbonate pretreatment on the enzymatic digestibility and structural features of rice straw[J]. Bioresource Technology, 2014, 166: 353—357.
[9] Domanski J, Borowski S, Marchut-Mikolajczyk O, et al. Pretreatment of rye straw with aqueous ammonia for conversion to fermentable sugars as a potential substrates in biotechnological processes[J]. Biomass & Bioenergy, 2016, 91: 91—97.
[10] Antonopoulou G, Jonuzaj S, Gavala H N, et al. The effect of aqueous ammonia soaking pretreatment on methane generation uing different lignocellulosic feedstocks[J]. Waste & Biomass Valorization, 2015, 6(3): 281—291.
[11] Ngamprasertsith S, Sunphorka S, Kuchonthara P, et al. Pretreatment of rice straw by hot-compressed water for enzymatic saccharification[J]. Korean Journal of Chemical Engineering, 2015, 32(10): 2007—2013.
[12] 刘翀, 张瑞婷, 刘本国, 等. 蒸汽爆破处理对麦麸的酚酸组成及其抗氧化活性的影响[J]. 农业工程学报, 2016, 32(6): 308—314. Liu Chong, Zhang Ruiting, Liu Benguo, et al. Effect of steam explosion treatment on phenolic acid compositionof wheat bran and its antioxidant capacity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(6): 308—314. (in Chinese with English abstract)
[13] 马欢, 刘伟伟, 刘萍, 等. 微波预处理对水稻秸秆糖化率与成分和结构的影响[J]. 农业机械学报, 2014, 45(10): 180—186. MaHuan, LiuWeiwei, Liu Ping, et al. Effects of microwave pretreatment on enzymatic saccharification and lignocellulosic structure of rice straw[J]. Transactions of the Chinese Society of Agricultural Machinery, 2014, 45(10): 180—186. (in Chinese with English abstract)
[14] Zhong C, Lau M W, Balan V, et al. Optimization of enzymatic hydrolysis and ethanol fermentation from AFEX-treated rice straw[J]. Applied Microbiology and Biotechnology, 2009, 84(4): 667—676.
[15] Hou X D, Smith T J, Li N, et al. Novel renewable ionic liquids as highly effective solvents for pretreatment of rice straw biomass by selective removal of lignin[J]. Biotechnology and Bioengineering, 2012, 109(10): 2484—2493.
[16] Yang L F, Cao J, Mao J Y, et al. Sodium carbonate–sodium sulfite pretreatment for improving the enzymatic hydrolysis of rice straw[J]. Industrial Crops and Products, 2013, 43: 711—717.
[17] Garlock R J, Balan V, Dale B E, et al. Comparative material balances around pretreatment technologies for the conversion of switchgrass to soluble sugars[J]. Bioresource Technology, 2011, 102(24): 11063—11071.
[18] Nguyen T A, Kim K R, Han S J, et al. Pretreatment of rice straw with ammonia and ionic liquid for lignocellulose conversion to fermentable sugars[J]. Bioresource Technology, 2010, 101(19): 7432—7438.
[19] Kumar R, Mago G, Balan V, et al. Physical and chemical characterizations of corn stover and poplar solids resulting from leading pretreatment technologies[J]. Bioresource Technology, 2009, 100(17): 3948—3962.
[20] Nissila M E, Lay C, Puhakka J A, et al. Dark fermentative hydrogen production from lignocellulosic hydrolyzates – A review[J]. Biomass & Bioenergy, 2014, 67: 145—159.
[21] Zhao C, Ma Z Q, Shao Q J, et al. Enzymatic hydrolysis and physiochemical characterization of corn leaf after H-AFEX pretreatment[J]. Energy & Fuels, 2016, 30(2): 1154—1161.
[22] Umagiliyage A L, Choudhary R, Liang Y, et al. Laboratory scale optimization of alkali pretreatment for improving enzymatic hydrolysis of sweet sorghum bagasse[J]. Industrial Crops and Products, 2015, 74: 977—986.
[23] Shao Q, Chundawat S P, Krishnan C, et al. Enzymatic digestibility and ethanol fermentability of AFEX-treated starch-rich lignocellulosics such as corn silage and whole corn plant[J]. Biotechnology for Biofuels, 2010, 3(1): 12.
[24] Li Q M, Li X J, Jiang Y L, et al. Analysis of degradation products and structural characterization of giant reed and Chinese silvergrass pretreated by 60Co-γ irradiation[J]. Industrial Crops and Products, 2016, 83: 307—315.
[25] Garlock R J, Balan V, Dale B E. Optimization of AFEX™ pretreatment conditions and enzyme mixtures to maximize
sugar release from upland and lowland switchgrass[J]. Bioresource Technology, 2012, 104: 757—768.
[26] Rabelo S C, Andrade R R, Maciel Filho R, et al. Alkaline hydrogen peroxide pretreatment, enzymatic hydrolysis and fermentation of sugarcane bagasse to ethanol[J]. Fuel, 2014, 136: 349—357.
[27] Gao M T, Yano S, Inoue H, et al. Combination of wet disk milling and hydrogen peroxide treatments for enhancing saccharification of sugarcane bagasse[J]. Biochemical Engineering Journal, 2012, 68: 152—158.
[28] 赵相君. 农作物秸秆液氨—过氧化氢预处理参数优化及酶解效果研究[D]. 杭州:浙江农林大学, 2013.
[29] Singh R, Tiwari S, Srivastava M, et al. Experimental study on the performance of microwave assisted Hydrogen peroxide (H2O2) pretreatment of rice straw[J]. Agricultural Engineering International: The CIGR Journal, 2014, 16(1): 173—181.
[30] Zhao C, Cao Y, Ma Z Q, et al. Optimization of liquid ammonia pretreatment conditions for maximizing sugar release from giant reed (L.)[J]. Biomass & Bioenergy, 2017, 98(2): 61—69.
Mechanism on effect of liquid ammonia and hydrogen peroxide pretreatment on rice straw enzymatic hydrolysis
Zhao Xiangjun, Li Cong, Peng Hehuan, Zhao Chao, Ma Zhongqing※
(311300,)
Biomass is a promising, eco-friendly, and renewable source for generating energy, fuels, and bio-chemicals that could partially replace fossil fuels to reduce the pressure of environmental pollution problems. Rice straw is one of the most important lignocellulosic biomass in China, which is a potential feedstock to produce bio-ethanol by enzyme hydrolysis method. The production process of bio-ethanol is composed of three stages, namely pretreatment, enzymatic hydrolysis, and fermentation. The pretreatment process is important step to overcome biomass recalcitrance, and improve the performance of enzymatic hydrolysis. In this study, three types of pretreated method, namely high-temperature hydrogen peroxide pretreatment (HTHP), low-temperature hydrogen peroxide pretreatment (LTHP), and liquid ammonia pretreatment (LAT), were used to overcome biomass recalcitrance and improve the performance of enzymatic hydrolysis. Then, a caparison of the performance of enzymatic hydrolysis and the yield of monosaccharides were carried out by using three pretreatment methods. The contents of monosaccharide (glucose, xylose, and arabinose) of the enzymatic hydrolysate were quantitative determined by high performance liquid chromatography (HPLC). Results showed that three pretreatment methods were effective to enhance the performance of enzymatic hydrolysis, and ordered as LAT > HTHP > LTHP. Based on the chemical component analysis before and after pretreatment, the content of glucan decreased from 35.54% of control sample to 33.76% of HTHP pretreatment, 35.12% of LTHP pretreatment, and 35.86% of LAT pretreatment. The content of xylan decreased from 19.06% of control sample to 14.69% of HTHP pretreatment, 17.53% of LTHP pretreatment, while increase to 19.07% of LAT pretreatment. The optimal pretreatment conditions of HTHP were 120 ℃, mass ratio of 0.75:1 (w/w) between 30% H2O2solution and biomass ratio, and 60 minutes’ residence time. The conversion rates of glucan and xylan were 61.55% and 47.82%, respectively, after 72 hours enzymatic hydrolysis at 1% glucan loading using 15 FPU/(g of glucan) of cellulase. The sugar yield was 334.5 g per kg of rice straw (dry basis) after 144 hours enzymatic hydrolysis. The effect of H2O2addition on the enzymatic hydrolysis effect was significant, and the excessive addition amount (more than 1.0:1) led to a rapid decrease in the enzymatic hydrolysis rate. The optimal pretreatment conditions of LAT were 90 ℃, mass ratio of 1:1 (w/w) between liquid ammonia and biomass ratio, 60% moisture content (drybasis) and 5 minutes’ residence time. The conversion rates of glucan and xylan were 88.62% and 79.29%, respectively, after 72 hours enzymatic hydrolysis at 1% glucan loading using 15 FPU/(g of glucan) of cellulase. The sugar yield was 554.1 g per kg of dry rice straw after 144 hours enzymatic hydrolysis, which is 2.9-fold of producing from untreated straw. The total sugar recovery rate was almost 90%. In conclusion, the performance of LAT pretreatment was more effective than other two pretreatment methods (HTHP and LTHP). This study would be useful to supply scientific and basic data for industrial application of rice straw.
enzyme; ethanol; straw; liquid ammonia pretreatment; enzymatic hydrolysis; peroxide hydrogen; cellulosic ethanol
10.11975/j.issn.1002-6819.2019.10.028
S216
A
1002-6819(2019)-10-0221-06
2019-01-14
2019-03-22
国家自然科学基金(31500491);浙江省基础公益研究计划项目(LGN18B060001);浙江省竹资源与高效利用协同创新中心开放基金(2017ZZY2-02);中国科协“青年人才托举工程”项目(2018QNRC001)
赵相君,实验师,主要从事农林生物质废弃物资源化利用研究工作。Email:zhaoxiangjunzpp@126.com
马中青,副教授,主要从事生物质资源化利用研究工作。Email:mazq@zafu.edu.cn
赵相君,李 琮,彭何欢,赵 超,马中青.液氨和过氧化氢预处理对稻草酶解效果的影响机制[J]. 农业工程学报,2019,35(10):221-226. doi:10.11975/j.issn.1002-6819.2019.10.028 http://www.tcsae.org
Zhao Xiangjun, Li Cong, Peng Hehuan, Zhao Chao, Ma Zhongqing.Mechanism on effect of liquid ammonia and hydrogen peroxide pretreatment on rice straw enzymatic hydrolysis[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(10): 221-226. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.10.028 http://www.tcsae.org
