辽宁地区云南白药胶囊多中心、前瞻性、大样本临床安全性集中监测统计分析研究
2019-07-23李福春高建烨李殿明董钧邵泽丹王新厚邢丽邵立春范忠义安良宝杨波赵刚张传家赵猛孙玉坤
李福春 高建烨 李殿明 董钧 邵泽丹 王新厚 邢丽 邵立春 范忠义 安良宝杨波 赵刚 张传家 赵猛 孙玉坤
云南白药是我国著名的伤科中成药, 既属于我国中药保护品种又属于国家保密方, 从1902年发明创制至今, 已有一百多年的临床运用历史。现代药理学研究表明, 云南白药的作用机制可能包括以下几个方面:①明显缩短凝血时间和凝血酶原时间, 促进血小板粘附、聚集、释放等生理过程, 增强血小板的活化百分率及增加血小板表面糖蛋白的表达[1,2];②对血管有明显的收缩作用[3];③增强吞噬细胞的吞噬功能, 提高机体免疫力, 抑制炎症介质释放, 促进皮质激素释放, 改善局部微循环[4];④可显著提高骨折部位血管内皮生长因子的水平, 改善骨折端的微循环, 诱导骨髓间充质细胞向成骨细胞分化, 促进骨折愈合[5]。叶剑锋等[2]进行云南白药对大鼠血小板聚集及膜糖蛋白表达的影响研究发现, 云南白药可显著增强大鼠血小板聚集及血小板膜上CD61和CD62P的表达, 同时不会增加静息血小板表面CD41的表达。这也是云南白药在发挥止血作用的过程中并不会导致促血栓形成倾向的原因。
云南白药因其具有神奇的止血化瘀、活血止痛、消炎生肌、愈合伤口、祛毒排脓等功效, 临床用于治疗各类跌打损伤、瘀血肿痛、吐血、咳血、便血、痔血、崩漏下血、手术出血、疮疡肿毒及软组织挫伤、闭合性骨折、支气管扩张、肺结核咳血, 溃疡病出血以及皮肤感染性疾病, 被人们誉为“中华瑰宝”、“伤科圣药”[6-8]。云南白药胶囊是传承了百年白药配方制作而成的胶囊剂, 内容物为粉末, 既保留了云南白药散剂的特点, 又克服了散剂口感酸涩、剂量不易掌握的缺点[9]。
随着云南白药胶囊在临床科室和疾病种类中的应用范围越来越广泛, 在临床中亦偶见不良反应发生, 也偶有关于云南白药致不良反应的个例报道[10-12]。为进一步探究云南白药胶囊在真实临床使用过程中的安全性, 发现未知、罕见不良反应以及诱发不良反应发生的影响因素, 评估云南白药胶囊在大样本人群中使用的安全性。本研究在辽宁省内选择了14家医院作为集中监测点, 共收集到接受云南白药胶囊治疗的2019例患者的临床资料, 在有合并用药的情况下, 对照研究分析2019例服用云南白药胶囊的患者中出现不良反应患者的病例数据, 探索云南白药胶囊不良反应发生的影响因素。评估云南白药胶囊的临床安全性, 提出云南白药胶囊不良反应发生的防治措施, 为临床合理用药提供一定的参考。现报告如下。
1 资料与方法
1.1 一般资料 选择2015年6月~2016年12月本院联合辽宁地区其他13家医院内骨科、消化科、耳鼻喉科、妇科、外科、眼科及其他科室(包括急诊科、呼吸科、老年病科、康复科)等多个临床科室中接受云南白药胶囊治疗的急诊、门诊和住院患者2019例作为研究对象。所有入组患者的诊疗及给药方案, 均由各监测医院具体负责该例患者入组的临床医生根据患者的实际病情, 并结合自身临床用药经验进行制定, 具体包括云南白药胶囊的用法用量、疗程、合并用药等,本研究的研究方案对此不作任何限定。
1.2 方法
1.2.1 研究设计 本研究为上市后的安全性主动监测研究,是真实世界研究。故在研究方案中没有设定特定的患者纳入及排除标准, 只要来院就诊的患者的病症在云南白药胶囊说明书的适应证范围内, 且不属于云南白药胶囊使用禁忌证的人群(如孕妇、明确对云南白药胶囊有过敏史等, 详细标准可参考云南白药胶囊的使用说明书), 由医生处方云南白药胶囊进行治疗的患者, 均可纳入本研究。整个研究采用了巢氏病例对照研究的方法, 以集中监测过程中出现不良反应的患者作为“病例”, 以未发生不良反应的患者作为“对照”, 收集其病史资料及其他特征, 进行病例对照研究。探索云南白药胶囊致不良反应发生的影响因素。
在用药期间, 患者基本信息、药品使用情况等均进行详细记录, 包括患者原患疾病、一般资料、过敏史、药物不良反应史、合并用药名称、生产批次、用法用量、疗程、治疗方案等信息。在整个研究期间, 患者发生的任何不良事件均要记录, 包括不良事件名称及特征、发生和消失时间、处理措施、对原发疾病的影响及转归等信息。对于既往有肝肾功能损害者, 在治疗前后进行了肝肾功能的监测。不良事件相关信息由负责该病例的临床医生详细记录到安全性监测病例报告表(CRF)中。
1.2.2 观察时点 患者在用药期间, 每天随访患者不良事件的发生情况;在用药结束后第14天进行末次随访, 以观察迟发性不良反应, 并嘱患者在此期间一旦出现不良事件,需立刻主动报告。
药品不良事件(ADE):根据世界卫生组织(WHO)的定义,药品不良事件是指药物治疗过程中所发生的任何不幸的医疗卫生事件, 而这种事件不一定与药物治疗有因果报应关系。药品不良反应(ADR):指在按规定剂量正常应用药物的过程中产生的有害而非所期望的, 与药物应用有因果关系的反应。
1.3 判定标准 根据WHO的标准规定, 将药品不良事件/反应分为轻度、中度、重度和严重4个级别, 具体判定标准如下, 轻度:有症状出现, 但很轻微;中度:症状稍重, 但能很好地耐受, 不影响正常工作;重度:症状影响正常生活,患者难以忍受, 需要停药或对症处理;严重:症状严重, 危机患者生命, 致死或致残, 须立即停药或紧急处理。
2 结果
2.1 各研究中心入组情况及科室分布 2019例患者中骨科1256例、消化科19例、耳鼻喉科2例、妇科1例、外科272例、眼科141例、其他科室328例。其他科室涵盖急诊科、呼吸科、康复科、老年病科, 丹东市人民医院的其他科室为呼吸科,铁西区中心医院、沈河区人民医院、沈阳市德济医院、武警辽宁总队医院、东港市骨科医院的其他科室均为急诊科。见表1。

表1 2019例患者各研究中心入组情况及科室分布(n)
2.2 患者的基本情况 2019例患者中男1290例, 女729例;平均年龄(51.8±16.1)岁, 平均体重(66.6±10.2)kg。见表2。
2.3 患者的基本生命体征 2019例患者平均收缩压为(128.2±12.7)mm Hg(1 mm Hg=0.133 kPa)、 平 均 舒 张 压 为(79.6±8.0)mm Hg、平均脉搏(76.1±7.9)次/min、平均呼吸频率(18.7±2.1)次/min。见表3。
2.4 患者的就诊信息 2019例患者中841例于门诊(含急诊)就诊, 1178例患者于住院部就诊。见表4。
2.5 患者的病史及过敏史等情况 2019例患者中有家族史24例, 有传染病史10例, 有过敏史51例, 有手术、外伤史223例, 有伴随疾病248例, 有药品不良反应史12例。见表5。
2.6 患者治疗期间云南白药胶囊的使用情况 2019例患者中1680例为首次使用本胶囊, 口服1990例, 口服+外用29例;平均每日用药量(7.9±1.1)粒/d;平均用药天数(17.3±9.5)d。见表6。
2.7 患者治疗期间合并用药及研究期间的随访方式 1532例患者治疗期间有合并用药, 441例无合并用药, 43例不详。随访方式包括患者自报、电话随访、护士检查、医生检查、其他。见表7、表8。
表2 2019例患者的基本情况[n(%), ±s, M]
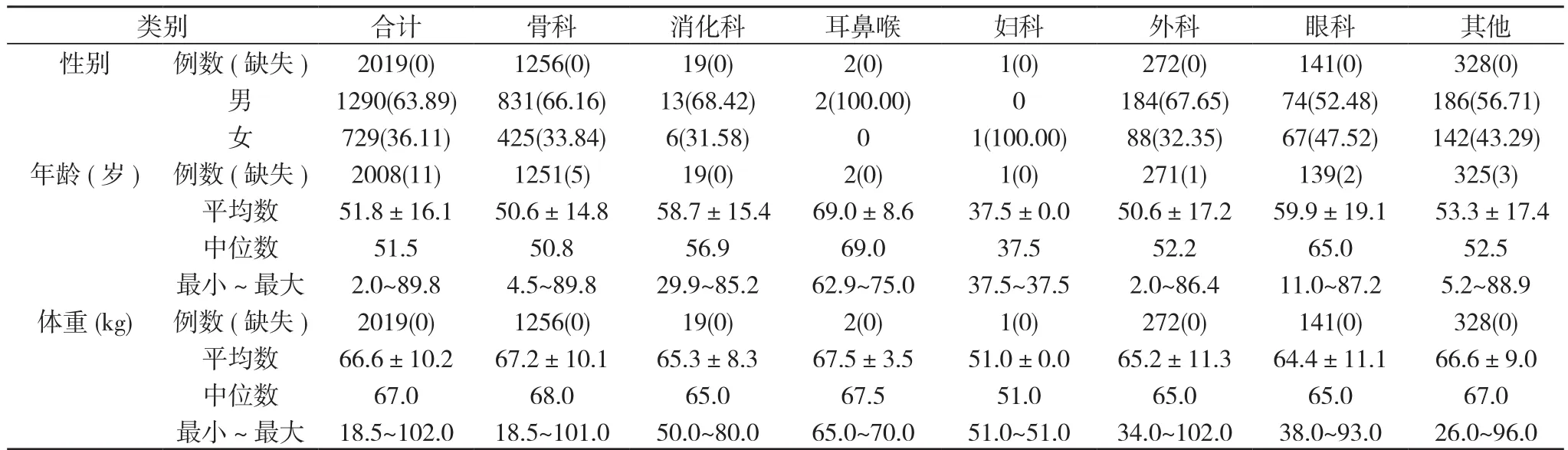
表2 2019例患者的基本情况[n(%), ±s, M]
类别 合计 骨科 消化科 耳鼻喉 妇科 外科 眼科 其他性别 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)男 1290(63.89) 831(66.16) 13(68.42) 2(100.00) 0 184(67.65) 74(52.48) 186(56.71)女 729(36.11) 425(33.84) 6(31.58) 0 1(100.00) 88(32.35) 67(47.52) 142(43.29)年龄(岁) 例数(缺失) 2008(11) 1251(5) 19(0) 2(0) 1(0) 271(1) 139(2) 325(3)平均数 51.8±16.1 50.6±14.8 58.7±15.4 69.0±8.6 37.5±0.0 50.6±17.2 59.9±19.1 53.3±17.4中位数 51.5 50.8 56.9 69.0 37.5 52.2 65.0 52.5最小 ~ 最大 2.0~89.8 4.5~89.8 29.9~85.2 62.9~75.0 37.5~37.5 2.0~86.4 11.0~87.2 5.2~88.9体重(kg) 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)平均数 66.6±10.2 67.2±10.1 65.3±8.3 67.5±3.5 51.0±0.0 65.2±11.3 64.4±11.1 66.6±9.0中位数 67.0 68.0 65.0 67.5 51.0 65.0 65.0 67.0最小 ~ 最大 18.5~102.0 18.5~101.0 50.0~80.0 65.0~70.0 51.0~51.0 34.0~102.0 38.0~93.0 26.0~96.0
表3 2019例患者基本生命体征( ±s, M)
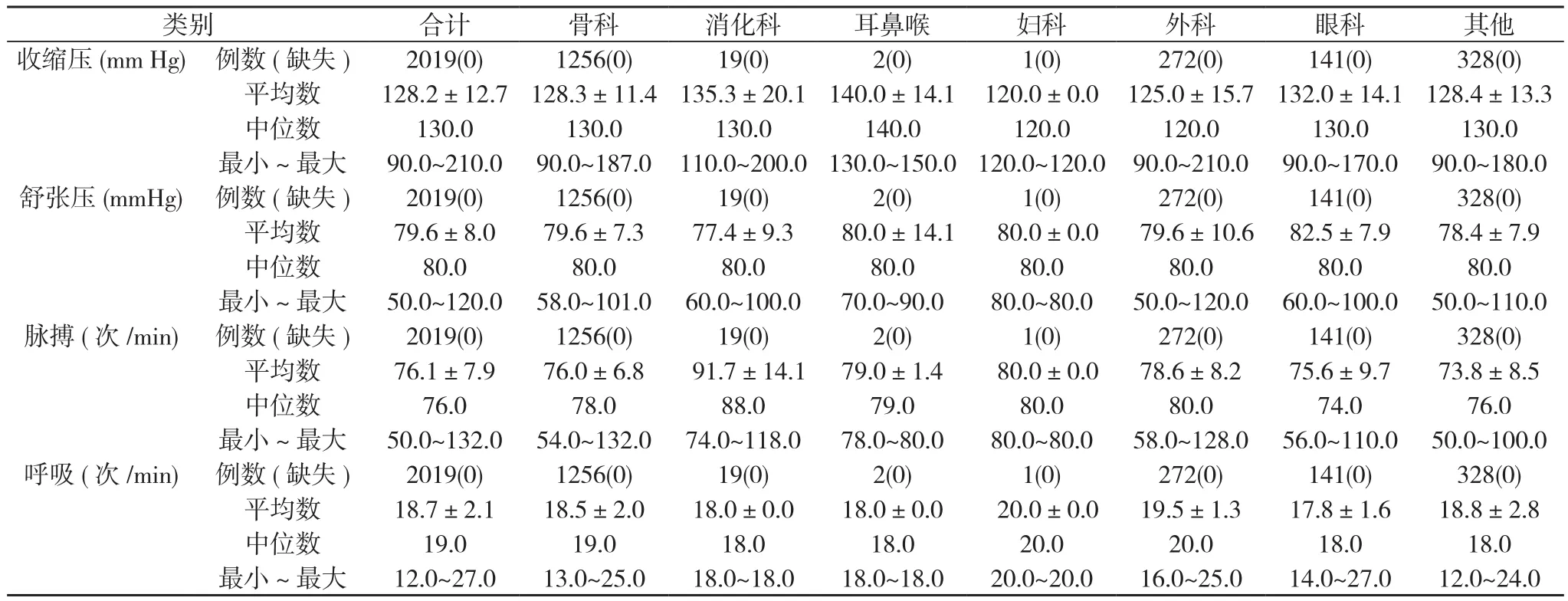
表3 2019例患者基本生命体征( ±s, M)
类别 合计 骨科 消化科 耳鼻喉 妇科 外科 眼科 其他收缩压(mm Hg) 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)平均数 128.2±12.7 128.3±11.4 135.3±20.1 140.0±14.1 120.0±0.0 125.0±15.7 132.0±14.1 128.4±13.3中位数 130.0 130.0 130.0 140.0 120.0 120.0 130.0 130.0最小 ~ 最大 90.0~210.0 90.0~187.0 110.0~200.0 130.0~150.0 120.0~120.0 90.0~210.0 90.0~170.0 90.0~180.0舒张压(mmHg) 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)平均数 79.6±8.0 79.6±7.3 77.4±9.3 80.0±14.1 80.0±0.0 79.6±10.6 82.5±7.9 78.4±7.9中位数 80.0 80.0 80.0 80.0 80.0 80.0 80.0 80.0最小 ~ 最大 50.0~120.0 58.0~101.0 60.0~100.0 70.0~90.0 80.0~80.0 50.0~120.0 60.0~100.0 50.0~110.0脉搏(次/min) 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)平均数 76.1±7.9 76.0±6.8 91.7±14.1 79.0±1.4 80.0±0.0 78.6±8.2 75.6±9.7 73.8±8.5中位数 76.0 78.0 88.0 79.0 80.0 80.0 74.0 76.0最小 ~ 最大 50.0~132.0 54.0~132.0 74.0~118.0 78.0~80.0 80.0~80.0 58.0~128.0 56.0~110.0 50.0~100.0呼吸(次/min) 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)平均数 18.7±2.1 18.5±2.0 18.0±0.0 18.0±0.0 20.0±0.0 19.5±1.3 17.8±1.6 18.8±2.8中位数 19.0 19.0 18.0 18.0 20.0 20.0 18.0 18.0最小 ~ 最大 12.0~27.0 13.0~25.0 18.0~18.0 18.0~18.0 20.0~20.0 16.0~25.0 14.0~27.0 12.0~24.0
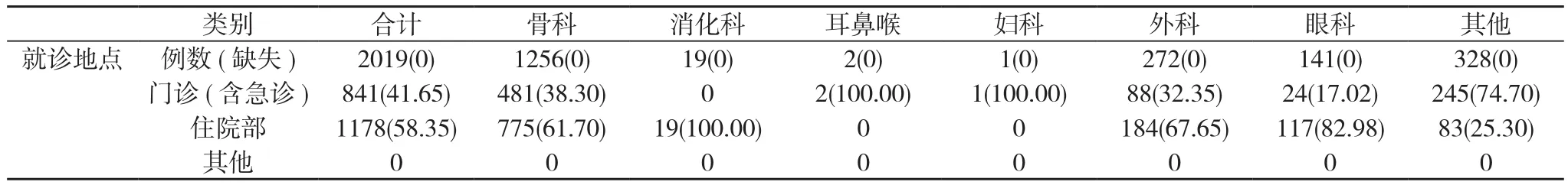
表4 2019例患者就诊信息[n(%)]
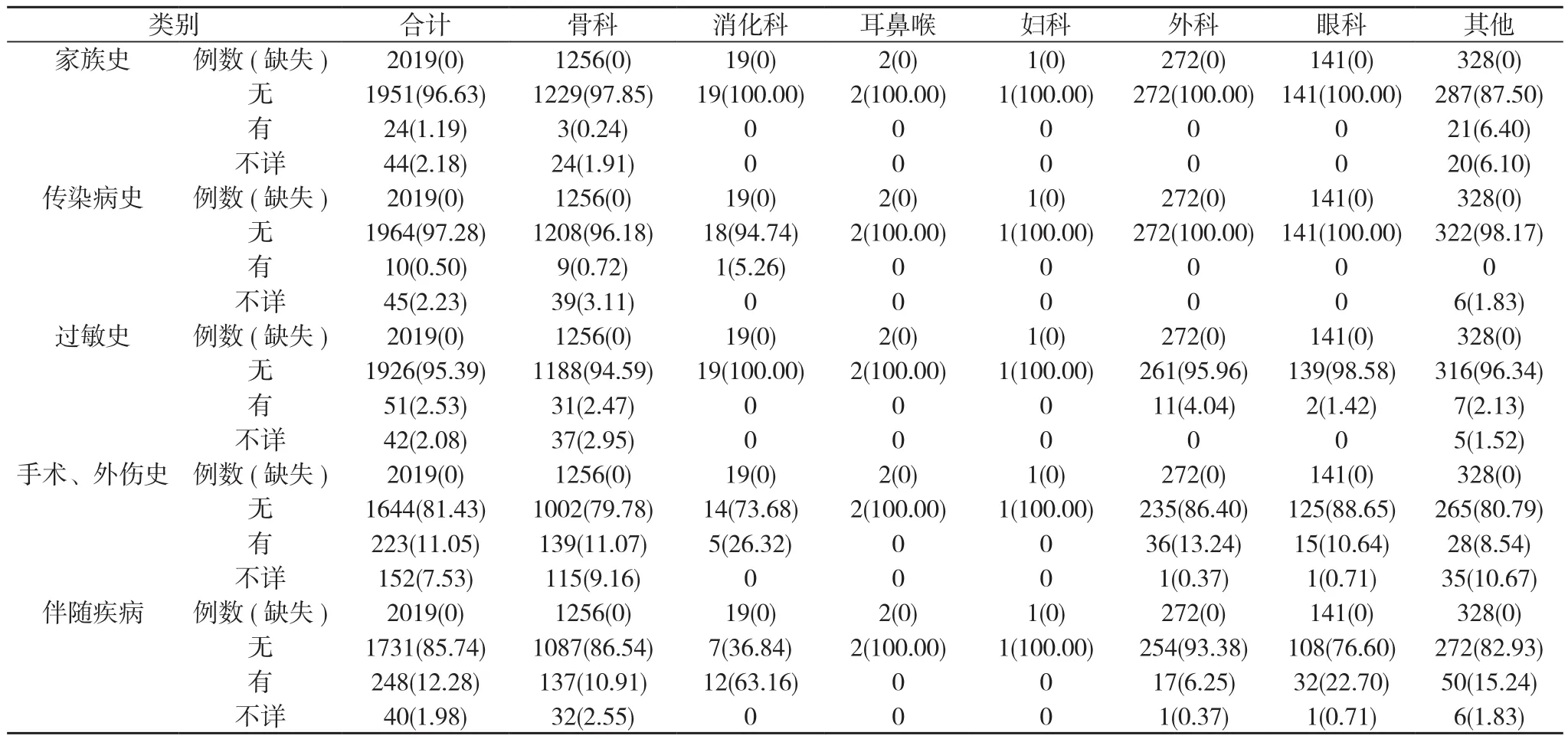
表5 2019例患者病史及过敏史等情况[n(%)]
2.8 不良事件及不良反应情况 2019例患者中收集到63例不良事件, 其中轻度59例, 中度4例, 重度0例。见表9。通过我国6级法判定结果为:有5例不良反应很可能与云南白药胶囊有关, 10例可能有关, 共收集到与云南白药胶囊有关的不良反应15例。详细分析见表10。
续表5
表6 2019例患者治疗期间云南白药胶囊的使用情况[n(%),±s, M]
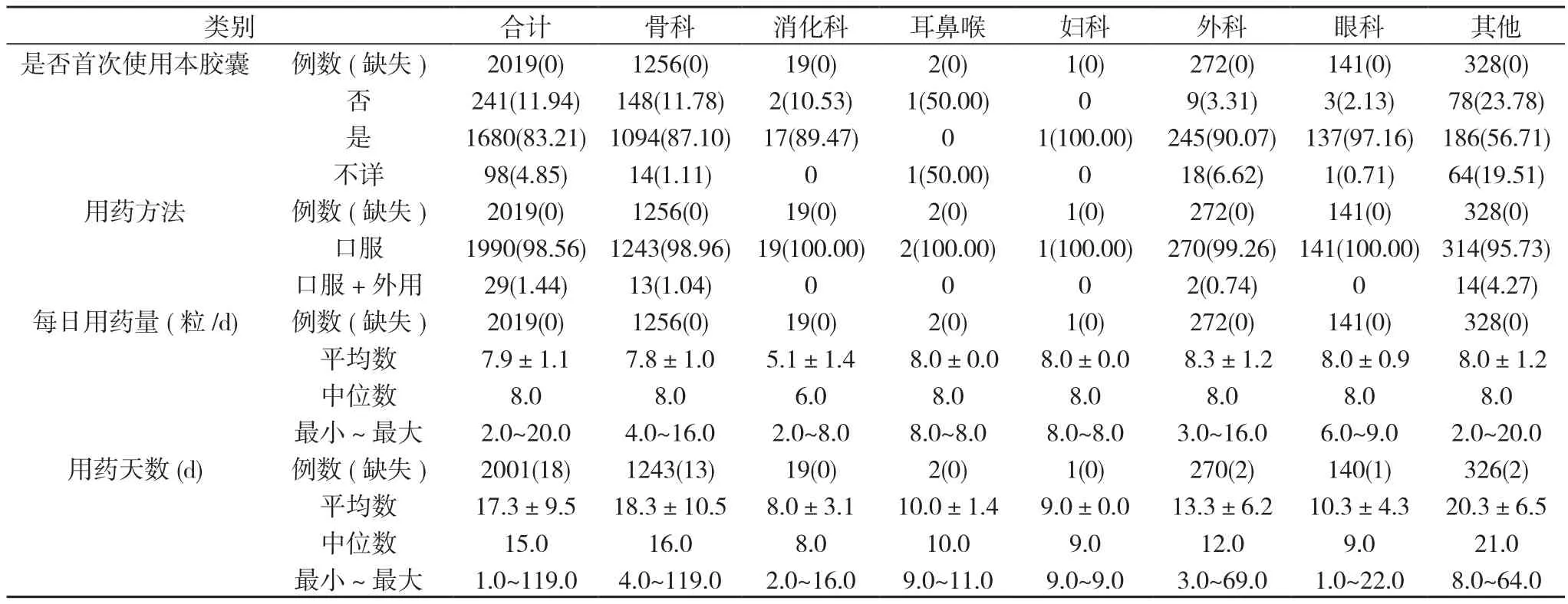
表6 2019例患者治疗期间云南白药胶囊的使用情况[n(%),±s, M]
类别 合计 骨科 消化科 耳鼻喉 妇科 外科 眼科 其他是否首次使用本胶囊 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)否 241(11.94) 148(11.78) 2(10.53) 1(50.00) 0 9(3.31) 3(2.13) 78(23.78)是 1680(83.21)1094(87.10) 17(89.47) 0 1(100.00) 245(90.07) 137(97.16) 186(56.71)不详 98(4.85) 14(1.11) 0 1(50.00) 0 18(6.62) 1(0.71) 64(19.51)用药方法 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)口服 1990(98.56)1243(98.96) 19(100.00) 2(100.00) 1(100.00) 270(99.26)141(100.00)314(95.73)口服+外用 29(1.44) 13(1.04) 0 0 0 2(0.74) 0 14(4.27)每日用药量(粒/d) 例数(缺失) 2019(0) 1256(0) 19(0) 2(0) 1(0) 272(0) 141(0) 328(0)平均数 7.9±1.1 7.8±1.0 5.1±1.4 8.0±0.0 8.0±0.0 8.3±1.2 8.0±0.9 8.0±1.2中位数 8.0 8.0 6.0 8.0 8.0 8.0 8.0 8.0最小 ~ 最大 2.0~20.0 4.0~16.0 2.0~8.0 8.0~8.0 8.0~8.0 3.0~16.0 6.0~9.0 2.0~20.0用药天数(d) 例数(缺失) 2001(18) 1243(13) 19(0) 2(0) 1(0) 270(2) 140(1) 326(2)平均数 17.3±9.5 18.3±10.5 8.0±3.1 10.0±1.4 9.0±0.0 13.3±6.2 10.3±4.3 20.3±6.5中位数 15.0 16.0 8.0 10.0 9.0 12.0 9.0 21.0最小 ~ 最大 1.0~119.0 4.0~119.0 2.0~16.0 9.0~11.0 9.0~9.0 3.0~69.0 1.0~22.0 8.0~64.0

表7 2019例患者治疗期间合并用药情况[n(%)]
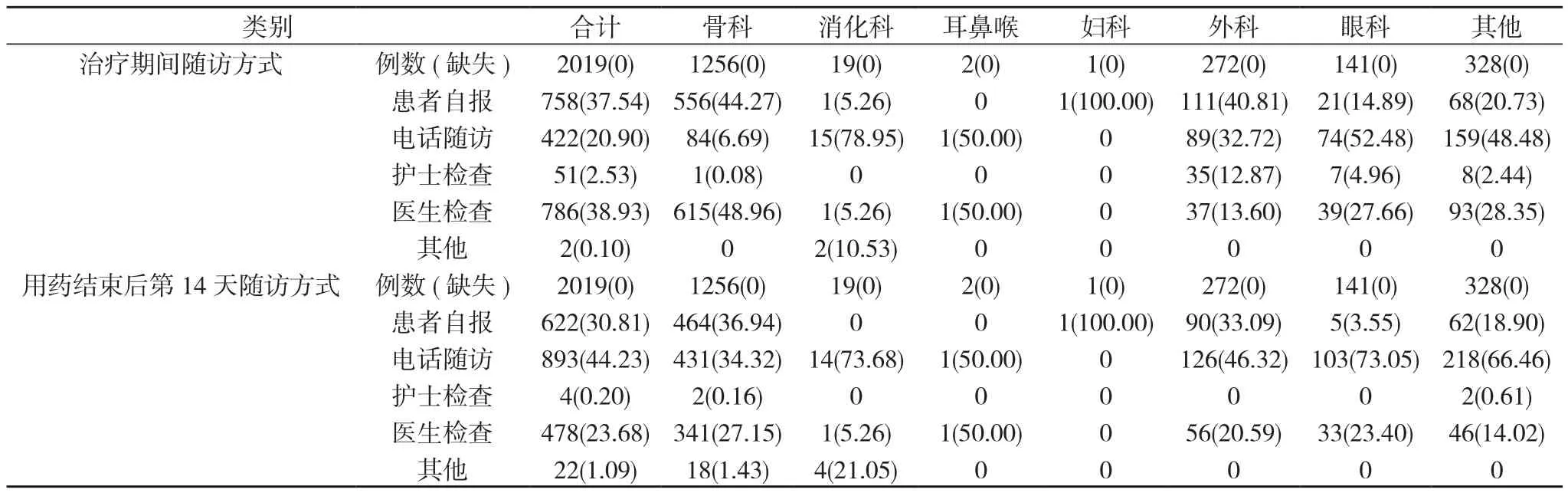
表8 2019例患者研究期间的随访方式[n(%)]

表9 2019例患者不良事件情况[n(%)]

续表9

表10 与云南白药胶囊有关的不良反应详细分析[n(%)]
2.9 被认定为与云南白药胶囊有关的不良反应分析 为进一步确保不良反应判定结果的准确性和科学性, 将收集到的63例不良事件的原始病历数据资料, 提交由国内不良反应判定领域的权威专家组成的专家委员会进行二次判定。最后, 不良反应判定专家委员会最终判定出18例与云南白药有关的不良反应, 不良反应发生率为0.892%(18/2019)。见表11。18例被认定为与云南白药有关的不良反应中, 5例为单用云南白药胶囊的患者, 13例患者有合并用药。单用云南白药胶囊的不良反应发生率为0.248%(5/2019), 有合并用药不良反应发生率为0.644%(13/2019), 属偶见级别。与云南白药胶囊有关的不良反应发生时段, 见表12。其中2例全身性疾病及给药部位各种反应, 16例胃肠系统疾病, 见表13, 图1。轻度16例, 中度2例。见表14。18例不良反应均消失。见表15。
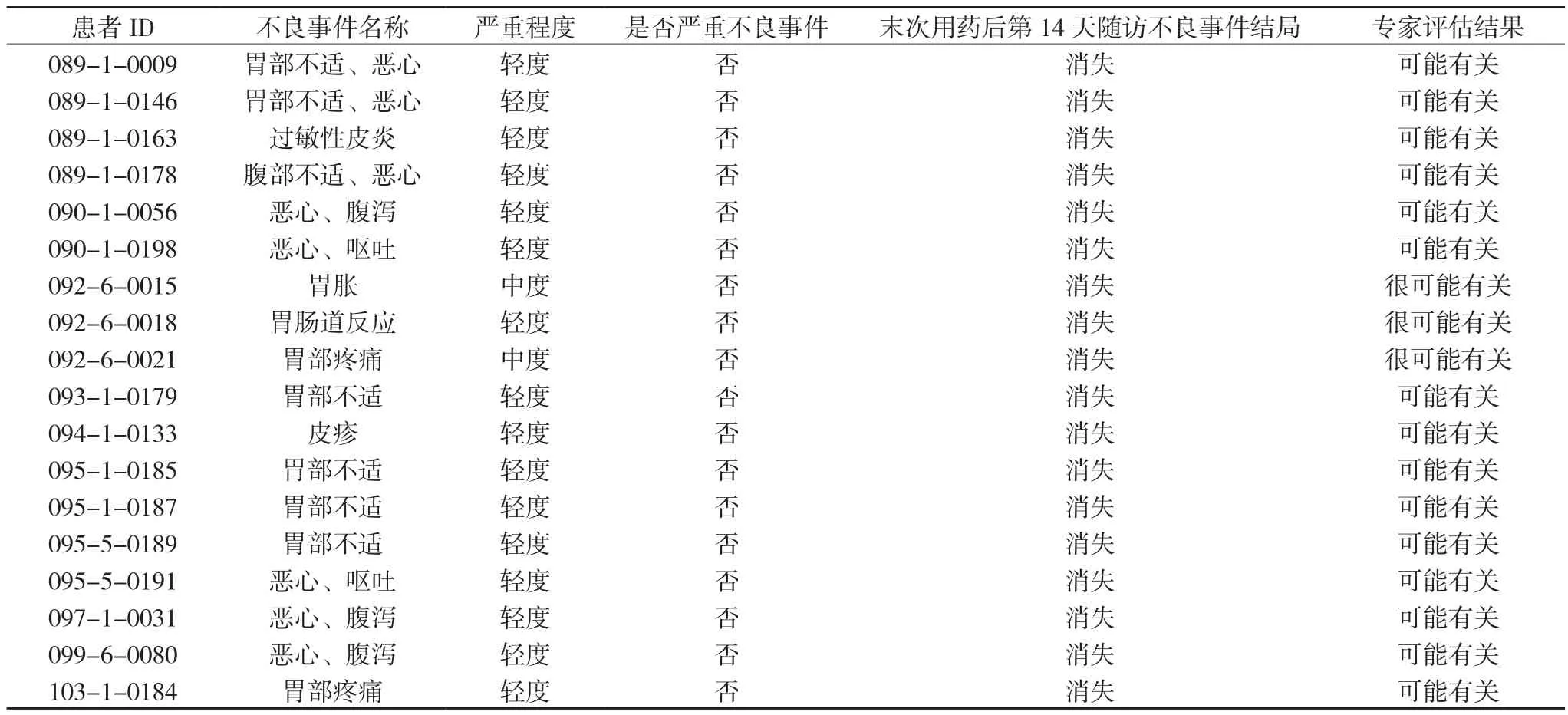
表11 被认定为与云南白药胶囊有关的不良反应专家评估结果

表12 与云南白药胶囊有关的不良反应发生时段(n, %, n=18)

表13 与云南白药胶囊有关的不良反应各系统发生情况(n, ‰, n=2019)
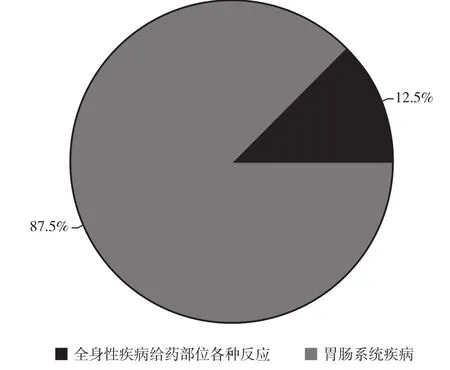
图1 与云南白药胶囊有关的不良反应类型图
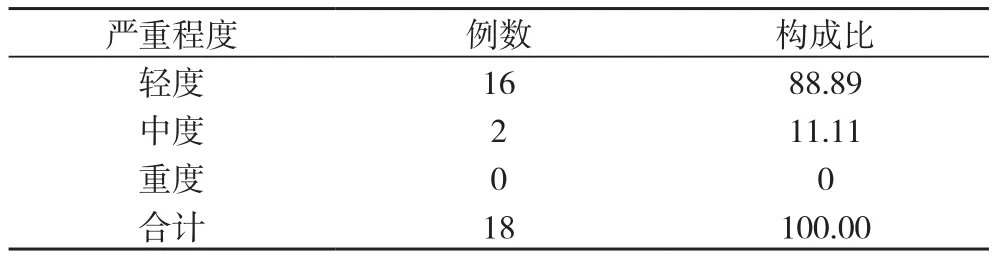
表14 与云南白药胶囊有关的不良反应严重程度分布(n, %, n=18)

表15 与云南白药胶囊有关的不良反应结局(n, %, n=18)
3 讨论
3.1 云南白药胶囊致不良反应的原因分析及应对措施 云南白药历史悠久, 自1902年问世以来, 使用至今已有100余年的历史, 因其疗效显著, 价格低廉, 而享有盛名。但随着云南白药用药科室、治疗疾病及用药人群的不断扩展, 临床上偶见有患者使用云南白药后出现过敏、皮疹、恶心、呕吐、胸闷心慌等不良反应的相关报道。
云南白药为国家保密配方, 且成分复杂, 在临床使用过程中, 引发不良反应的机制和原因尚不明确。猜测不良反应的发生可能与人体对其中某些化学成分的敏感性有关。除此之外, 云南白药具有特异性香气, 略感清凉, 并有麻舌感, 且服用1 d内, 忌食蚕豆、鱼类及酸冷食物, 因此, 对特异性气味过敏或者易过敏体质的人群应慎用。本文作者通过在中国知网、万方、维普等数据库中以“云南白药”、“致”、“引起”、“不良反应”、“中毒”等关键词检索相关文献资料, 进行分析后发现:云南白药导致不良反应发生的主要原因是由于患者用药剂量过大、用药时间过长, 患者严格按照药品说明书的用法用量使用云南白药后出现不良反应的个例报道较为少见。此外, 还有文献曾报道过云南白药存在着引发过敏性休克的可能。因此, 过敏性体质和有用药过敏史的患者也需慎用;如果曾经使用云南白药后发生过过敏反应的患者, 应避免再次使用。另外, 虽未有研究表明, 有青霉素类药物和磺胺类药物过敏史的患者与使用云南白药过敏的患者间存在关联性, 但云南白药所致的不良反应中, 也有一部分患者存在青霉素类药物和磺胺类药物过敏史, 所以对青霉素类药物和磺胺类药物过敏患者使应慎用云南白药。为了提高云南白药临床使用的安全性,临床医生在处方患者云南白药时, 应注意以下几点:①适宜的用药人群的选择。临床医生在开具处方之前, 应详细了解患者的病情情况, 认真询问患者的所有病史、曾经用药史、过敏反应史及生活中的特殊饮食等方面, 综合分析之后再决定是否给予云南白药。如此一来, 可有效降低患者不良反应发生率。②倡导严格按照说明书的适应证和用法用量进行使用。处方时, 嘱咐患者严格按照说明书进行用药, 不可因求愈心切而在短时间内重复、超剂量服药;更不可超适应证用药。③加强医院患者的用药监测, 一旦发现与云南白药胶囊相关的不良反应的苗头, 应及时采取相应措施进行纠正;出现不良反应之后, 不论症状轻重, 应给予患者高度的重视并采取措施进行救治, 及时将不良反应整理呈报至相关部门。
3.2 中成药上市后安全性再评价研究方法 在中成药上市前的临床研究中, 尽管要严格考察其安全性, 但受样本量少、用药限制严格、受试人群固定等随机对照试验固有特点的影响, 很难对药物的安全性做出深入的评价。因此, 加强中成药上市后的安全性再评价意义重大。目前, 上市后不良反应监测主要有自发呈报系统、强制性报告系统、医院集中监测、基于药物流行病学的病例对照研究、队列研究等[14]。医院集中监测是指在一定的时间(数月或数年)、一定的范围内(一家或几家医院、某一个或几个地区、甚至全国性)详细登记某一药品的使用情况和不良事件发生情况, 研究不良反应发生规律和影响因素[15]。巢式病例对照研究是目前较为适合于此类研究的药物流行病学方法之一, 是将传统的病例对照研究和队列研究要素组合后形成的一种研究方法, 即在对一个事先确定好的队列进行随访观察的基础上, 再应用病例对照研究(主要是匹配病例对照研究)的设计思路进行相关影响因素的研究[16]。在中药上市后安全性评价中, 对于发生率小的不良事件的评价可以用病例对照研究的方法。
目前临床上, 云南白药胶囊被各大医院广泛应用于骨科、消化科、耳鼻喉科、妇科、肛肠科及眼科等, 治疗各种跌打损伤、瘀血肿痛、吐血、痔血等各类临床症状, 深受广大临床医生和患者青睐[17-20]。经过临床安全性监测研究, 证明了云南白药胶囊安全性非常可靠, 是一个值得临床广泛推广使用的药物[21-24]。本研究结果表明, 云南白药胶囊在临床实际使用过程中是相对安全的, 偶见过敏反应、胃肠道反应等不良反应, 反应多较轻微, 对原疾病治疗几乎不受影响。从本研究纳入的辽宁省内14家医院7个不同类别科室共2019例患者进行研究, 最终有18例与云南白药有关的不良反应。云南白药与其他药物联用不良反应发生率为0.644%, 属偶见级别。
