胃印戒细胞癌伴发黑棘皮病1例报道及文献分析
2019-07-22沈晔华陈其文
董 舒,张 皓,刘 渊,沈晔华,陈其文,4
1. 复旦大学附属肿瘤医院中西医结合科,复旦大学上海医学院肿瘤学系,上海200032;
2. 复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032;
3. 复旦大学附属肿瘤医院内镜中心,复旦大学上海医学院肿瘤学系,上海200032;
4. 复旦大学公共卫生学院健康教育教研室,上海 200032
黑棘皮病(acanthosis nigricans,AN)最早由 Pollitzer和Jaurorky在1890年报道并命名,是以皮肤色素沉着、角化过度、天鹅绒样增生,形成疣状赘生物为特征的皮肤角化性疾病,好发于皮肤皱褶部位,如腋窝、颈后、肘窝、腘窝、腹股沟及阴唇[1]。恶性AN是指伴有恶性肿瘤的AN,笔者诊治1例伴有胃印戒细胞癌的恶性AN,报告如下。
1 临床资料
患者,男性,43岁,因“全身皮疹3月”收入复旦大学附属肿瘤医院。患者2017年1月起无明显诱因出现躯体及四肢皮损,患处皮肤明显色素沉着、色黑、粗糙质硬,伴疣状赘生物,有瘙痒感,主要以面部、乳头、颈项部、腋下为主。患者皮肤表现见图1。患者于复旦大学附属肿瘤医院行颈部皮疹活检,病理学检查提示,见散在组织细胞,未见肿瘤细胞(图2)。肿瘤标志物糖类抗原CA19-9>1 000 U/mL(参考值0.00~27.00 U/mL)。2017年3月31日血常规检测结果显示,白细胞为14.3×109/L,中性粒细胞为9.7×109/L,血红蛋白为161.0 g/L,血小板为306.0×109/L,不伴有发热。2017年3月22日,患者接受PET/CT检查,结果显示,两肺弥漫多发小结节,全身多发肿大淋巴结,FDG代谢异常增高,考虑为淋巴瘤或感染性病变(图3)。胆囊窝肝面局限性FDG代谢增高。肝左叶囊肿,L1椎体良性改变。胃镜提示胃窦小弯癌可能大(图4A)。胃窦活检病理学检查结果显示为低分化腺癌,部分为印戒细胞癌(图4B、C)。肠镜检查未见明显异常。2017年4月10日对患者行腹腔淋巴结穿刺活检,病理学检查结果显示为恶性肿瘤细胞,倾向癌(图5)。其他检查:乙型肝炎病毒表面抗原(+),乙型肝炎病毒表面抗体(-),乙型肝炎病毒e抗原(+),乙型肝炎病毒e抗体(-),乙型肝炎病毒核心抗体(+),丙型肝炎病毒抗体(-),人类免疫缺陷病毒抗体(-),梅毒抗体(-),尿常规(-),粪常规/粪隐血(-)。肿瘤标志物:鳞状细胞癌相关抗原2.20 ng/mL(参考值0.00~1.50 ng/mL),CA12-5 38.61 U/mL(参考值0.00~35.00 U/mL),神经元特异性烯醇化酶93.21 ng/mL(参考值0.00~16.30 ng/mL),CA19-9>1 000 U/mL(参考值0.00~27.00 U/mL),CA72-4>300 U/mL(参考值0.00~6.90 U/mL),CA50>500 U/mL(参考值0.00~25.00 U/mL),CA242>200 U/mL(参考值0.00~20.00 U/mL),CYFRA21-1>500 ng/mL(参考值0.00~3.30 ng/mL),甲胎蛋白(-),癌胚抗原(-)。肝肾功能检查结果显示,血清总胆红素为9.5 μmol/L,碱性磷酸酶为120.0 U/L,谷丙转氨酶(glutamic-pyruvic transaminase,GPT)为58.8 U/L,谷草转氨酶(glutamic oxaloacetic transaminase,GOT)为64.1 U/L,乳酸脱氢酶(lactate dehydrogenase,LDH)为1 036 U/L,血清白蛋白为37.7 g/L,血清球蛋白为37.0 g/L,血清尿素为3.8 mmol/L,血清肌酐为62.0 μmol/L,血糖为5.0 mmol/L,体质量指数(body mass index,BMI)为20.57。患者入院后接受奥沙利铂联合口服替吉奥方案(奥沙利铂为135 mg/m2,替吉奥胶囊40 mg每天2次,第1~14天,3周方案,SOX)化疗2个疗程后,CA19-9下降为819.9 U/mL,同时,皮损较治疗前明显改善,疣状赘生物明显消退,图6为患者接受两个疗程化疗后面部皮肤与治疗前面部皮肤对比。其后患者在后续3个疗程的SOX方案化疗后,疾病出现迅速进展,患者及家属放弃治疗,于2017年12月中旬死亡。
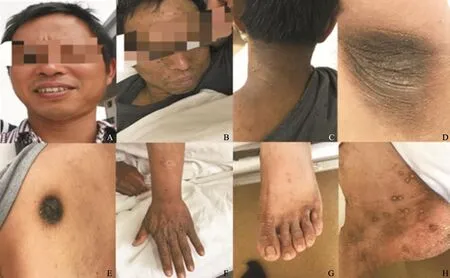
图 1 患者皮肤表现Fig. 1 Patient's skin appearance
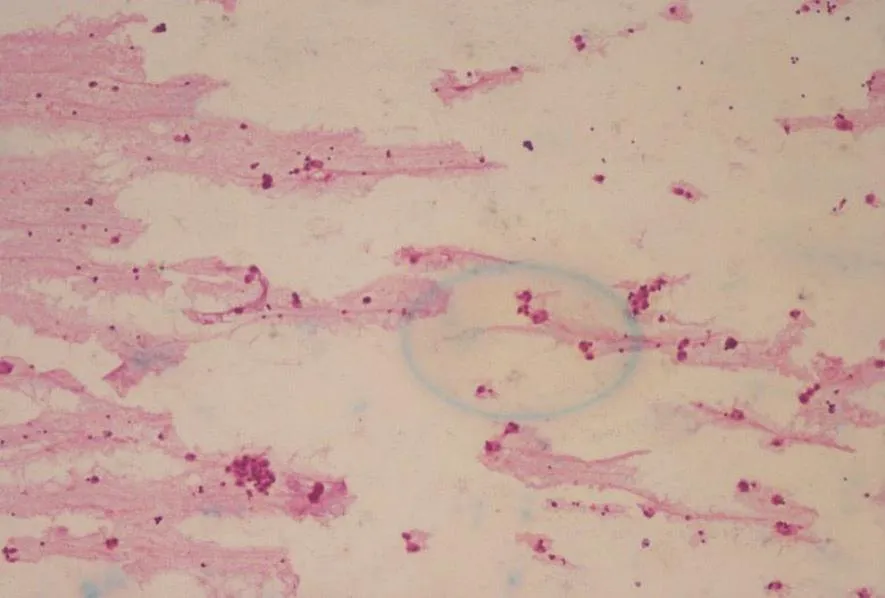
(H-E, ×10)图 2 病理学检查结果显示散在组织细胞,未见肿瘤细胞Fig. 2 Pathology diagnosis showed scattered tissue cells, no tumor cells
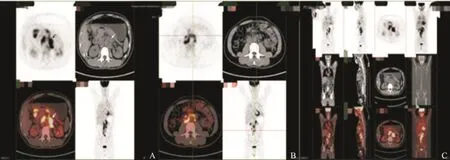
图 3 患者PET/CT检查Fig. 3 Patient's PET/CT scan
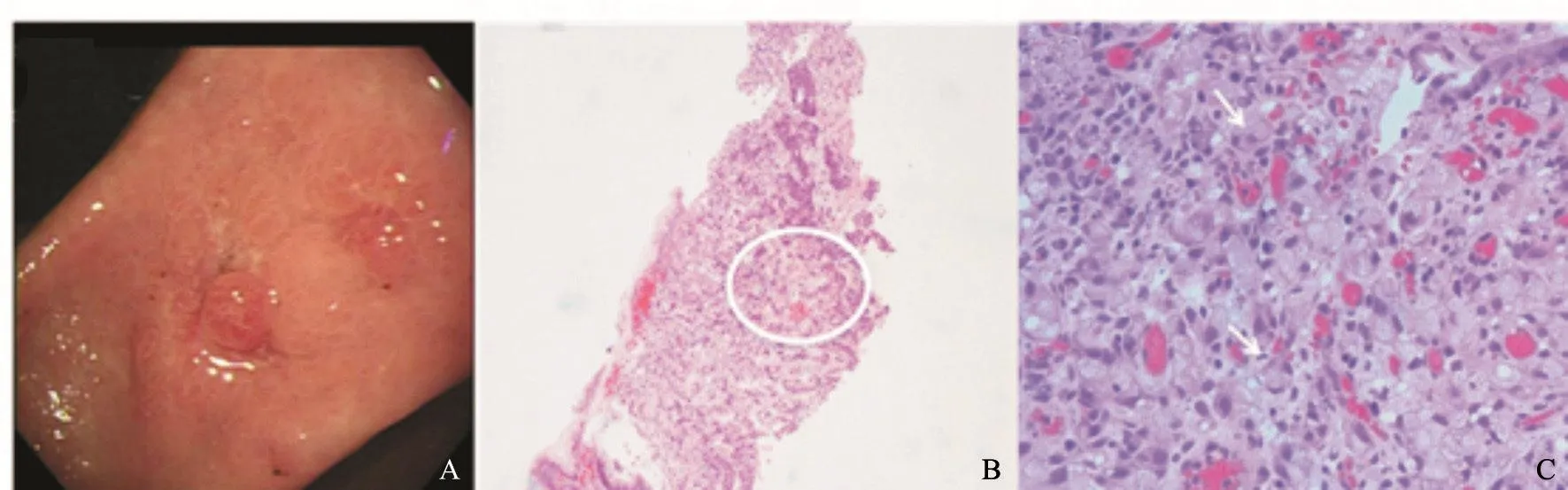
图 4 患者胃镜及活组织检查Fig. 4 Patient's examination by gastroscope and biopsy
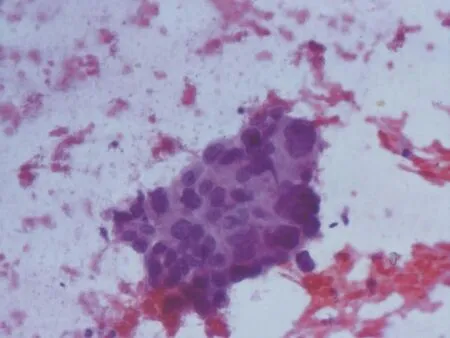
(H-E, ×40)图 5 显微镜镜下见成团排列的高度异型癌细胞Fig. 5 Microscope examination showed a highly heterogeneous mass of cancer cells
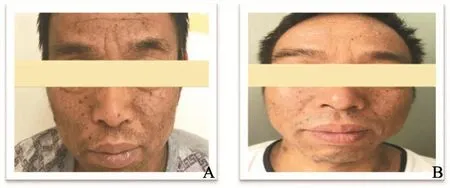
图 6 患者接受2个疗程SOX方案化疗后面部皮肤与治疗前面部皮肤对比Fig. 6 Patient's facial skin before and after 2 cycles of SOX chemotherapy
2 讨 论
多种肿瘤可以合并皮肤症状,如非霍奇金淋巴瘤或慢性淋巴细胞白血病可伴有副肿瘤性天疱疮[2],白血病患者可伴有急性发热性中性粒细胞性皮病[3],胰高血糖素瘤可伴有坏死松解游走性红斑[4]等。而AN其皮损较为特别,主要表现为皮肤呈天鹅绒样增厚、色素沉着,形成疣状赘生物为特征的皮肤角化性疾病。可发生在身体的任何部位, 好发于皮肤皱褶部位,特别是腋下、颈背、颈侧、腹股沟、肘前等部位。在黏膜,乳头瘤样增生较色素沉着常见,口腔、咽、喉、食管、肛门和生殖器黏膜乳头瘤样增生均有报道[5-7]。
AN的病因未明,可分为非恶性与恶性两大类。非恶性AN可发生在任何年龄,可在出生时、青春期、成年早期发病,多与胰岛素抵抗、代谢综合征(metabolic syndrome,MS)、2型糖尿病(type 2 diabetes mellitus)、肥胖密切相关[8]。恶性AN主要发生于中、老年,伴有恶性肿瘤[9]。皮损发展迅速且严重,色素沉着明显且不限于增厚皮损,黏膜及皮肤黏膜交界处亦有典型皮损,是其背后恶性肿瘤的报警症状。恶性AN多与消化道恶性肿瘤有关,其病因尚不甚清楚,有人认为与恶性肿瘤产生的嗜表皮因子、表皮生长因子、血小板衍生生长因子等促生长因子有关[10];另外,肿瘤释放的激素,如促黑素细胞激素等,能够刺激黑素细胞、角质细胞和成纤维细胞的生长[11]。恶性AN皮肤症状的轻重常与肿瘤的发生、发展密切相关,目前尚无针对皮肤症状的特效治疗药物,治疗上以针对恶性肿瘤的手术、放化疗、靶向药物等治疗手段等为主。若上述方法治疗肿瘤有效,则可明显改善皮肤症状[12]。观察恶性AN的皮损变化也是观察恶性肿瘤的动态、手术或化疗效果以及是否复发的重要辅助证据,亦进一步证实恶性肿瘤与AN的因果关系及AN的发病机制。本例患者血糖正常,BMI正常,无肥胖史,且年龄为中年,不存在非恶性AN的基础疾病证据;同时,患者SOX方案治疗2个疗程后,其相关的肿瘤指标下降,自觉皮肤瘙痒症状好转,皮损亦随之改善,根据患者穿刺标本的病理学检查结果、实验室检查结果及临床表现可确认胃印戒细胞癌伴发AN的诊断,排除非恶性AN。
AN与恶性肿瘤同时存在并不意味着可诊断为恶性AN,后者必须是由恶性肿瘤引起或加重了原有的皮损。AN本身的发病机制也支持了这种相关性的存在,所有AN中约有20%为恶性[13],其与内脏癌变同时发生者占61%,发生于恶性肿瘤之前者占17%、之后者占22%[14],AN伴发的恶性肿瘤以腺癌居多,常见于胃肠道、肺及乳腺,此外,还有食管癌、肝癌、胰腺癌、卵巢癌等[15]。因单一检查手段的敏感性有局限,临床经常需联合多种检查手段以诊断恶性肿瘤。本例患者PET/CT未提示胃部有异常FDG代谢增高,因PET/CT本身在敏感性方面存在不足,某些恶性肿瘤,如胃印戒细胞癌、高分化肝细胞肝癌[16],可不摄取18F-FDG,而表现为PET/CT检查的阴性结果。
目前肿瘤发病有年轻化的趋势,不可因流行病学提示非恶性AN的发病年龄偏小,便忽略年轻患者恶性AN存在的可能。笔者建议对于皮肤症状考虑AN的患者,无论年龄性别均应排除恶性肿瘤,经过完备的排除诊断后,方可谨慎地诊断为非恶性的AN,以免延误恶性肿瘤的治疗。对于皮肤表现考虑为AN的患者,我们建议至少要进行以下检查来排除恶性肿瘤:① 血常规,粪隐血。因一部分消化道肿瘤存在慢性失血,可导致贫血,故不符合患者年龄、性别的过低的血红蛋白浓度,尤其合并粪隐血的小细胞低色素为特征的缺铁性贫血患者中,应警惕消化道肿瘤的存在。② 全套肿瘤标志物。如伴有肿瘤标志物升高,尤其是多个肿瘤标志物升高,应高度警惕恶性肿瘤。③ 影像学检查。尤其是腹部(增强CT)检查,平扫CT因诊断敏感性及特异性较低,故不优先考虑。④ 消化内镜。CT、MRI等影像学手段,对于胃肠等消化道肿瘤敏感性有限,需结合直观的内窥镜检查以排除肿瘤的存在。
