碘难治性分化型甲状腺癌的诊治管理共识(2019年版)
2019-07-22中国临床肿瘤学会CSCO甲状腺癌专家委员会中国研究型医院学会甲状腺疾病专业委员会中国医师协会外科医师分会甲状腺外科医师委员会医促会甲状腺疾病专业委员会核医学组北京市核医学分会治疗学组
中国临床肿瘤学会(CSCO)甲状腺癌专家委员会中国研究型医院学会甲状腺疾病专业委员会中国医师协会外科医师分会甲状腺外科医师委员会医促会甲状腺疾病专业委员会核医学组北京市核医学分会治疗学组
甲状腺癌的发病率呈逐年增高趋势,同时晚期甲状腺癌的死亡率亦呈增高趋势[1]。甲状腺乳头状癌(papillary thyroid cancer,PTC)、甲状腺滤泡癌(follicular thyroid cancer,FTC)及嗜酸细胞肿瘤(Hürthle cell thyroid tumor)占甲状腺癌的90%以上,因其一定程度上保留了甲状腺滤泡上皮细胞的功能,故被称为分化型甲状腺癌(differentiated thyroid cancer,DTC)。大多数DTC患者经规范化治疗后预后良好,但仍有约23%的患者发生远处转移[2]。远处转移患者中约1/3在其自然病程或治疗过程中,肿瘤细胞形态和功能发生退行性改变,浓聚碘的能力丧失,最终发展为碘难治性DTC(radioiodine refractorydifferentiated thyroid cancer, RAIR-DTC)[3-4]。RAIR-DTC患者的生存期较摄碘良好的DTC患者显著缩短,平均生存期仅为3~5年,10年生存率约为10%[5]。目前,关于RAIR-DTC的界定、临床评估、多学科综合治疗及随访策略等热点问题仍存在争议,在中国RAIR-DTC靶向药物仍相对匮乏,各种靶向药物在RAIR-DTC的应用指征仍相对受限。由于RAIR的判断和识别是DTC诊治中的重要环节,有必要基于目前中国的诊治现状进一步规范RAIR-DTC的诊治及管理,本共识将综合目前国内外循证医学证据,以及包括核医学、外科学、肿瘤学、内科学及诊断学等多学科团队专家的意见,针对RAIR-DTC的界定、判断、临床处置及随诊管理提出相应的处理建议。
1 碘难治性DTC的界定
RAIR-DTC的界定需结合核医学、影像医学、肿瘤学、内分泌学等多学科进行综合判断。通常,在无外源性碘负荷干扰的情况下,促甲状腺激素(thyroid-stimulating hormone,TSH)刺激状态(>30 mIU/L)时,出现下列情形之一即可界定为RAIR-DTC[4,6]:
① 转移灶在清甲成功后的首次131I治疗后全身显像中即表现为不摄碘,致其无法从后续的131I治疗中获益。对于其他影像学检查提示转移而诊断性131I全身显像证实不摄碘(需除外患者准备不充分以及技术因素影响等)的患者,即使在后续的131I治疗后全身显像中出现摄碘,也可能因肿瘤吸收剂量未能达到控制病灶所需而难以从131I治疗中充分获益,故此种情况也可考虑为RAIR-DTC[7-9]。
② 原本摄碘的功能性转移灶经131I治疗后逐渐丧失摄碘能力。在131I治疗前就可能存在不同分化程度的肿瘤细胞,131I选择性清除病灶中分化较好的肿瘤细胞,而分化较差的肿瘤细胞则从131I治疗中“幸存”,从而逐渐呈现失分化特征,导致转移灶最终不摄碘,并可能反复被131I治疗前停用甲状腺激素后的高水平TSH所刺激而造成病情进展。
③ 部分转移灶摄碘,而部分转移灶不摄碘,且可被18F-FDG PET/CT、CT或MRI等其他影像学检查手段所显示。这些非摄碘性转移灶(尤其是18F-FDG阳性摄取病灶)更易因每一次131I治疗前停用甲状腺激素后的高水平TSH所激发而出现病情进展,因此,反复的131I治疗并未给患者带来明确获益及明确改善预后[10]。有学者提出,对非摄碘灶采取其他治疗措施而对摄碘灶继续131I治疗的联合治疗方案可能改善患者的获益[6,11-12],但目前尚无明确证据,故对此观点仍存在争议。如患者多数病灶仍具有摄碘功能,尤其是伴有明显的局部症状,则更可能通过后续的131I治疗(或包括131I治疗在内的联合治疗)缓解病情。
④ 摄碘转移灶在经过多次131I治疗后虽然保持摄碘能力但仍在1年内出现病情进展,包括病灶逐渐增长、出现新发病灶、血清甲状腺球蛋白(thyrogloblin,Tg)持续上升等。研究发现,经规范的131I治疗后如病情仍出现进展,则后续131I治疗常无效,且可能增加远期不良反应如白血病、继发性恶性肿瘤等的风险,故应考虑终止131I治疗[12]。然而,既往131I治疗是否规范(包括治疗剂量及重复治疗间隔时间等)、评估治疗反应的时间间隔及判定标准等因素均会影响对病情的判断。有学者认为,前次131I治疗后1年以上才发生病情进展恰恰证实患者对131I治疗反应良好,继续131I治疗仍可给患者带来获益;而治疗后0.5年内即发生病情进展方可判定为RAIR-DTC[13]。对于131I治疗后0.5年到1年发生病情进展的患者,应个体化权衡患者的可能获益及多次大剂量131I治疗带来的不良反应风险,并结合患者意愿来选择治疗策略,如继续131I治疗并未能给患者带来血清学和(或)影像学的获益,则应终止131I治疗。
需要指出的是,上述对RAIR-DTC的界定主要基于病灶的临床特征而非病理学改变,4种情形的发生机制不同、病情进程各异,部分摄碘性病灶有可能因为诊断仪器设备的灵敏度、显像方式、显像时间等因素未能捕捉到其摄碘情形而误判;亦可能由于目前对131I治疗评估及诊治体系的不完善(如不同病灶经131I治疗后的无进展生存期及再次131I治疗的指征等)而低估131I在RAIR-DTC中的价值[14]。因此,上述RAIR-DTC情形更多地说明患者在此状态下目前从进一步单一131I治疗模式中获益较少,其有可能通过更为有效的治疗手段如局部外放射治疗、靶向药物等系统性治疗,以及这些治疗尤其是靶向治疗诱导分化后与131I治疗的联合应用中进一步获益。可以预期,有关RAIR-DTC的界定及诊治策略有可能随着DTC诊治体系的完善而不断改进。
建议1:RAIR-DTC的界定需考虑核医学、影像学、肿瘤学、内分泌学等多学科的综合判断。
2 碘难治性DTC的判断
患者病史、Tg等血清学变化、131I-全身显像所见的病灶摄碘特征及其变化、影像学进展等是判断RAIR-DTC的重要依据。诊断影像(颈部超声、CT、MRI检查等)或功能影像检查(18F-FDG PET/CT、99mTc-MIBI亲肿瘤显像、整联蛋白受体显像及生长抑素受体显像等),均有助于进一步明确RAIR-DTC病灶的部位、大小、数量、侵犯程度等[6,14-20],为制定适宜的治疗策略提供依据。
此外,DTC患者131I治疗后动态监测Tg的变化,在辅助判断131I治疗效果的同时,对预测RAIR-DTC的发生也有一定价值。有研究发现,对于远处转移性DTC患者,如两次131I治疗前刺激性Tg下降不明显,则预示着可能进展为RAIRDTC[21]。
3 碘难治性DTC的处置及随诊管理
对于判断为RAIR-DTC的患者,尤其病灶不摄碘或虽摄碘但病情仍进展的患者,可考虑终止131I治疗[22]。在对RAIR-DTC患者的随诊管理中,要定期进行综合临床评估,根据患者病情制定适宜的个体化后续处置方案。RAIR-DTC进展的自然病程各异,可从几个月到几年不等。对于病情进展迅速的患者,可考虑分子靶向治疗。
建议2:对RAIR-DTC患者定期进行综合临床评估,以指导个体化后续处置方案的制定。
由热力学平衡方程可知,在体系中,Mg2+的存在形式有游离Mg2+、Mg(Ida)、Mg(OH)+、MgCO3(aq)和Mg(HCO3)+ 5种。以各物种中[Mg2+]与[Mg2+]T之比作图,考察其随[Ida2-]T(0.1~2.5 mol·L-1)和pH(5~14)的变化关系,如图6所示。
3.1 TSH抑制治疗下随诊监测
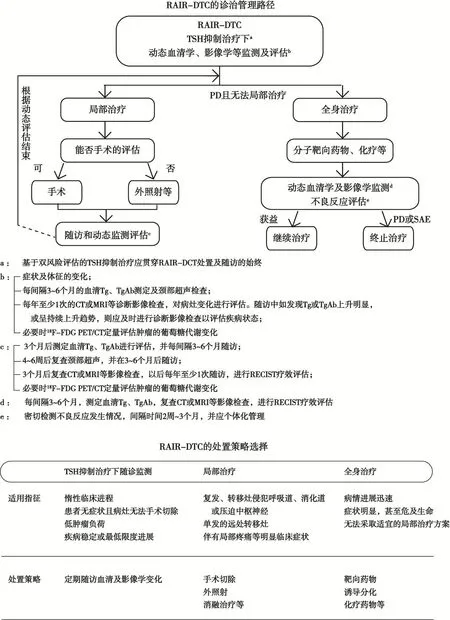
TSH抑制治疗下随诊监测主要适用于如下情况:惰性临床进程;患者无症状、且病灶无法手术切除;低肿瘤负荷;疾病稳定或最低限度进展;肿瘤病灶未对患者造成明显不良影响等[23]。对RAIR-DTC患者,考虑到疾病高危风险,应达到TSH低于0.1 mU/L的目标(尤其是对于体内尚存在摄碘病灶的患者,可能从严格的TSH抑制治疗中获益),但也应结合TSH抑制治疗不良反应的风险评估予以适当调整[6]。
TSH抑制治疗下应对患者进行定期随诊监测,建议多学科团队综合评估其疾病状态。监测内容包括:患者症状及体征的变化;每间隔3~6个月的血清Tg、甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)测定及颈部超声检查;每年至少进行一次的CT或MRI等影像学检查,并基于检查结果对病灶的变化进行评估;必要时可行18F-FDG PET/CT定量评估肿瘤的葡萄糖代谢变化。有研究证实,18F-FDG糖代谢与转移性RAIR-DTC患者的预后密切相关[24]。如多次随诊监测患者血清学及影像学检查结果提示病灶持续稳定,则可考虑适当延长随访间隔。如随访中发现Tg或TgAb上升明显,或呈持续上升趋势,则应及时进行影像学检查。如综合评估结果证实疾病进展(progressive disease,PD),则应调整治疗策略。
建议3:对于部分疾病稳定或进展缓慢、无法手术切除、低肿瘤负荷的RAIR-DTC患者,可采取TSH抑制治疗下随诊监测的策略。
建议4:TSH抑制治疗下随诊监测中,如发现疾病进展,则应及时调整治疗策略。
3.2 局部治疗
局部治疗的适应证包括:① 复发、转移灶侵犯呼吸道、消化道或压迫中枢神经;② 单发的远处转移灶;③ 伴有局部疼痛等明显临床症状等[23]。局部治疗的策略主要包括手术切除、外照射、消融治疗等。有手术指征者,应优先选择手术治疗,同时可根据患者个体化病情单一或联合应用上述治疗疗法。在采取相应局部治疗的同时,应维持TSH抑制治疗。
对RAIR-DTC患者采取局部治疗后,应定期随访以评估疗效,随访间隔因治疗方法及评估手段不同而有所差异。血清学检查可在3个月后进行评估,并每间隔3~6个月进行随访;超声评估可在手术治疗后的4周、外照射治疗后的4~6周及消融治疗后立即进行,并在3~6个月后随访[6,16,25];CT、MRI检查等可在3个月后进行,以后每年至少随访1次,并按照实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)评估疗效;必要时可行18F-FDG PET/CT定量评估肿瘤的葡萄糖代谢变化。如在随访中发现PD,则应考虑全身治疗。
建议5:对单发、伴有局部临床症状、侵犯周围重要脏器及组织结构的RAIR-DTC病灶,可采取局部治疗。
3.3 全身治疗
全身治疗的适应证主要为:① RAIR-DTC患者病情进展迅速;② 临床症状明显,甚至危及患者生命(但预期生存时间大于3个月);③ 无法采取适宜的局部治疗方案等[23]。全身治疗的策略主要包括抑制肿瘤生长和(或)抗血管生成的靶向药物治疗、诱导分化治疗、化疗等,其中靶向药物在进展期RAIR-DTC的治疗中正得到越来越广泛的应用。在采取全身治疗的同时应维持TSH抑制治疗。
给患者行靶向药物治疗前,应综合评估患者既往治疗史及反应、当前一般状况、合并基础疾病、血清及影像学进展等,积极控制合并症,了解是否存在可能导致靶向治疗不良反应发生风险升高的危险因素,在权衡患者获益及风险的基础上作出决策。同时应通过患者教育以实现治疗后不良反应的自我管理,及时复诊并接受规范处理。
RAIR-DTC患者开始接受靶向药物治疗后,应定期复查血清学及影像学变化,随访间隔为3~6个月,并进行疗效评估。由于靶向药物的不良反应比较常见,故RAIR-DTC患者接受靶向治疗后,应密切监测其不良反应发生情况。随访间隔2周~3个月,并应个体化管理,对不良反应及时对症处理,并关注其病情变化。如病灶不同程度缓解或维持稳定,且不良反应耐受较好,则可持续接受靶向药物治疗。但如果疗效评估结果为PD,或患者出现严重不良事件(serious adverse event,SAE)而难以耐受,则应终止靶向治疗[22]。RAIR-DTC的诊治管理路径和处理策略选择见附录Ⅰ。
建议7:对RAIR-DTC患者,如病情进展迅速,可考虑靶向药物治疗、化疗等。