凡纳滨对虾育苗水体中三种生物絮团的菌群多样性及Tax4Fun基因功能预测分析
2019-07-20杨章武杜秀萍卓吓晃许智海
张 哲 杨章武 葛 辉 杜秀萍 卓吓晃 许智海
(1. 福建省水产研究所福建省海洋生物增养殖与高值化利用重点实验室,厦门 361013; 2. 厦门市厦兴龙水产种苗有限公司,厦门 361026; 3. 福建省漳浦县水产技术推广站,漳州 363000)
凡纳滨对虾(Litopenaeus vannamei), 又称南美白对虾, 原产于中南美太平洋海域, 目前是我国最重要的对虾养殖品种, 养殖产量超过我国对虾养殖总产量的85%, 福建是我国重要的凡纳滨对虾种苗生产基地, 虾苗产量占全国的70%以上[1]。把生物絮团技术应用于凡纳滨对虾育苗生产, 形成生态化规模化育苗技术工艺, 是防止滥用药物、提高生物安全的重要技术手段。目前, 生物絮团技术已普遍应用在罗氏沼虾(Macrobrachium rosenbergii)[2]、罗非鱼(Oreochromisspp)[3]、草鱼(Ctenopharyngodon idella)[4]和鳙(Aristichthys nobilis)[5]等水产动物的养殖中, 一些研究表明, 碳源的不同类型可以影响生物絮团的组成和大小[6,7]。不同的絮团结构也将影响其内部聚集的菌群丰富度[8], 而保持菌群结构的稳定性对维持育苗水体生态平衡和水质净化能力具有重要意义[9,10]。在养殖水体中添加碳源, 在曝气和水流的物理作用下, 会产生不同颗粒大小的絮团, 絮团的颗粒过大不仅不利于虾苗抱食, 而且会消耗水体过多的溶氧; 过小的絮团颗粒, 则微生物群落较少[11], 且易于黏附在虾苗体表, 影响其正常脱壳。因此, 在养殖水体中培育适宜大小的絮团颗粒才能对虾苗的生长、存活、营养组成及水质净化产生有益的影响。
目前, 在凡纳滨对虾育苗中添加不同碳源对培育生物絮团大小的影响及其群落结构与功能的研究尚少涉及。本研究以3种碳水化合物作为不同的添加碳源, 进行生物絮团技术育苗标粗凡纳滨对虾苗实验, 测定不同碳源培育的絮团颗粒的大小, 并对3种生物絮团中微生物进行高通量测序, 比较其结构和功能, 旨在探索凡纳滨对虾育苗生产中有效的生物絮团技术措施, 以及为优质絮团的筛选提供理论依据。
1 材料与方法
1.1 实验设计与条件
实验在福建厦门海沧区厦兴龙水产种苗有限公司的种苗基地进行。实验养殖池为容积1.5 m3,深1.2 m的圆形玻璃钢桶, 每池设置气石4个, 1 kW加热棒及控温仪1套(精确度为±1℃)。实验养殖对象为凡纳滨对虾虾苗, 虾苗材料是由厦兴龙水产种苗公司生产的同一批无节幼体孵化而成, 体长0.2—0.5 cm, 实验设3种碳源(葡萄糖、淀粉和蔗糖)进行研究, 每组2个平行, 另设1个对照组, 每个养殖桶投放2×104尾P2仔虾, 养殖20d, 养殖期间投喂虾片等配合饲料(45%粗蛋白), 均购自饶平县永得利饲料有限公司, 每日投喂8次(每3h一次), 前期投饵量约2 g/m3, 后期增至3—5 g/m3, 根据水色、虾苗密度等不同情况灵活调整。在投喂饲料后分别添加葡萄糖、淀粉、蔗糖和芽孢杆菌, 碳源添加量设定为每日投饵量的80%, 芽孢杆菌每3天添加1次, 每次添加量按1.5×105cfu/mL, 菌粉提前4h用海水活化, 然后均匀泼洒入池。对照组不添加任何碳源和芽孢杆菌, 按正常投喂进行养殖。实验添加的碳源材料均购自超市, 芽孢杆菌由中国水产科学院南海水产研究所研发, 主要成分为地衣芽孢杆菌(Bacillus licheniformis), 菌含量1×1010cfu/g。
实验海水为海区抽取, 通过沉淀、砂滤、紫外灭菌处理后进入养殖池, 实验期间保持水温为28℃,盐度26.5‰, 溶解氧>5 mg/L, 水体持续均匀充气, 使水体保持翻腾状态。养殖池初始进水600 L, 实验进行5日后每日加水30 L, 实验期间不排水。
1.2 水质参数的测定
实验期间, 每天测定溶解氧、pH; 每3天测定1次氨氮、亚硝酸盐氮和硝酸盐氮等水质指标。溶解氧采用哈希HQ30D便携式溶氧仪测定, pH采用PHB-1型pH计测定; 水体氨氮、亚硝酸盐氮和硝酸盐氮浓度测定参照《海洋监测规范》, GB 17378.4-2007[12]。
1.3 生物絮团收集与测定
实验期间, 每3天同一时间将1 L水样加入英霍夫锥形管中测定絮团体积, 取样后20 min读出积累在锥形管底部的絮状物体积(单位mL/L)。在育苗第20天, 收集生物絮团, 利用60目筛网将养殖桶中的虾苗分离, 之后将桶内水体分别过300目筛网, 所得过滤物置-20℃冰箱保存。
在养殖实验结束时, 取各组收集的生物絮团各1 g, 平行样混合后在500 mL灭菌海水中混匀, 吸管取样在生物显微镜(DH-2, Olympus)下观察絮团的形态结构, 随机选取200个絮团颗粒进行长度测定,测定其长边和短边长度, 取其均值作为絮团颗粒的粒径。
1.4 DNA提取、PCR扩增及高通量测序
采用OMEGA公司的Soil DNA Kit试剂盒提取3种絮团DNA, 平行组絮团混合, 总计3个样品。对提取后的DNA产物经琼脂糖凝胶电泳进行检测, 然后用带有barcode的特异引物扩增16S rDNA的V3+V4区。引物序列为: 341F: 5′-CCTACGGGNGGCW GCAG-3′; 806R: 5′-GGACTACHVGGGTATCTA AT-3′。PCR反应条件为: 95℃预变性2min, 随后98℃ 变性10s, 62℃退火 30s, 68℃延伸30s, 共27个循环, 最后68℃ 延伸10min。对扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合, 连接测序接头, 构建测序文库,之后Hiseq2500 PE250上机, 进行高通量测序。
1.5 数据统计分析
数据优化处理: 首先去除Miseq测序序列中带有模糊N碱基的序列和低质量序列。根据成对双端片段(PE reads)之间的重叠关系, 将PE reads拼接为一条序列, 得到的拼接序列为原始标签(Raw Tags),Raw Tags经过进一步过滤处理[13], 得到高质量的标签数据(Clean Tags): Raw Tags从连续低质量值(默认质量阈值为≤3)碱基数达到设定长度(默认长度值为3)的第一个低质量碱基位点截断; 经过截取后得到的标签(Tags)数据集, 进一步过滤掉其中连续高质量碱基长度小于Tags长度75%的Tags[14]。然后与数据库进行比对检测嵌合体序列, 去除其中的嵌合体序列, 最终得到有效数据。
操作分类单元(OTU, Operational Taxonomic Units)分析: 为了研究样品的物种组成多样性信息,用Uparse(usearch v9.2.64)软件对所有样品的全部有效序列(Effective Tags)进行聚类, 默认在97 %的相似性水平下将序列聚类成为OTUs, 并计算出每个OTU在各个样品中的标签序列绝对丰度和相对信息, Uparse构建OTUs时会选取代表性序列(依据其算法原则, 筛选OTUs中丰度最高的序列)[15], 将代表序列比对参考数据库, 进行各类OTU分析。
物种分类: 主要通过RDP Classifier (http://rdp.cme.msu.edu/classifier/classifier.jsp)对各OTU代表序列进行分类。RDP classifier是基于Naive Bayesian方法的分类工具, 它对每条序列在数据库中每个分类水平进行匹配, 并计算匹配到某一水平的置信值(Confidence Threshold), 一般认为置信值达到0.8为可信。再通过EzTaxon (http://www.ezbiocloud.net/identify)和/或NCBI (http://www.ncbi.nlm.nih.gov/)Blast程序进一步修正分类单元, 筛选出OTU序列最佳比对结果。统计各样品在界(Domain)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)水平上的分类单元数。
菌群多样性分析: 基于OTU的丰度结果, 应用Mothur软件计算Alpha多样性指数中的丰富度(Chao1)、覆盖率(Coverage)和多样性(Simpson/Shannon)。同时利用R软件生成不同分类水平上(门、属)的物种分布图及样本聚类树图, 使用GraphlAn和iTOL软件进行分类和系统发育可视化作图。
Tax4Fun基因功能预测: 16S高通量测序数据通过QIIME或SILVAngs平台, 基于SILVA数据库对OTU进行物种分类; 再根据NCBI的基因组注释对16S拷贝数进行标准化; 最后通过构建SILVA分类与KEGG数据库中原核分类间的线性关系, 实现对菌群基因功能的预测。本文根据丰度排列前20的预测结果制作各组功能分布图。
利用Excel数据处理软件进行数据处理, 使用SPSS 18.0软件对实验参数进行单因素方差分析(One-Way ANOVA)。实验数据用平均值±标准差(Mean±SD)表示,P<0.05为差异性显著。
2 结果
2.1 生物絮团对育苗水质的影响
3种碳源添加组及对照组中育苗水体pH无显著差异(P>0.05, 表 1); 不同实验组的溶解氧表现为:对照组>淀粉组>葡萄糖组>蔗糖组, 其中对照组和淀粉组溶解氧分别与另二组差异显著(P<0.05), 葡萄糖组和蔗糖组差异不显著; 不同组的氨氮、亚硝酸盐氮和硝酸盐氮总体表现为: 对照组>淀粉组>蔗糖组>葡萄糖组, 淀粉组的氨氮、亚硝酸盐氮和硝酸盐氮的浓度分别为葡萄糖组的1.6、2.5和4.2倍和蔗糖组的1.3、1.9和3.0倍, 与这二组差异显著(P<0.05), 葡萄糖组和蔗糖组差异不显著, 对照组氨氮、亚硝酸盐氮和硝酸盐氮的浓度分别为淀粉组的1.7、1.7和1.6倍, 与其他3组差异显著(P<0.05)。
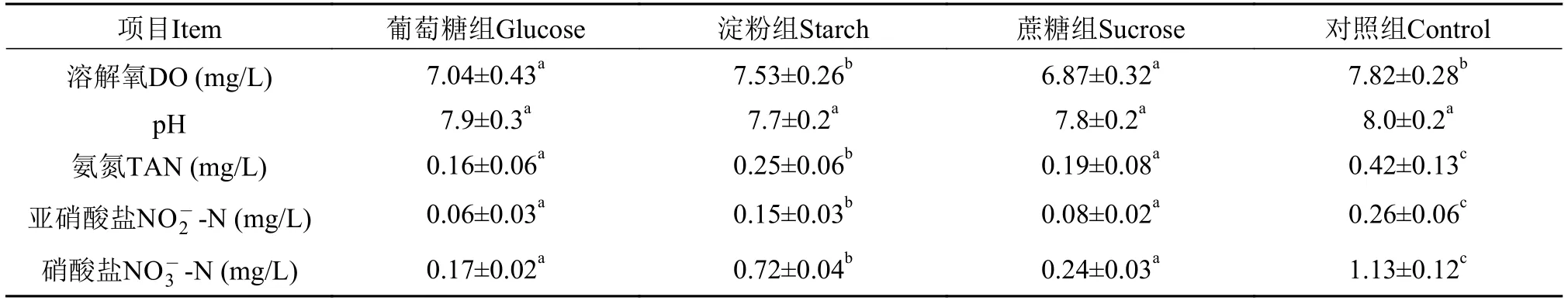
表 1 添加不同碳源的生物絮团对水质指标的影响Tab. 1 Effects of different carbohydrate sources on water quality
2.2 生物絮团的变化与大小测定
经过5—10d的培养, 不同碳源组出现不同的水色。葡萄糖组水色呈现淡黄色, 淀粉组水色为橙黄色, 蔗糖组水色为棕色。实验期间, 生物絮团的沉降体积随时间延长逐步增加(图 1)。3个实验组生物絮团生长呈现刚开始生长缓慢, 培养7—9d后生物絮团生长迅速, 13—15d后, 沉降体积变化较小,趋于稳定。
葡萄糖组絮团形成较快, 实验1d和7d后絮团体积增加较蔗糖和淀粉组分别多0.9和3.1 mL/L, 而第9天时, 蔗糖组絮团体积超过葡萄糖组, 且增加较葡萄糖组多1.3 mL/L, 后期蔗糖组与葡萄糖组絮团体积差异慢慢增大。与葡萄糖和蔗糖组的生物絮团相比, 淀粉组在养殖实验第5天后絮团体积显著小于其他两组(P<0.05)。
3种生物絮团在实验结束时大小测定结果如图 2所示, 葡萄糖组、淀粉组和蔗糖组生物絮团大小均值分别为(135.8±52.4)、(86.3±37.6)和(176.2±62.8) μm,粒径大小呈现: 蔗糖组>葡萄糖组>淀粉组。
2.3 微生物群落多样性分析

图 1 不同碳源组生物絮团沉降体积的变化Fig. 1 Changes in biofloc volume with different carbohydrate sources throughout the experiment period

图 2 三组絮团的粒径分布Fig. 2 Particle size distribution of flocs in three samples

图 3 各组门水平菌群分布Fig. 3 Phylum distribution in each groups

表 2 三种生物絮团微生物群落多样性指数Tab. 2 Bacterial diversity in three samples
如表 2所示, 3种生物絮团样品分别测得553、515和542个OTU, 覆盖率均在99%以上, 足够检测到大部分的微生物种系类型。葡萄糖组群落分布丰度Chao1指数为594.6, 高于蔗糖组和淀粉组;Shannon指数越大代表多样性越高, 各组絮团多样性依次为: 葡萄糖组(6.13)>蔗糖组(5.89)>淀粉组(5.42); 蔗糖组Simpson指数(0.913) 最高, 葡萄糖组次之, 淀粉组Simpson指数最低为0.652。
2.4 三种生物絮团菌群结构
三种生物絮团门水平菌群分布3种类型的生物絮团在门级水平的细菌群落共有18余种(图3),各组所含菌门主要是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和浮霉菌门(Planctomycetes), 为各组优势菌门。淀粉组细菌门类有11种,其中变形菌门(Proteobacteria)占38.3%, 拟杆菌门(Bacteroidetes)含量较葡萄糖组和蔗糖组分别高15.7%和25.3%; 蔗糖组细菌门类有18种, 其中浮霉菌门(Planctomycetes)和放线菌门(Actinobacteria)含量高于葡萄糖组和淀粉组, 分别高出6.1%、12.7%和2.3%、2.5%。蔗糖组特有菌门SHA-109占比0.05%; 葡萄糖组细菌门类有17种, 其中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)占比分别为42.7%和40.0%。葡萄糖组特有菌门Gracilibac-teria占比0.14%。还有Parcubacteria、Lentisphaerae、Spirochaetae等占比较少的菌门在蔗糖组和葡萄糖组中检出, 淀粉组没有。
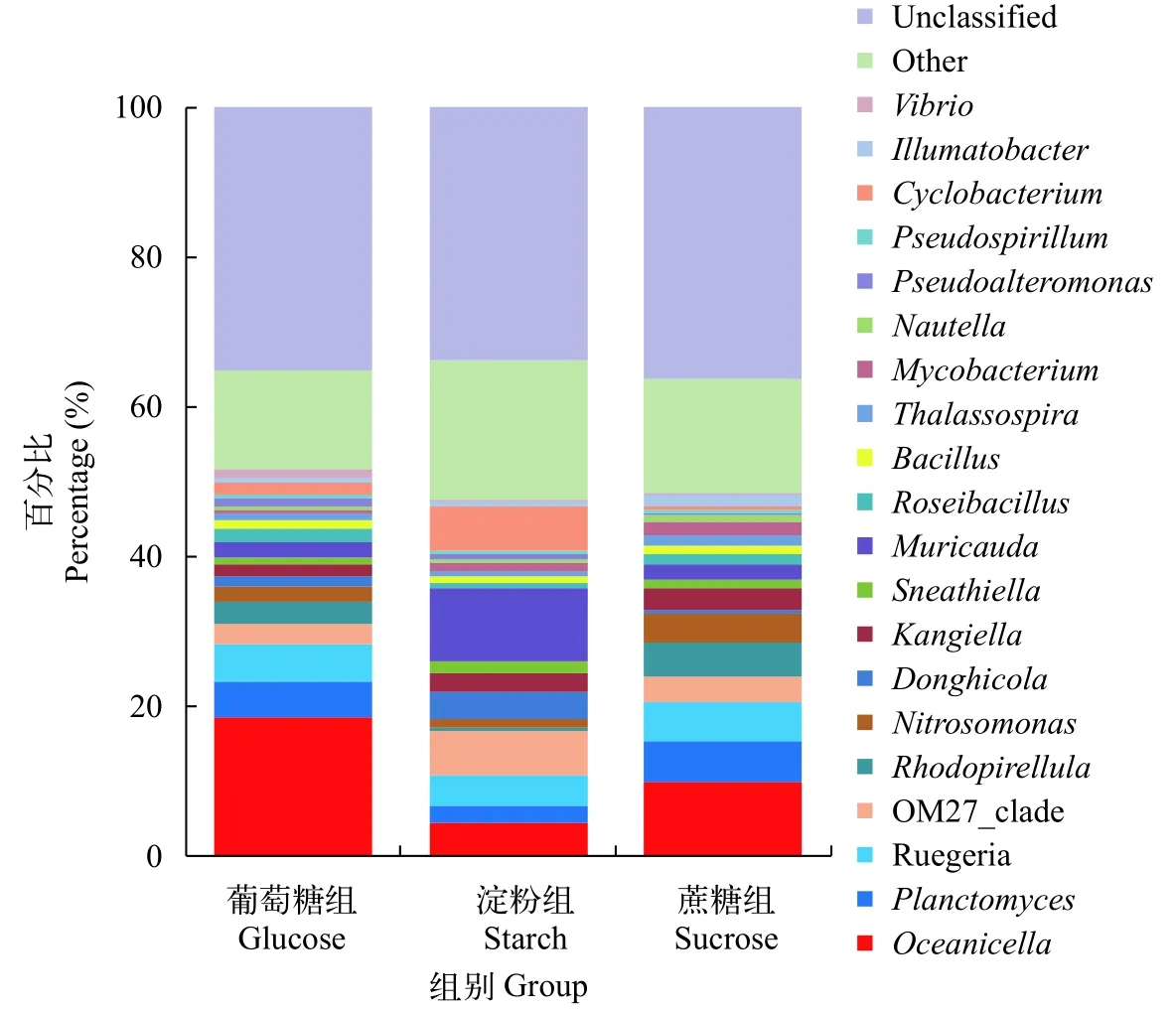
图 4 各组属水平菌群分布Fig. 4 Genus distribution in each groups
三种生物絮团属水平菌群分布3种类型的生物絮团共包含210个菌属, 各组占比前20位的菌群分布如图 4所示。其中, 可鉴定的优势菌属分别为Oceanicella、Planctomyces、Ruegeria、OM27_clade、Nitrosomonas、Kangiella和Muricauda, 各组的占比均超过1%。葡萄糖组中Oceanicella、Planctomyces和Ruegeria为优势菌属, 其中Oceanicella属占比最高为18.4%, 较淀粉组和蔗糖组分别高13.9%和8.5%;Ruegeria属占比为5.1%, 较淀粉组高1%;Bacillus属为投喂的地衣芽孢杆菌所在属, 为3组中最高, 占比为0.92%, 较淀粉组和蔗糖组分别高0.4%和0.2%。淀粉组中Muricauda、OM27_clade、Cyclobacterium、Oceanicella属为优势菌属,其中差异较大的有Muricauda属占比9.8%, 较葡萄糖组和蔗糖组分别高7.6%和7.8%;Cyclobacterium属占比5.9%, 均高于葡萄糖组和蔗糖组。蔗糖组中Oceanicella、Planctomyces、Ruegeria、Rhodopirellula属为优势菌属, 其中Rhodopirellula属具有较高占比, 较葡萄糖组和淀粉组分别高1.8%和4.1%。另外, 3组分别有35.3%、33.8%和36.3%的尚未鉴定菌属。
菌属分类及系统发育如图 5所示, 根据物种的分类表达谱的数据, 选取丰度大于1%的部分物种分类单元, 制作了菌属分类进化树, 将丰度靠前的菌门按不同的颜色标出, 圈和星号大小代表物种丰度大小。
由图 5可知, 菌门比例最大的为变形菌门(Proteobacteria), 包括Oceanicella、Ruegeria、OM27-clade、Nitrosomonas、Kangiella、Donghicola、Pseudospirillum及Sneathiella等菌属。拟杆菌门(Bacteroidetes)为第二大菌门, 包括Muricauda、Cyclobacterium、Portibacter等菌属。Planctomyces、Rhodopirellula菌属隶属于浮霉菌门(Planctomycetes)。Mycobacterium、Illumatobacter菌属隶属于放线菌门(Actinobacteria)。Roseibacillus菌属隶属于疣微菌门(Verrucomicrobia)。
聚类分析根据Unweighted Unifrac矩阵信息做UPGMA (Unweighted Pair-group Method with Arithmetic Mean)聚类分析(图 6), 葡萄糖组和蔗糖组聚为一类, 说明葡萄糖组絮团菌属分布与蔗糖组絮团菌属分布相似。而淀粉组单独聚为一类, 淀粉组絮团菌属分布与葡萄糖组和蔗糖组存在差异性。
2.5 Tax4Fun群落功能预测分析
Tax4Fun主要是通过构建SILVA分类与KEGG数据库中原核分类间的线性关系, 实现对微生物群落功能的预测。结果获得280个预测的功能, 丰度前20的功能如图 7所示, 分别为ABC转运蛋白(A)、双组分系统(B)、嘌呤代谢(C)、氨酰生物合成(D)、甘氨酸、丝氨酸和苏氨酸代谢(E)、嘧啶代谢(F)、精氨酸和脯氨酸代谢(G)、氮代谢(H)、卟啉和叶绿素代谢(I)、氧化磷酸化(J)、细菌分泌系统(K)、核糖体合成(L)、氨基糖和核苷酸糖代谢(M)、细胞周期(N)、淀粉和蔗糖代谢(O)、RNA降解(P)、果糖和甘露糖代谢(Q)、乙醛酸和二羧酸代谢(R)、鞭毛组装(S)和甲烷代谢(T)。其中涉及氨基酸、核苷酸等新陈代谢功能的有12项, 葡萄糖组、淀粉组、蔗糖组该类功能基因丰度分别占比为22.2%、19.4%和21.8%; 涉及遗传信息加工功能的3项, 葡萄糖组该类功能基因丰度最高为5.7%, 是淀粉组的1.12倍, 是蔗糖组的1.01倍; 发挥膜运输、信号转导等环境信息处理功能的3项, 占比最高的是葡萄糖组, 蔗糖组次之, 淀粉组最低, 基因丰度分别为18.8%、14.0%和16.9%; 还有2项功能存在于细胞周期中, 丰度最高组为蔗糖组, 葡萄糖组次之,淀粉组最低, 占比分别为2.6%、2.5%和2.9%。由图可知3个实验组不同絮团整体功能类型相似, 但前20位的功能基因在葡萄糖组、淀粉组和蔗糖组群落中的丰度分别为49.3%、41.0%和47.2%, 其存在一定差异。

图 5 菌属分类及系统发育Fig. 5 Classification and phylogenetic information
3 讨论
3.1 不同碳源组生物絮团对养殖水质和菌群多样性的影响
本研究表明, 不同碳源组生物絮团对养殖水质有显著影响。结果显示, 不添加碳源的对照组三氮指标显著高于碳源添加组, 在形成生物絮团的养殖系统中, 应用不同碳水化合物作为碳源产生的效果也不同[16], 淀粉组的水质指标要显著高于葡萄糖组和蔗糖组, 可能是由于葡萄糖和蔗糖为单糖和二糖,淀粉为多糖, 单糖和二糖能够较快的被絮团中的细菌如硝化细菌、氨化细菌利用, 同时吸收水体中的氨氮、亚硝酸盐等物质, 合成细菌自身蛋白物质。而多糖则需要更多的时间分解为单糖, 才能被细菌利用, 从而导致氨化和硝化反应较慢, 这可能造成淀粉组中的氨氮、亚硝酸盐水平高于葡萄糖组和蔗糖组。这与Van[17]研究结果相符, 且添加碳水化合物可以降低水体里的氨氮和亚硝酸盐氮浓度, 同时减少排放到环境中的氮[18], 说明生物絮团对氨氮的快速异养转化的功能在水产养殖中具有重要意义。在本实验中, 3个实验组生物絮团生长过程先缓慢后快速, 最后平稳, 这与细菌的生长曲线中迟缓期、对数期和稳定期类似[19], 实验第13至第15天后, 沉降体积趋于稳定, 这与Xu等[20]研究结果吻合。另外, 在本研究中, 粒径测量结果显示, 淀粉组生物絮团更为密集且颗粒较小, 而蔗糖组絮团颗粒较大且孔隙较大, 粒径大小呈现: 蔗糖组>葡萄糖组>淀粉组。3种絮团的微生物群落多样性分析显示,Chao1指数值在543.1—594.6, Shannon指数值在5.42—6.13, 说明3组絮团微生物群落的丰富度较高,Shannon指数越大, 丰富度越高。所得结果相似于夏耘等[21]采用PCR-DGGE技术分析草鱼(Ctenopharyngodon idellus)养殖水体中生物絮团情况。其中,葡萄糖组絮团微生物群落表现出较高的丰富度和多样性特征, 其粒径大小约135.8 μm, 这表明, 在该粒径范围的絮团具有较好的微生物生存环境, 例如适宜的好氧区、厌氧区比例, 有利于不同溶氧需求的微生物分布[22]。如菌属分布中有好氧型Planctomyces、Nitrosomonas、Bacillus、Vibrio菌属, 兼性厌氧型Arcobacter菌属, 厌氧型Desulforhopalus、Thermotalea菌属[23—27]。而粒径大小约86.3 μm的淀粉组絮团, 其菌群多样性较低, 推测原因为其絮团体积较小, 菌群结构测定结果显示淀粉组絮团专性好氧型菌属占比约为36.7%, 而葡萄糖组和蔗糖组分别约为27.2%和29.5%, 淀粉组优势菌属以好氧型居多, 其余类型微生物分布和生长可能受到限制,致使其Chao1和Shannon指数均最低。蔗糖组絮团颗粒虽然最大, 具有更多的内部空间结构, 但由于其内部孔隙较多, 易被杂质堵塞, 导致物质传输受阻, 部分营养物质供给不足, 造成菌群退化和死亡,Chao1和Shannon指数也会相应降低[11]。研究结果表明, 不同粒径大小的絮团颗粒具有不同的菌群多样性, 在育苗生产中培育适宜粒径大小的絮团颗粒对于保持系统菌群多样性具有重要作用。
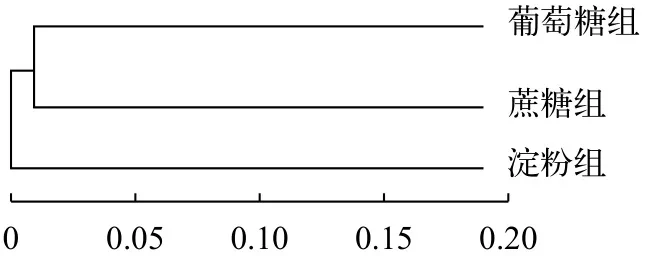
图 6 三组生物絮团样本菌群的聚类分析Fig. 6 Cluster analysis of microflora in three biofloc samples

图 7 Tax4Fun基因功能预测分布Fig. 7 Prediction distribution of Tax4Fun gene function
3.2 不同碳源组生物絮团对菌群结构的影响
在本研究中各组菌门分布显示, 变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)是各组的优势菌, 变形菌门和拟杆菌门在各组中分别占比达(38.3%—45.0%)和(49.6%—27.8%)。这与Xue等[28]通过DGGE研究对虾苗池优势菌群特征相似。葡萄糖组和蔗糖组中浮霉菌门(Planctomycetes)比例较淀粉组分别大6.8%和15.1%。变形菌门(Proteobacteria)被认为是水产养殖中的共生菌[29], 而变形菌门(Proteobacteria)和浮霉菌门(Planctomycetes)都具有去除污水中有机物的作用[30,31], 尤其是在生物絮团的污水处理中, 变形菌门(Proteobacteria)在细菌组成中占支配地位[32]。所以生物絮团应用于养殖生产时, 能有效调节养殖池水水质。拟杆菌门(Bacteroidetes)普遍存在于海洋环境中, 其下属的鞘脂杆菌纲具有降解不同生物高分子如纤维素、几丁质与果胶质的能力[33], 可以快速降解幼体脱下的甲壳; 另外本实验检测到的黄杆菌科也属于拟杆菌门, 该科多数种类能水解碳聚合物和蛋白质等有机物, 同时消耗水体中过量的氮和磷[34], 因此, 拟杆菌门对维持育苗水体生态系统平衡具有重要作用。总体来看, 在凡纳滨对虾育苗养殖中, 添加碳源可提高系统中微生物群落的丰富度, 包括变形菌门(Proteobacteria)、放线菌门(Actinobacteria)及厚壁菌门(Firmicutes)等菌群的比例。系统中微生物群落结构随添加碳源的不同会发生一定的变化, 关于不同微生物利用碳源的方式以及有益菌和致病菌的比例控制还需进一步研究。在属水平上, 各组呈现较大差异, 水体菌群最优势的为Oceanicella属。该属菌群多为温和嗜盐种类, 在碳和硫元素循环过程中起重要作用, 同时会产生多种次生代谢活性物质[35], 具有高效积累聚羟基烷酸(Polyhydroxyalkanoate, PHA)的能力[36]。在各组中还有3个已知属(Donghicola、Nautella、Marivita)和Oceanicella同隶属于红杆菌科, 是其重要的分支, 普遍存在于海水环境中, 其丰度之和在3组中分别高达20.4%、8.8%和11.6%, 表明红杆菌科在育苗水体中呈显著优势。其中,Nautella和Marivita都是温和嗜盐或耐盐菌, 大多化能异养[35]; 关于Donghicola相关功能报道较少, Xue等[28]通过DGGE研究发现,Donghicolasp.在凡纳滨对虾正常苗池中也具有优势。除此之外,Planctomyces与Rhodopirellula也是相对优势菌属, 这2个属都属于浮霉菌门, 均为海水中高丰度类群[37]。Planctomyces多数种类是化能异养, 可利用碳氢化合物进行发酵作用[38]。Rhodopirellula具有碳化合物合成相关途径, 可固定二氧化碳[39,40], 属于化能自养型的厌氧氨氧化细菌。另外, 拟杆菌门的Muricauda也是相对优势菌属,Muricauda可产生多种胞外酶分解利用复杂碳源[41], 同时水解产生的简单碳水化合物可为菌群移除水体过量N、P提供碳源[34]。在各组鉴定菌属中, 还有Ruegeria、OM27_clade、Nitrosomonas和Kangiella为优势菌属, 丰度均≥1.0%, 在上述菌属的协同作用下, 各组生物絮团能有效调控水质, 在不排水的情况下, 使三氮浓度维持较低水平, 育苗水体生态系统保持相对稳定状态。关于优势菌群在育苗水体中高丰度存在机制及生态位功能还需进一步研究。
3.3 不同碳源组生物絮团对菌群基因功能的影响
养殖水体中菌群结构和多样性对水质和养殖生物安全都有很大影响。研究表明, 弧菌病和丝状细菌病常见于对虾幼体育苗过程中, 其主要病原菌来自水体环境中的弧菌属(Vibrio)和亮发菌属(Leucothrix)等, 导致幼体脱壳缓慢, 附肢断裂, 是水体中常见的病原菌[42,43]。同时, 养殖水体中也存在大量中性和有益菌群, 它们在物质循环、生物合成、维持水体生态平衡等方面起着重要作用[44]。由此可见, 水体菌群会直接或间接的影响对虾幼体生长过程。通过Tax4fun基因功能预测, 各组样品OTU基因表达与细胞生长分裂等生命活动密切相关, 如N、S等, 这表明, 在生物絮团内部存在旺盛的生命活动, 例如各种物质的新陈代谢, 如C、F、E、G,本文中同样检测到较高丰度的碳水化合物代谢基因, 如M、O、Q、R。生物絮团组分之一的胞外聚合物(Extracellular Polymeric Substances, EPS)主要由多种细菌分泌的蛋白质、核酸、多糖多肽等组成, 结果检测有较高A、B、K基因丰度, 这些基因可能与胞外聚合物的运输和形成密切相关。EPS不仅是对虾生长很好的营养补充, 而且能帮助絮团凝聚及净化水质。邓吉朋等[45]将生物絮团应用于斑节对虾(Penaeus monodon)养殖中, 显著提高了斑节对虾的特定生长率和存活率。阮晓东等[46]研究了絮团在吸附污染物过程中, 紧密型胞外聚合物发挥主要作用。结果表明, 絮团内部菌群代谢旺盛, 部分菌群的代谢产物对于水质净化具有很好的促进作用。通过Tax4Fun预测显示, 3种生物絮团基因功能相似, 但在各组中的丰度水平存在差异, 这与各组菌群的种类和数量相关, 结果与菌群多样性和丰度数据基本吻合。
4 结论
通过向凡纳滨对虾育苗水体中添加碳源, 形成生物絮团, 可有效调节水质, 降低水体中三氮水平,其中, 葡萄糖组和蔗糖组效果较好, 淀粉组次之。菌群多样性分析结果表现为葡萄糖组>蔗糖组>淀粉组, 这与絮团大小、菌群组成和占比有关; 在门级水平上, 3种絮团菌群种类和占比存在差异性, 葡萄糖组和蔗糖组在门级种类上显著高于淀粉组; 在属水平上, 3种絮团菌群种类相似, 但优势菌属占比存在差异。Tax4Fun群落功能基因预测分析结果显示, 葡萄糖组在细胞新陈代谢、遗传信息加工和环境信息处理等方面功能基因在本组的丰度均高于蔗糖组和淀粉组, 说明葡萄糖组生物絮团内部菌群生命活动更加活跃。
