不同蛋白源对瓦氏黄颡鱼幼鱼生长和蛋白质代谢相关基因表达的影响
2019-07-20杨英豪李学山麦康森张彦娇艾庆辉
杨英豪 李学山 麦康森 徐 玮 张彦娇 艾庆辉
(中国海洋大学海水养殖教育部重点实验室,农业农村部水产动物营养与饲料重点实验室,青岛 266003)
随着集约化养殖的不断发展, 寻找优质蛋白源以替代鱼粉(Fish meal, FM)、节约成本, 成为水产动物营养研究的热点和难点[1—5]。研究发现, 不同蛋白源具有不同的特点, 大豆浓缩蛋白(Soy protein concentrate, SPC)由于蛋白质含量高(65%—70%的粗蛋白), 抗营养因子和纤维含量较低, 同时还具有利用率高、氨基酸平衡性好、价格低廉等优点, 成为极具潜力的鱼粉替代源[6,7]。在线鳢(Channa striata)[8]和星斑川鲽(Platichthys stellatusPallas)[9]中研究发现, 用SPC替代部分鱼粉可显著提高鱼体生长率和饲料转化效率。水解鱼肉蛋白(Fish hydrolysate, FH)是一种富含各种肽段、诱食好且促进鱼类生长明显的蛋白源[10,11]。在大黄鱼(Larimichthys crocea)的养殖中发现, 用过滤后的水解蛋白替代40%的鱼粉, 相比于全鱼粉组, 不影响大黄鱼的存活率和特定生长率[12]。晶体氨基酸(Crystal amino acids, CAA)可被鱼体直接吸收和利用, 因此晶体氨基酸对水产养殖动物来说也是极具价值的鱼粉替代源[13—15]。然而, 这几种蛋白源在同一鱼类中的替代效果尚不明确, 有待进一步研究。
日粮蛋白和内源性蛋白经胰蛋白酶、小肠刷状缘蛋白酶和肽酶等消化后形成小肽和游离氨基酸, 经小肠吸收后进入血液循环, 被机体各组织器官吸收利用[16]。消化后的氨基酸和小肽主要由氨基酸转运载体和小肽转运载体(PEPT1)进行吸收[17]。机体吸收的小肽和氨基酸一方面可用于分解供能,另一方面可用来重新合成蛋白质, 蛋白质在机体的沉积是由蛋白质的分解和合成共同决定的[18,19], 其中雷帕霉素靶蛋白(TOR)信号通路对于蛋白质的合成起着至关重要的作用。哺乳动物中关于不同蛋白源调控蛋白质代谢的研究已较为系统[20,21], 然而鱼类中关于不同蛋白源对PEPT1和TOR基因表达的调控及鱼体生长的影响还有待进一步研究。
瓦氏黄颡鱼(Pelteobagrus vachelli), 鲶形目、鲿科、黄颡鱼属, 温水性鱼类, 我国重要的淡水经济养殖种类之一。近年来, 随着瓦氏黄颡鱼养殖规模的扩大, 对鱼粉的需求量也随之增加, 饲料成本逐渐加大, 因此亟待寻找合适的蛋白源替代鱼粉以促进瓦氏黄颡鱼养殖产业可持续发展[22]。本研究旨在比较不同蛋白源对黄颡鱼生长、体组成和蛋白质代谢基因PEPT1和TOR表达的影响, 以探讨不同蛋白源对黄颡鱼生长性状的影响机理, 为黄颡鱼饲料中鱼粉替代提供理论依据和指导。
1 材料与方法
1.1 饲料配方和饲料制作

表 1 实验饲料配方和化学成分(%干重)Tab. 1 Formulation and chemical composition of the experimental diets (% dry matter)
分别以鱼粉(FM)、大豆浓缩蛋白(SPC)、水解鱼蛋白(FH)和晶体氨基酸混合物(CAA)为主要蛋白源, 鱼油、豆油和大豆卵磷脂为主要脂肪源, 小麦粉为糖源制作4种等氮(粗蛋白含量为39.0%)等脂(粗脂肪含量为9.0%)的实验饲料(表 1)。FH购自上海海清饲料公司, 其他饲料原料购自青岛七好生物科技有限公司。
饲料制作前, 将饲料原料进行粉碎并过246目筛。在饲料制作过程中, 饲料原料根据配方按逐级放大原理混合均匀, 之后加入鱼油、豆油和卵磷脂,手工将油脂颗粒搓匀, 然后加入适量水, 用全自动渔用饵料机(F-26(Ⅱ), 华南理工大学)进行制粒, 制成直径为1.5 mm×3.0 mm饲料颗粒, 以45℃烘至水分含量小于10%, 用双层塑料袋扎口保存, 置-20℃冰箱中备用。
1.2 养殖实验和样品采集
瓦氏黄颡鱼购于四川眉山育苗场, 实验前, 实验鱼在广州市农业科学院白云基地循环水系统中暂养2周, 以FM组饲料进行饱食投喂, 使实验鱼逐渐适应人工饲料和养殖环境。在暂养结束后, 黄颡鱼饥饿24h, 将初重(2.90±0.01) g的瓦氏黄颡鱼随机分成4组, 每组3个重复, 每个重复(桶/260 L)60尾鱼。每天人工饱食投喂2次(7: 00和 18: 00), 在投喂结束后1h, 吸出残饵在70℃烘箱中烘干至恒重, 并称重, 每天记录投饵量。养殖周期 66d, 养殖期间记录每桶的死鱼数量并称重。实验条件: 水温,25—26℃; 溶氧, >6.0 mg/L; pH, 6.8—7.6; 总氨氮量, <0.1 mg/L; 亚硝酸盐, <0.1 mg/L; 所有养殖桶均连续充气, 光照为自然光照。
养殖中期(35d)和养殖末期(66d)采集样品。取样前, 将鱼体饥饿24h, 统计每桶瓦氏黄颡鱼数量和重量, 每桶随机挑选10尾鱼, 用MS-222麻醉(1∶10000; 上海康汀生物科技有限公司, 中国), 采集鱼体前肠和肝脏组织, 立即置于液氮, 待样本采集完毕后统一放于-80℃冰箱长期保存, 用于后续代谢基因的定量分析。实验末期每桶另取6尾黄颡鱼,于-20℃冰箱保存, 用于后续体组成分析。
1.3 化学分析
采用AOAC (1995)[23]标准方法对饲料原料、饲料和鱼体成分进行分析; 采用全自动凯氏定氮仪(Kjeltec 2300, Sweden)测定粗蛋白含量(N×6.25); 采用索氏抽提法测定粗脂肪含量(Buchi 36680, Switzerland); 样品于电炉上炭化后, 马弗炉中(550℃)灼烧12h, 可得样品灰分含量。
1.4 RNA 提取
将黄颡鱼肝脏和前肠在液氮中磨成粉末, 然后放入含1 mL Trizol的无RNase离心管中, 分别加入氯仿、异丙醇、乙醇等试剂, 最后用灭菌水溶解沉淀, 具体操作过程参照李明珠[24]方法。RNA质量通过1.2%琼脂糖凝胶电泳检测, 浓度通过核酸定量仪(Nano Drop 2000 spectrophotometer, Thermo, USA)测定。将各组织样品的RNA调成1 μg后, 用Primer-Script®Reverse Transcriptase (TaKaRa, Japan)试剂盒将RNA反转成cDNA, 具体操作参照试剂盒说明书。
1.5 实时荧光定量PCR
采用SYBR®Green I嵌合荧光法, 使用SYBR®Premix ExTaqTM(Perfect Real Time, TaKaRa, Japan)试剂在Thermal cycler (Mastercycler ep realplex, Eppendorf, German)仪器上进行, 反应条件为: 95℃2min, 1循环; 95℃变性15s, 59℃退火15s, 72℃延伸30s, 共计40个循环。溶解曲线: 95℃, 15s; 59℃,15s, 95℃, 5min。以GAPDH和β-actin作为内参基因。在定量前, 验证内参基因、PEPT1和TOR2基因引物(表 2)的扩增效率。本实验PEPT1、TOR、GAPDH和β-actin基因的扩增效率分别为0.98、0.95、0.99和0.98, 随后以Lg(模板相对拷贝数)为横坐标, 以平均ΔCt(目的基因Ct值)-平均ΔCt(目的内参-内参基因Ct值后再平均)为纵坐标, 得到另外一条直线, 若其斜率绝对值小于0.1, 即说明目的基因与内参基因扩增效率一致, 用2-ΔΔCt进行基因表达分析[25]。分别对中期、末期瓦氏黄颡鱼PEPT1和TOR基因进行RT-PCR分析, 以水解鱼肉蛋白组为对照组, 对其他组的基因表达进行分析。
1.6 统计分析
生长指标计算如下:
成活率(SR, %)=100%×(末鱼数量/初鱼数量)特定生长率(SGR, %/d)=100%×[(Ln终末重-Ln初始重)/实验天数]
结果采用SPSS17.0软件进行数据处理, 在单因素方差分析(ANOVA)数据达到显著(P<0.05)时, 进行Tukey’s多重比较, 数据以平均值±标准误(Mean±SEM)表示。
2 结果
2.1 不同蛋白源对瓦氏黄颡鱼幼鱼不同生长阶段存活率和生长的影响
各处理组瓦氏黄颡鱼存活率(SR)无显著差异(P>0.05), 且SR均大于94%。在生长方面, 不同蛋白源显著影响瓦氏黄颡鱼生长性能(P<0.05)。在第35和第66天时, FM组瓦氏黄颡鱼SGR分别为4.86%/d和3.08%/d, SPC组瓦氏黄颡鱼SGR分别为3.94%/d和2.55%/d, SPC组瓦氏黄颡鱼SGR虽然低于FM组,但显著高于FH组(1.13%/d和0.96%/d)和CAA组(1.69%/d和1.28%/d) (表 3)。
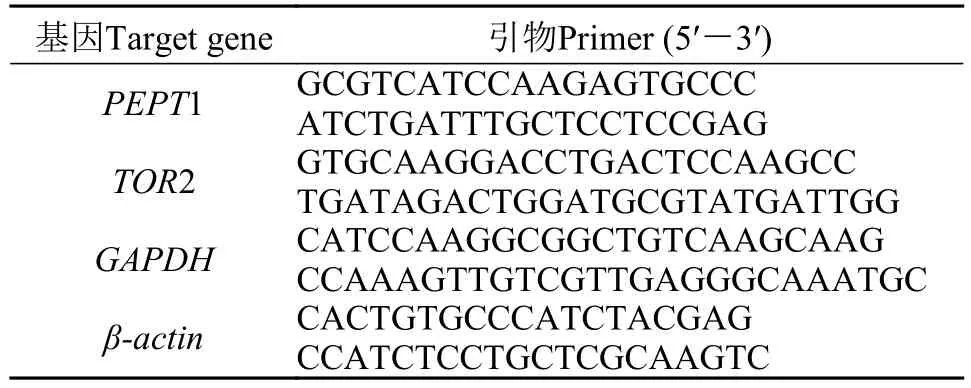
表 2 瓦氏黄颡鱼PEPT1和TOR2基因定量所需引物序列Tab. 2 Real-time quantitative PCR primers for PEPT1 and TOR2 genes

表 3 不同蛋白源对瓦氏黄颡鱼幼鱼不同生长阶段存活率和生长的影响(平均值±标准误, n=3)Tab. 3 Growth performance and survival of darkbarbel catfish (Pelteobagrus vachelli) fed diets at different growth stages (Mean±SEM, n=3)
2.2 不同蛋白源对瓦氏黄颡鱼幼鱼体组成的影响
不同蛋白源显著影响了瓦氏黄颡鱼体组成。SPC替代FM会降低鱼体粗蛋白含量, SPC组鱼体蛋白含量仅次于FM组, 其粗蛋白含量为13.28%。SPC组瓦氏黄颡鱼的粗脂肪含量显著高于FM组(P<0.05), 粗脂肪含量为 14.86%, SPC组瓦氏黄颡鱼灰分和水分含量显著低于其他组(P<0.05), 分别为6.80%和69.48% (表 4)。

表 4 不同蛋白源对瓦氏黄颡鱼幼鱼体组成的影响(平均值±标准误, n=3, 湿重%)Tab. 4 Body composition analysis of darkbarbel catfish (Pelteobagrus vachelli) fed diets at different growth stages (Mean±SEM, n=3, wet weight %)
2.3 不同蛋白源对瓦氏黄颡鱼幼鱼前肠PEPT1和肝脏TOR基因表达的影响
在第35和第66天时, 不同蛋白源显著影响了瓦氏黄颡鱼幼鱼前肠PEPT1的表达(P<0.05, 图 1)。在第35天时, FM组鱼体前肠PEPT1基因表达量显著高于其他处理组(P<0.05), SPC组鱼体前肠PEPT1表达量显著高于FH和CAA组(P<0.05)。在第66天时,SPC组鱼体前肠PEPT1表达量显著高于FM组(P<0.05)。在第35和第66天时, 不同蛋白源并未显著影响瓦氏黄颡鱼肝脏TOR基因的表达水平(P>0.05,图 2)。
3 讨论
3.1 不同蛋白源对瓦氏黄颡鱼幼鱼不同生长阶段存活率和生长的影响
本实验发现4种蛋白源对瓦氏黄颡鱼存活率无显著影响, 说明瓦氏黄颡鱼对养殖条件和实验饲料较为适应。在第35和第66天时, FM组实验鱼的生长性能达到最大, 显著高于其他各实验组; 通过比较瓦氏黄颡鱼SGR发现, SPC组虽然低于FM组, 但显著高于FH组和CAA组, 说明SPC是较理想的鱼粉替代源。SPC组的瓦氏黄颡鱼具有相对较好的生长性状, 这可能和SPC的特性相关, SPC蛋白含量高达65%—70%, 抗营养因子含量低, 同时SPC具有利用率高等特点[26], 因此, 使用SPC饲喂鱼体能使鱼体获得较好的生长性能。在大黄鱼[27]、真鲷(Pagrus major)[28]、虹鳟(Oncorhynchus mykiss)[29]中使用SPC进行投喂, 鱼体均具有较高的SGR。但是SPC缺乏鱼体生长所需的蛋氨酸, 因此本实验SPC的替代效果稍差于鱼粉, 这可能与SPC中缺乏蛋氨酸有关[30,31]。
3.2 不同蛋白源对瓦氏黄颡鱼幼鱼体组成的影响
蛋白源会影响鱼体组成, 在本实验中鱼粉组瓦氏黄颡鱼的粗蛋白含量显著高于其他组。这可能与鱼粉具有较高的氨基酸平衡性有关[32—34], 鱼粉水解出的氨基酸更有利于鱼体蛋白沉积, 而这一点在其他实验中也得到类似的结果。周晖等[35]用酵母粉、脱脂豆粕和玉米蛋白粉分别替代10%的鱼粉,饲喂体重30—38 g的军曹鱼(Rachycentron canadum)幼鱼5周, 结果发现FM组军曹鱼体蛋白含量最高。李学丽等[36]用2种豆粕部分替代鱼粉, 发现鱼粉组珍珠龙胆石斑鱼(Epinephelus fuscoguttatus×Epinephelus lanceolatus)幼鱼的全鱼体蛋白含量显著高于其他组。本实验同样发现, SPC组瓦氏黄颡鱼的体脂含量达到最大。与其他鱼粉替代源相比, SPC含有较少的抗营养因子, 虽然其氨基酸平衡性稍差于鱼粉, 但仍优于其他植物蛋白源, 有利于蛋白或糖类等转化为脂肪储存。SPC的这种特性在其他研究中也得到验证, Kissinger等[37]以SPC和其他蛋白源替代鱼粉饲喂长鳍(Seriola rivoliana) 9周, 发现其他组鱼体粗脂肪含量显著低于80%SPC组。

图 1 不同蛋白源对瓦氏黄颡鱼前肠PEPT1 mRNA表达的影响Fig. 1 Effects of different dietary protein sources on PEPT1 mRNA expressions in the foregut of darkbarbel catfish图中数值为平均值±标准误(n=3), 含有相同字母或没有上标代表差异不显著(P≥0.05); 下同Data are presented as means±SEM (n=3). Means in each bar sharing the same superscript letter or absence of superscripts are not significantly different determined by Tukey's test (P≥0.05),the same applies below
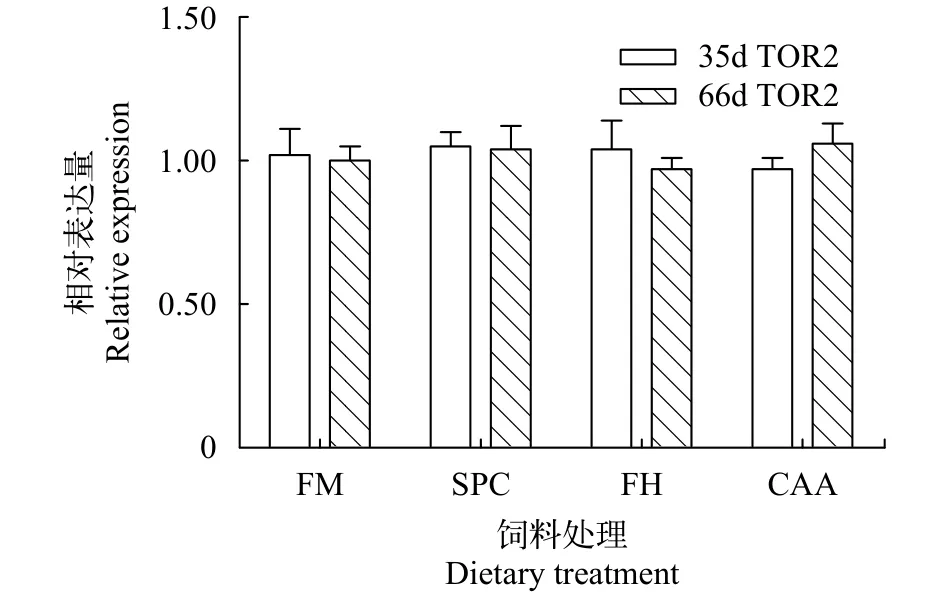
图 2 不同蛋白源对瓦氏黄颡鱼肝脏TOR mRNA表达的影响Fig. 2 Effects of different dietary protein sources on TOR mRNA expressions in the liver of darkbarbel catfish
3.3 不同蛋白源对瓦氏黄颡鱼幼鱼前肠PEPT1和肝脏TOR基因表达的影响
不同蛋白源会显著影响鱼体蛋白质代谢相关基因的表达, 对虹鳟[38]饲喂含小肽、游离氨基酸和完整蛋白质的饲料会显著影响虹鳟肠道PEPT1的表达。在本实验中, 第35天和第66天时, FM组和SPC组黄颡鱼前肠PEPT1的表达高于其他组。相比于CAA、SPC和FM可被鱼体肠道蛋白酶水解为小肽, 可提高PEPT1 mRNA的表达, 促进鱼体对蛋白的吸收, 从而增加鱼体的蛋白沉积, 有利于鱼体生长, 这表明SPC是较好的FM替代源。在33d和66d时, FH组鱼体PEPT1 mRNA表达量最低, 在大菱鲆(Scophthalmus maximusL.)[39]上也发现类似结果。然而, 在大西洋鲑(Salmo salarL.)[40]、鲤(Cyprinus carpioL.)[41]和黄金鲈(Perca flavescens)[42]的相关研究中却得到不同的结果, 这很可能是由于鱼种、水解底物等不同所引起的。
PEPT1的表达还和生长阶段、能量水平等因素有关。在早期发育阶段, 鳜(Siniperca chuatsi)[43]肠道PEPT1表达量较高, 而随着鱼体体重的进一步增加, 肠道PEPT1的表达量逐渐下降并趋于稳定。在能量影响PEPT1的研究中, 高能量(13.17 kJ/kg)组肉鸡空肠和回肠PEPT1表达量显著低于低能量组(12.34 kJ/kg)[44]。在本实验中, 在33d时FM组鱼体PEPT1表达量较高, 而66d时FM组鱼体PEPT1表达量出现一定程度下降。这可能是FM相比于CAA和FH, FM能量更高,PEPT1表达上升有利于黄颡鱼吸收能量物质, 用于生长, 而随着黄颡鱼体重进一步增加,PEPT1表达出现一定程度地下降。
综上所述, SPC的替代效果尽管差于FM, 但显著优于FH和CAA, 这可能是由于SPC上调前肠PEPT1的表达、促进鱼体对小肽的吸收所致, 表明SPC可作为一种鱼粉替代的优质蛋白源。
