三种不同的铜源对珍珠龙胆石斑鱼生长、抗氧化酶活性及肠道形态的影响
2019-07-20郭鑫伟麦浩彬迟淑艳谭北平姚亚军姚红梅董晓慧杨奇慧刘泓宇
郭鑫伟 麦浩彬 迟淑艳, 谭北平, , 姚亚军 姚红梅 董晓慧, , 杨奇慧, 刘泓宇, 章 双,
(1. 广东海洋大学水产动物营养与饲料实验室, 湛江 524088; 2. 广东省水产动物精准营养与高效饲料工程技术研究中心, 湛江524088; 3. 农业部华南水产与畜禽饲料重点实验室, 湛江 524088; 4. 长沙兴嘉生物工程有限公司, 长沙 410128)
铜(Cu)作为动物的必需微量元素在中各组织的生理生化学过程中承担着重要的生物学功能[1],例如铜作为超氧化物歧化酶的辅助因子, 参与清除自由基和电子传递一系列生物过程[2,3]; 作为细胞色素氧化酶、酪氨酸酶和抗坏血酸氧化酶的成分,影响体表色素形成和骨骼发育; 同时, 铜还参与铁的吸收及代谢, 影响机体健康[4]。
矿物元素可以与有机化合物如碳水化合物、氨基酸和水解蛋白质(肽)等螯合, 使其可以在吸收位点以离子的形式释放出去, 同时也能作为一种完整的螯合物被吸收, 能够最大限度地减少与其他矿物元素的竞争以及原料中植酸、粗纤维等物质的螯合, 从而增强矿物元素的吸收。因而, 不同的铜源在鱼体内的吸收、运输和代谢效率是存在差异的[5]。铜在饲料中最常见的添加形式是硫酸铜(CuSO4)[6-8]。与CuSO4相比, 鱼类摄食碱式氯化铜和氨基酸螯合铜可以获得更好的生长[9-12]。并且,有机铜螯合物在水中的溶解度比CuSO4的溶解度低[11], 可以减少养殖水体污染。
珍珠龙胆石斑鱼(Epinephelus lanceolatus♂×Epinephelus fuscoguttatus♀)具有生长快速、抗病力强、经济价值高等优势[13]。本研究通过在饲料中添加硫酸铜(CuSO4)、甘氨酸铜(Cu-Gly)和羟基蛋氨酸铜(Cu-HMA)三种铜源投喂珍珠龙胆石斑鱼,评估饲料中铜源对珍珠龙胆石斑鱼生长性能、抗氧化酶以及肠道形态结构的影响, 以期为石斑鱼饲料中铜的添加形式提供理论依据。
1 材料与方法
1.1 试验饲料配制
参考斜带石斑鱼(Epinephelus malabaricus)[14,15]、点带石斑鱼(Epinephelus malabaricus)[11,16]铜需要量, 在饲料中分别添加CuSO4、Cu-Gly和Cu-HMA,在基础饲料中铜的实际含量分别为5.45、5.94和5.53 mg/kg, 配制3组等氮等脂的实验饲料(表 1)。所有原料经粉碎后过60目筛, 与预混合的微量组分经过V型立式混合机(浙江正泰电器股份有限公司,JS-14S型)进行一次混合, 再与预混合的鱼油和磷脂油于小型搅拌机(恒联食品机械厂, B20-H型)中二次混合后经双螺杆挤条机(华南理工大学, F-75型)制成粒径为3 mm的颗粒饲料。在室温条件下自然风干至水分含量为10%左右, 分装封口, -20℃冰箱保存备用。
1.2 试验用鱼及饲料管理
试验用珍珠龙胆幼鱼(购于湛江东海岛石斑鱼苗场), 暂养于东海岛广东海洋大学海洋生物研究基地室外水泥池, 投喂商品饲料驯化10d。试验共设3个处理组, 每个处理3个重复, 每个重复放养珍珠龙胆石斑鱼30尾, 养殖8周。每天饱食投喂2次(8:00和17:00)。
试验用水为经过沉淀、沙滤的天然海水, 试验期间每天换水1次, 换水量约为养殖水体的2/3, 养殖期间水温(29.08±0.85)℃, 海水盐度27—29, 水体溶解氧量≥5 mg/L, 氨氮含量≤0.03 mg/L, 水体铜的含量为1.32 μg/L。观察石斑鱼摄食情况, 记录死亡数。
1.3 样品采集与处理
养殖试验结束, 禁饲24h后称重, 记录存活尾数,计算成活率、增重率和特定生长率。每个重复随机取3尾鱼测体长、体质量后备测全鱼常规养分以及全鱼矿物质含量; 另取5—7尾鱼尾静脉采血, 放入1.5 mL离心管中, 4℃静置12h, 4000×g, 4℃离心10min, 分离上清液, 保存于-80℃超低温冰箱, 用于测定血清生化指标和血清酶活力; 解剖取肝脏称重后迅速于液氮中, 后置于-80℃保存, 用于测定肝脏酶活力; 剥离脊椎骨-20℃保存, 用于测定脊椎骨矿物质含量; 剥离取肠道置于10%甲醛溶液中固定,用于制作肠道组织学切片。
1.4 测定方法
常规养分试验饲料和全鱼营养成分均参照AOAC[17]的方法进行测定: 水分含量采用105℃烘干恒重法测定, 粗蛋白质含量采用凯氏定氮法(Kjeltec 8400 凯氏定氮仪)测定, 粗脂肪含量采用索式抽提法测定, 粗灰分含量采用550℃马弗炉灼烧法测定。
生理生化、抗氧化酶血清总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDLC)和低密度脂蛋白胆固醇(LDLC)含量运用全自动生化分析仪(Hitachi-7020型)进行测定。
血清铜蓝蛋白(Ceruloplasmin, CP)活性、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)和铜锌超氧化物歧化酶(CuZn-SOD)活性采用南京建成生物工程研究所试剂盒进行检测。
矿物元素含量准确称量实验饲料、全鱼、脊椎骨0.1—0.15 g置于消解罐中, 加入8 mL硝酸(Merck, 德国)和2 mL双氧水, 放入微波消解仪(CEM MARS)消解。在赶酸后转入比色管中, 用超纯水定容。采用等离子体质谱仪(Thermo ICAP-6000 series)测定Cu、Fe、Mn、Zn四种元素含量。同时测定试验养殖水体中矿物质含量。
肠道石蜡切片苏木精-伊红(HE)染色的石蜡切片(武汉谷歌生物科技有限公司制作)在4倍全自动生物显微镜(DM600)下观察、拍照, 用体视显微镜(SZX7)测量皱襞高度(Plica height, PH), 皱襞宽度(Plica width, PW)和肌层厚度(Muscle thickness,MT), 每张切片分别随机选择10个位置测定相应数据。
1.5 计算方法
成活率(Survival rate,SR, %)=100%×Nt/N0;
增重率(Weight gain rate,WGR, %)=100%×(Wt-W0)/W0;
特定生长率(Specific growth rate,SGR, %/d)=100%×(lnWt-lnW0)/t;
饲料系数(Feed coversion ratio,FCR)=F/(Wt-W0);
肥满度(Condition factor,CF, g/cm3)=100×;肝体比(Hepatosomatic index,HSI)=100×Wh/Wt;脏体比(Viscerosomatic index,VSI)= 100×Wv/Wt。
式中:Nt为终末存活尾数,N0为初始放养尾数,Wt为终末体重(g),W0为初始体重(g),t为试验天数(d),F为饲料摄入量干重(g),Lt为终末体长(cm),Wh为肝脏重量(g),Wv为内脏团重量(g)。
1.6 数据处理与统计分析
所有数据均以平均值±标准差(Mean±SD)表示,所有取得的试验数据均在SPSS 20.0软件进行单因素分析, 当不同处理之间有显著差异(P<0.05)时, 用Duncan氏法多重比较检验。
2 结果
2.1 珍珠龙胆石斑鱼幼鱼生长性能
饲料中的铜源对珍珠龙胆的SR和FCR均无显著影响(P>0.05, 表 2)。Cu-Gly组和Cu-HMA组WGR、SGR显著高于CuSO4组(P<0.05)。
由表 3所示, Cu-HMA组HSI、VSI显著高于CuSO4组和Cu-Gly组(P<0.05)。铜源各组间CF均无显著差异(P>0.05)。

表 2 铜源对珍珠龙胆石斑鱼幼鱼生长性能的影响Tab. 2 Effects of Cu sources on growth performance of juvenile pearl gentian grouper
2.2 珍珠龙胆石斑鱼幼鱼全鱼体成分和脊椎骨矿物元素含量
在饲料中添加3种铜源显著影响全鱼水分以及粗脂肪含量(P<0.05, 表 4)。CuSO4组和Cu-Gly组全鱼水分无显著差异(P>0.05), 但是显著高于Cu-HMA组(P<0.05); Cu-HMA组粗脂肪含量显著高于CuSO4组(P<0.05)。
Cu-Gly组和Cu-HMA组全鱼铁含量无显著差异(P>0.05), 但是显著高于CuSO4组(P<0.05);CuSO4组全鱼锌含量显著低于Cu-Gly组(P<0.05),Cu-HMA组与其他两组相比无显著差异(P>0.05);全鱼铜、锰含量不受饲料铜源的影响, 各组之间无显著差异(P>0.05, 表 5)。
Cu-HMA组脊椎骨铜和锌含量显著高于CuSO4组和Cu-Gly组(P<0.05), Cu-Gly组脊椎骨铜、锌含量显著高于CuSO4组(P<0.05); Cu-Gly组脊椎骨铁含量显著高于CuSO4组和Cu-Gly组(P<0.05), Cu-HMA组脊椎骨铁含量显著高于CuSO4组(P<0.05); Cu-Gly组和Cu-HMA组脊椎骨锰含量无显著差异(P>0.05), 但是显著高于CuSO4组(P<0.05, 表 6)。
珍珠龙胆石斑鱼幼鱼养殖水体中, 矿物质铜、铁、锰、锌四种元素含量较低。各组间铜、铁、锰、锌含量均无显著差异(P<0.05, 表 7)。
2.3 珍珠龙胆石斑鱼幼鱼血清生化指标和肝脏抗氧化酶活性
CuSO4组血清TG和LDLC显著高于Cu-Gly组和Cu-HMA组(P<0.05), Cu-Gly组和Cu-HMA组相比TG和LDLC无显著差异(P>0.05)。CuSO4组血清HDLC显著低于Cu-Gly组和Cu-HMA组(P<0.05),Cu-Gly组和Cu-HMA组相比HDLC无显著差异(P>0.05)。CuSO4组血清CP含量显著高于Cu-Gly组和Cu-HMA组(P<0.05), Cu-Gly组血清CP活性显著高于Cu-HMA组(P<0.05, 表 8)。

表 3 铜源对珍珠龙胆石斑鱼幼鱼形态学指标的影响Tab. 3 Effects of Cu sources on morphological characteristics of juvenile pearl gentian grouper
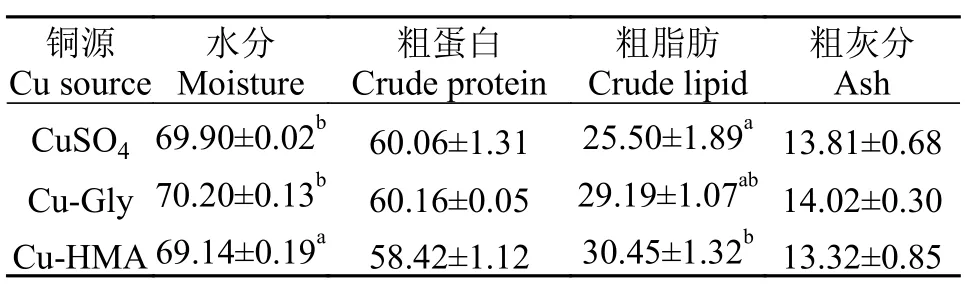
表 4 珍珠龙胆石斑鱼幼鱼全鱼体成分分析Tab. 4 Analysis of Cu sources on whole body compositions of juvenile pearl gentian grouper
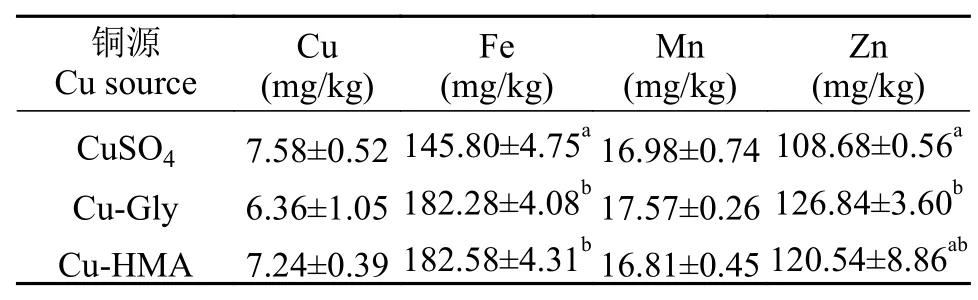
表 5 铜源对珍珠龙胆石斑鱼幼鱼全鱼铜、铁、锰、锌含量的影响Tab. 5 Effects of Cu sources on Cu, Fe, Mn and Zn contents in whole fish body

表 6 铜源对珍珠龙胆石斑鱼幼鱼脊椎骨铜、铁、锰、锌含量的影响Tab. 6 Effects of Cu sources on Cu, Fe, Mn and Zn contents in vertebrae of juvenile pearl gentian grouper

表 7 珍珠龙胆石斑鱼幼鱼养殖水体铜、铁、锰、锌含量Tab. 7 Cu, Fe, Mn and Zn content in mariculture water of juvenile pearl gentian grouper

表 8 珍珠龙胆石斑鱼幼鱼血清生化指标分析Tab. 8 Analysis of Cu sources on serum biochemical indices of juvenile pearl gentian grouper
饲料未显著影响肝脏MDA、T-SOD和CuZn-SOD活性(P>0.05, 表 9)。
2.4 珍珠龙胆石斑鱼幼鱼肠道形态结构
由表 10所示, Cu-HMA组前肠、中肠和后肠PH显著高于CuSO4组和Cu-Gly组(P<0.05), Cu-Gly组中肠和后肠PH显著高于CuSO4组(P<0.05)。Cu-Gly组前肠和后肠PW显著高于CuSO4组和Cu-HMA组(P<0.05), CuSO4组前肠和后肠PW显著高于Cu-HMA组(P<0.05); CuSO4组中肠PW显著高于Cu-Gly组和Cu-HMA组(P<0.05)。在饲料中添加3种铜源对中肠MT未产生显著影响(P>0.05), Cu-Gly组前肠和后肠MT显著高于CuSO4组和Cu-HMA组(P<0.05), CuSO4组前肠和后肠MT显著高于Cu-HMA组(P<0.05)。肠道切片显示, Cu-Gly组和Cu-HMA组杯状细胞显著多于CuSO4组(图1—3)。
3 讨论
3.1 饲料铜源对珍珠龙胆石斑鱼幼鱼生长性能的影响
不同形式的铜源在分子结构、分子量、溶解度、吸收方式以及饲料中的干扰物质等方面均存在差异[18,19]。无机铜易与饲料中的植酸和粗纤维络合成沉淀而影响铜的吸收, 而氨基酸铜可以氨基酸或肽的转运途径通过小肠绒毛刷状缘被吸收[19],因此, 无机铜的吸收利用程度低于氨基酸螯合铜[20]。乔永刚[21]研究发现以WGR和SGR为评价指标, 军曹鱼(Rachycentron canadum)对蛋氨酸铜的生物利用率是CuSO4的1.53倍和1.8倍。氨基酸铜比无机铜能更有效地能促进点带石斑鱼[11]、吉富罗非鱼(Oreochromis niloticus)[22]、俄罗斯鲟(Acipenser gueldenstaedtii)[23]、草鱼(Ctenopharyngodon idellus)[24]、花鲈(Lateolabrax japonicus)[25]等鱼类的生长, 在本试验中Cu-Gly组和Cu-HMA组WGR、SGR显著高于CuSO4组也印证了这一点。然而, 在饲料中添加氨基酸铜和CuSO4并未对异育银鲫(Carassius auratus gibelio)[26]和花鲈[25]WGR和SGR产生显著影响,可能与饲料组成、鱼体对铜源的耐受量等因素有关。
军曹鱼[21]、俄罗斯鲟[23]和虹鳟(Oncorhynchusmykiss)[27]摄食含氨基酸铜的饲料, 其骨骼中铜的含量远远高于其他组织中铜的含量, 表明骨骼对铜具有较强的累积作用。珍珠龙胆石斑鱼幼鱼全鱼铜含量不受添加铜源的影响, 但是脊椎骨中铜的含量以氨基酸螯合铜组(Cu-HMA组和Cu-Gly组)最高。矿物质的交互作用可能表现为对于肠道吸收或运输结合位点的竞争、酶活性位点的替代或矿物质正常代谢过程中的相互促进。Cu-Gly组和Cu-HMA组全鱼、脊椎骨锌、铁含量显著高于CuSO4组, 说明氨基酸铜在吸收方面不仅避免了其他矿物元素的竞争, 还能有效提高锌和铁的沉积。
铜作为参与机体代谢众多酶的辅助因子, 能显著影响哺乳动物的脂肪沉积[22]。饲料中不同铜源对阉牛血清CHOL、TG、HDLC和LDLC均无显著影响无显著影响, 但是摄食无铜组饲料的阉牛血清HDLC和LDLC均显著高于铜源组[28]。赖氨酸铜比五水硫酸铜更有效地降低北京鸭血浆TG[29]。在本实验中, 饲料中铜源对珍珠龙胆石斑鱼血清CHOL未产生显著影响, 氨基酸铜可显著降低石斑鱼血清TG和LDLC含量, 提高血清HDLC含量, 提示氨基酸铜有利于TG转运至靶组织参与能量代谢或者进入脂肪组织储存。在本实验中摄食Cu-HMA的石斑鱼全鱼粗脂肪含量显著高于CuSO4组, 也表明饲料中不同铜源会影响鱼体脂肪的含量。
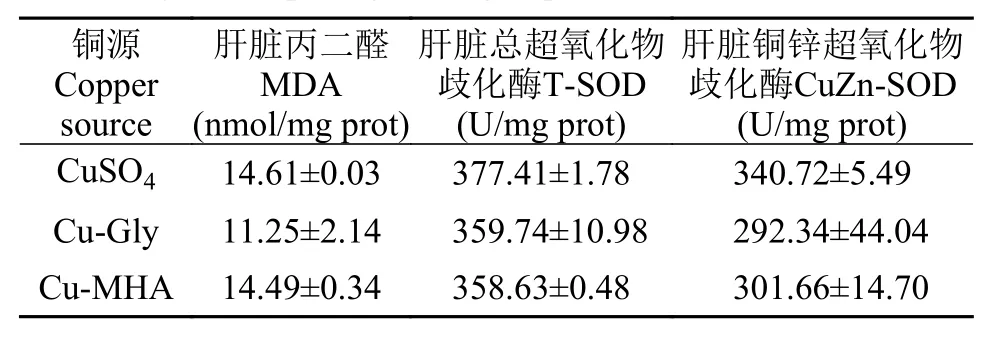
表 9 铜源对珍珠龙胆石斑鱼幼鱼肝脏抗氧化酶活性的影响Tab. 9 Effects of Cu sources on liver autioxidant enzyme activities of juvenile pearl gentian grouper
3.2 三种铜源对珍珠龙胆石斑鱼幼鱼抗氧化酶指标的影响

图 1 铜源对珍珠龙胆幼鱼前肠发育的影响(HE染色, 10×)Fig. 1 Effects of dietary copper sources on histomorphology of the foregut intestine in ♀E. fuscoguttatus×♂E. lanceolatu (HE stain, 10×)双向箭头. 肌层厚度; 弧形箭头. 皱襞宽; 曲线双向箭头. 皱襞高; 单向箭头. 杯状细胞; a. CuSO4组; b. Cu-Gly组; c. Cu-MHA组Double-headed arrow: muscle thickness; Cambered arrow: plica width; Double-headed curved arrow: plica height; Single-headed arrow:goblet cell; a. CuSO4 group; b. Cu-Gly group; c. Cu-MHA group

图 2 三种铜源对珍珠龙胆幼鱼中肠发育的影响(HE染色, 10×)Fig. 2 Effects of dietary copper sources on histomorphology of the midgut intestine in ♀E. fuscoguttatus×♂E. lanceolatu (HE stain, 10×)
CP是动物体内的一种含铜的糖蛋白, 可调节铜在组织中的分布, 调节机体组织中脂质过氧化物如MDA及自由基的产生[9,30], 还参与铜锌超氧化物歧化酶(CuZn-SOD)的组成, 参与机体抗氧化。Shao等[9]得出异育银鲫血浆T-SOD和CuZn-SOD活性不受饲料铜源的影响。同样, 在本实验中石斑鱼肝脏T-SOD和CuZn-SOD活性亦不受铜源的影响。然而, 相比于CuSO4或碱式氯化铜, 异育银鲫[9]和俄罗斯鲟幼鱼[23]摄食氨基酸螯合铜可获得较高的血浆CP活性和肝脏CuZn-SOD活性, 同时MDA含量较低, 具有更好的抗氧化作用。在饲料中分别添加4.54和6.34 mg/kg的蛋氨酸铜和CuSO4对俄罗斯鲟具有相同的抗氧化效果[23]。但是, 本实验CuSO4组血清CP活性显著高于Cu-Gly组和Cu-HMA组, 饲料不同的铜源对石斑鱼肝脏SOD活性和MDA含量没有显著影响。

图 3 三种铜源对珍珠龙胆幼鱼后肠发育的影响(HE染色, 10×)Fig. 3 Effects of dietary copper sources on histomorphology of the hindgut intestine in ♀E. fuscoguttatus×♂E. lanceolatu (HE stain, 10×)
3.3 三种铜源对珍珠龙胆石斑鱼幼鱼肠道形态的影响
肠道作为营养物质消化和吸收的主要场所, 其良好的生长发育是养分被充分消化、吸收和利用的基本保障[31,32]。鱼类肠黏膜PH是肠道吸收营养物质能力的标志[33], MT的增加可以提高小肠吸收营养物质的表面积, 改善肠道消化和吸收能力[34—37]。铜在机体内的稳态主要通过肠道吸收来调节[38], 而鱼类对饲料铜的吸收主要发生在幽门、中肠和后肠[26]。不同来源的铜对肠道的发育影响不同, 相对于CuSO4组, Cu-Gly可改善小鼠肠道绒毛长度和绒毛厚度[38]; 蛋白螯合铜组生长肥育猪十二指肠、空肠上皮细胞绒毛高度、绒毛宽度有升高趋势[39]; 载铜蒙脱石显著提高了罗非鱼前肠、中肠、后肠绒毛和微绒毛高度[40]。在本实验中Cu-HMA和Cu-Gly能提高珍珠龙胆石斑鱼中、后肠的PH、MT和PW, 表明氨基酸铜对肠道PH、PW和MT有积极的改善作用, 从而提高鱼类的生长和饲料利用率。
4 结论
在本实验条件下, 在饲料中添加Cu-Gly和Cu-HMA能显著影响珍珠龙胆石斑鱼幼鱼的生长及血清脂质代谢。铜源不影响全鱼铜的沉积, 而Cu-Gly和Cu-HMA则有利于脊柱骨铜的沉积, 且后者的作用效果更好。铜源显著影响中、后肠皱襞高度, 有利于肠道的消化吸收。
