苹果多酚处理对鲜切芋艿品质的影响
2019-07-20吴松霞郜海燕刘瑞玲韩延超吴伟杰陈杭君
吴松霞,郜海燕,刘瑞玲,韩延超,吴伟杰,陈杭君,*
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.浙江省农业科学院食品科学研究所,农业农村部果品采后处理重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江 杭州 310021 )
芋艿((Colocasia esculenta (L.) Schott)俗称为芋头,属天南星科单子叶多年生草本植物,在我国云南、四川、贵州、福建、海南、浙江等地均有栽培,其中宁波奉化享有“芋艿之乡”的美名,奉化芋艿是深受大众喜爱的蔬菜之一[1-3]。芋艿皮薄、肉质厚,因其含有丰富的营养物质逐渐成为人们饮食搭配的食材,其还具有较高的抗氧化性,可清除人体内的自由基、预防糖尿病、降低胆固醇等[4-8]。
鲜切果蔬由于去皮、切分等加工处理导致其色泽褐变、质地软化或木质化、风味和营养物质流失,从而造成腐烂致使其失去商品性[9-11]。芋艿表皮难以去除,尤其是人手接触后会造成皮肤瘙痒,给烹调加工带来诸多不便,通过鲜切加工处理不仅能解决这一问题,且还能扩大芋艿产品的消费市场。芋艿为非呼吸跃变型蔬菜[2],切分导致芋艿呼吸作用、乙烯代谢加强,从而提高其酚酶活性,在氧气的参与下,酚酶催化酚类物质氧化,加速了贮藏期间褐变的进程。芋艿去皮产生的机械损伤破坏了其细胞结构的完整性,使得细胞器中的酚类物质外泄被氧化形成褐色聚合物,从而使切面色泽劣变。谭谊谈等[12-13]研究多种保鲜方式对鲜切芋艿褐变的影响,结果表明保鲜处理能够抑制褐变发生的酚酶活性上升以及酚类物质被氧化的程度,因此能延缓鲜切芋艿的褐变。此外,王佳宏等[14]的研究结果表明低温贮藏能保持鲜切芋艿较好的品质,提高其商品性。
苹果多酚(apple polyphenols,APP)是苹果果皮中的天然植物多酚,主要由原花青素、黄酮醇、二氢查耳酮和其他酚酸等组成[15],具有调节人体免疫力,防止衰老,辅助治疗心血管疾病、炎症、食物过敏和吸烟所致肺损伤等功能[16]。此外,已有关于APP处理在部分果品如火龙果[17]和荔枝[18]等保鲜中的研究,但在鲜切芋艿保鲜应用中尚鲜见报道。本实验以不同质量分数的APP处理鲜切芋艿,研究贮藏期间对其褐变及品质的控制效果,以期为芋艿保鲜产业提供一定的借鉴及参考。
1 材料与方法
1.1 材料与试剂
芋艿购于浙江宁波奉化基地,挑选大小均一、没有病虫害、外观完整无机械伤的芋艿。
APP(纯度80%,食品级) 西安昌岳生物科技有限公司;苯酚、浓硫酸 上海凌峰化学试剂有限公司;考马斯亮蓝G250、愈创木酚 上海麦克林生化科技有限公司;Folin-Ciocalteau试剂 上海源叶生物科技有限公司。
1.2 仪器与设备
TA.XT.plus物性测定质构仪 英国Stable Micro Systems公司;CR-400手持色差仪 日本柯尼卡美能达公司;Bifugo stratos高速冷冻离心机 美国Thermo公司;Cintra404紫外分光光度计 澳大利亚GBC公司;UV-9000紫外-可见分光光度计 上海元析仪器有限公司;XMTD-8222水浴锅 上海精宏实验设备有限公司;MIR-553恒温箱 日本Sanyo公司。
1.3 方法
1.3.1 原料处理与分组
芋艿用200 mg/L的次氯酸钠溶液浸泡2 min后流水冲洗1 min,晾干,切去表皮,切分为厚度约0.5 cm、大小均一的切片,将切分后的芋艿分别用蒸馏水(CK)或0.3%(质量分数,下同)、0.5%、0.7% APP溶液浸泡3 min,然后流水冲洗1 min。沥干水分分装于聚丙烯塑料保鲜盒中,用保鲜袋(32 cm×25 cm×0.01 mm)挽口包装,每盒12~15 片,每组处理3 次重复(每组处理约24 盒)。置于温度(10.0±0.5)℃、相对湿度60%~70%条件下定期观察并每2 d取样一次测定指标,每次随机取样3 盒。
1.3.2 色泽测定
每组随机取10 片芋艿切片,对其中部采用手持色差仪进行L*、a*、b*值测定,取其平均值。
1.3.3 硬度测定
随机取10 片芋艿切片采用质构仪(探头直径6 mm)测定硬度,测试模式为TPA,测前速率为1 mm/s,测中速率为2 mm/s,测后速率为5 mm/s,压缩比为30%,触发力为5 g,结果取平均值。
1.3.4 还原性糖含量测定
参考曹建康等[19]的方法稍作修改。准确称取1.00 g芋艿研磨样品于25 mL具塞试管,加蒸馏水至刻度线,于80 ℃恒温水浴中加热30 min。取出冷却后,过滤浸提液,用20 mL蒸馏水洗涤残渣,再过滤。将两次滤液全部收集在100 mL容量瓶中,定容至刻度,作为还原糖提取液备用。取25 mL刻度试管,分别加入还原糖提取液2 mL和二硝基水杨酸试剂1.5 mL,按照制作标准曲线的方法测定芋艿还原性糖含量。
1.3.5 可溶性糖含量测定
可溶性糖含量测定参考曹建康等[19]的方法。准确称取1.00 g芋艿研磨样于25 mL具塞试管中,加入10 mL蒸馏水,沸水浴提取30 min,冷却后,将全部滤液过滤到100 mL容量瓶中,回收残渣于具塞试管中,加入10 mL蒸馏水,再次沸水浴10 min后,过滤至同一容量瓶,蒸馏水反复冲洗残渣,过滤转至容量瓶,定容至刻度备用。
取25 mL具塞试管,吸取0.1 mL样品液,分别加入1.9 mL蒸馏水和1 mL苯酚溶液,在5~20 s内加入5 mL浓硫酸,摇匀,在室温下放置反应30 min,以蒸馏水作参比调零,于485 nm波长处测定吸光度。按照标准曲线计算出芋艿的可溶性糖含量。
1.3.6 总酚含量测定
总酚含量的测定参考李巨秀等[20]的方法,采用Folin-Ciocalteau法进行测定。取1.00 g的芋艿研磨样,加入5 mL、体积分数60%乙醇溶液在25 ℃条件下取液浸提2 h,于8 000 r/min、4 ℃条件下离心20 min后,取2 mL上清液加入至25 mL的具塞试管,加入3 mL Folin-Ciocalteau试剂后摇匀静置5 min,分别加入6 mL 7.5 g/100 mL碳酸钠溶液,用蒸馏水定容至25 mL,25 ℃下暗反应2 h,于波长760 nm处测定其吸光度。
1.3.7 丙二醛含量测定
丙二醛(malondialdehyde,MDA)含量的测定参考Dhindsa等[21]的方法,称取1.00 g芋艿研磨样,加入5 mL 100 g/L的三氯乙酸溶液,于8 000 r/min、4 ℃条件下离心20 min,收集上清液低温备用。取2 mL上清液,加入2 mL 6.7 g/L硫代巴比妥酸溶液,混匀后沸水浴20 min,冷却后再次离心,分别测定450、532 nm和600 nm波长处的吸光度。MDA含量计算公式如下。
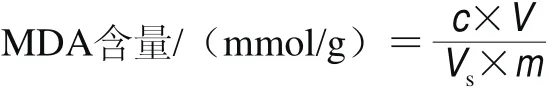
式中:c表示反应混合混合液中MDA浓度/(mmol/L),c=0.45×(OD532nm-OD600nm)-0.56×OD450nm;V表示样品提取液总体积/mL;Vs表示测定时所取样品提取液体积/mL;m表示样品质量/g。
1.3.8 POD、PPO活力测定
称取1.00 g芋艿研磨样于10 mL离心管,立即加5 mL 0.1 mol/L磷酸缓冲液(pH 6.8),于8 000 r/min、4 ℃条件下离心20 min,取上清液,即为酶提取液。过氧化物酶(peroxidase,POD)活力的测定参考Kochba等[22]的方法并稍作修改,反应体系:0.4 mL酶液+0.2 mL 6 mmol/L愈创木酚+2.4 mL 5 mmol/L的过氧化氢,以蒸馏水为参比,测定反应液在室温条件下420 nm波长处3 min内吸光度的变化,以每分钟吸光度变化0.01为一个酶活力单位(U)。多酚氧化酶(polyphenol oxidase,PPO)活力测定参考Zauberm等[23]的方法并稍作修改,3 mL反应体系:0.2 mL酶液+2.8 mL 10 mmol/L邻苯二酚,测定室温条件下反应液在470 nm波长处3 min内吸光度的变化,以每分钟吸光度变化0.01为一个酶活力单位(U)。酶活力单位均为U/g,结果以鲜质量计。
1.3.9 PAL活力测定
苯丙氨酸解氨酶(phenylalanin ammonia-lyase,PAL)活力的测定参考Zeng Kaifang等[24]的方法并稍作修改。称取1.00 g样品组织,加入5.0 mL提取缓冲液(含50 mmol/L pH 8.8硼酸缓冲液+5 mmol/L β-巯基乙醇+40 g/L聚乙烯吡咯烷酮溶液+2 mmol/L 乙二胺四乙酸溶液)混合匀浆,于8 000 r/min、4 ℃条件下离心20 min,上清液即为酶提取液,低温备用。取3 mL 50 mmol/L pH 8.8硼酸缓冲液、0.5 mL 20 mmol/L L-苯丙氨酸溶液,摇匀,37 ℃保温10 min后,加入0.5 mL酶液混合,迅速测定290 nm波长处的吸光度;再将试管置于37 ℃保温60 min后测定吸光度,以蒸馏水为参比调零,以每小时每克鲜样酶反应体系吸光度增加0.01为一个PAL活力单位(U),单位为U/g,结果以鲜质量计。
1.3.10 LOX活力测定
脂氧合酶(lipoxidase,LOX)活力的测定参照曹建康等[19]的方法,并稍作修改。称取1.00 g芋艿研磨样品,加入5.0 mL经预冷的pH 6.8磷酸缓冲液(含体积分数1% Trion-X、4 g/100 mL PVPP),然后于8 000 r/min、4 ℃条件下离心20 min,收集上清液(粗酶液),低温备用。再取2.775 mL 0.1 mol/L、pH 6.0柠檬酸缓冲液于反应体系中,加入0.1 mL、体积分数0.5%亚油酸,再加入0.2 mL粗酶液。以蒸馏水为参比调零,在反应15 s时开始记录反应体系在234 nm波长处吸光度,每隔30 s测定1 次,测定其180 s内的吸光度变化。以每克鲜样每分钟吸光度增加0.01为1 个LOX活力单位(U),单位为U/g,结果以鲜质量计。
1.4 数据处理与分析
采用Excel 2007软件进行数据统计、Origin Pro 2017软件进行数据图表制作,采用SPSS 24.0软件的Duncan’s法进行数据显著性差异分析(P<0.05)。除特殊说明外,所有数据均为3 次重复实验的平均值和标准差。
2 结果与分析
2.1 APP 处理对鲜切芋艿贮藏过程中色泽的影响

图1 芋艿切片贮藏10 d后的外观图Fig. 1 Appearance of fresh and APP-treated taro slices during 10 days of storage
果蔬采后色泽极易发生劣变,如黄化、褐变、绿化等[25]。新鲜芋艿肉质呈乳白色,鲜切后在贮藏期间极易发生褐变。根据CIELab颜色系统进行分析,L*、a*、b*值分别代表色泽亮暗程度、红绿程度和黄蓝程度[26]。由表1可知,随着贮藏时间的延长,芋艿切片色泽L*值呈缓慢下降趋势,在贮藏的0 d各组L*值为82.73,至贮藏末期,各处理组分别下降了24.82%(CK)、18.19%(0.3% APP)、7.25%(0.5% APP)和21.13%(0.7% APP),且各处理组间存在显著性差异(P<0.05)。鲜切芋艿的色泽a*值在贮藏期间呈急剧上升,表明芋艿切面红色偏向加深;CK组a*值从第2天就显著高于其他处理组(P<0.05),整个贮藏过程中a*值由-0.34急剧升至16.53,贮藏末期,各APP处理组a*值在5.07~13.74之间,其值从小到大依次为:0.5% APP<0.3% APP<0.7% APP。鲜切芋艿色泽b*值缓慢升高,各组之间总体上差异不显著(P>0.05)。从表1和图1可知,0.5% APP处理组芋艿切片保持较好色泽,表明适宜质量分数的APP处理能够延缓鲜切芋艿色泽劣变。
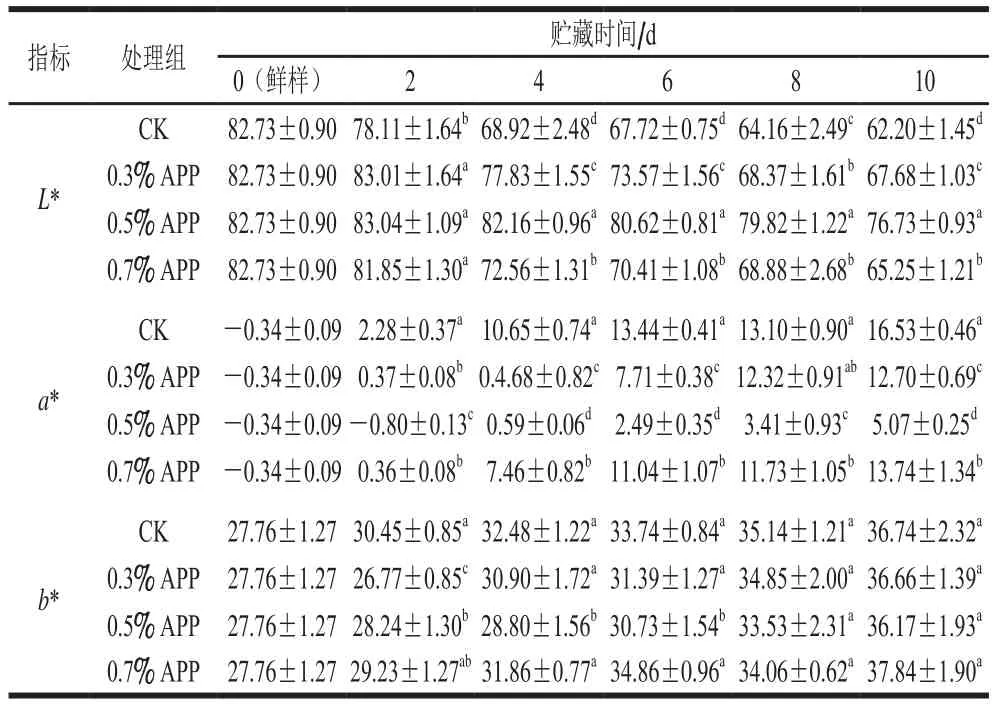
表1 苹果多酚处理对鲜切芋艿贮藏过程中色泽的影响Table 1 Effect of APP treatment on color of fresh-cut taro slices during storage
2.2 APP 处理对鲜切芋艿贮藏过程中硬度的影响

图2 苹果多酚处理对鲜切芋艿贮藏期间硬度的影响Fig. 2 Effect of APP treatment on hardness of fresh-cut taro slices during storage
硬度是评价果蔬质地的重要指标,能够直接反映产品质量和消费者的接受度[27]。由图2可知,贮藏期间CK组鲜切芋艿硬度呈下降趋势,CK组贮藏至第6天开始就显著低于其他3 个APP处理组(P<0.05),至贮藏末期下降了70%,而APP处理组保持较高的硬度,且0.5% APP处理在一定程度上提高了芋艿的硬度,贮藏末期其硬度为6.70 kg/cm2,表明APP处理能有效地抑制芋艿贮藏过程中硬度的降低。
2.3 A PP处理对鲜切芋艿贮藏过程中还原糖和可溶性糖含量的影响

图3 苹果多酚处理对鲜切芋艿贮藏期间还原糖(A)和可溶性糖(B)含量的影响Fig. 3 Effect of APP treatment on reducing sugar (A) and soluble sugar (B) content of fresh-cut taro slices during storage
糖类物质作为果蔬重要的营养物质,为果蔬的生理活动提供能量。由图3可知,芋艿贮藏过程中还原糖和可溶性糖含量均呈降低趋势。贮藏的前2 d,各组还原糖含量急剧降低,随后缓慢下降。贮藏末期CK组还原糖含量显著低于0.5% APP组(P<0.05);CK组还原糖含量在贮藏末期仅为初始含量的32.02%,而0.5% APP处理组为初始含量的44.19%(图3A)。CK组芋艿可溶性糖含量在贮藏末期仅为初始的20.75%,且显著低于其他3 个APP组(P<0.05),其中0.5% APP处理组可溶性糖含量最高,为初始含量的42.26%。因此,0.5% APP有利于鲜切芋艿保持较高的糖类物质含量。
2.4 AP P处理对鲜切芋艿贮藏过程中PAL活力和总酚含量的影响
PAL是苯丙烷代谢途径中的第一个酶,苯丙烷代谢途径中间产物及进一步转化的产物酚类、类黄酮等可以被酚酶氧化形成褐色聚合物,从而导致组织褐变[27]。如图4A所示,贮藏过程中PAL活力呈上升趋势,CK组和0.7% APP组从第2天开始就急剧升高,且2 d后显著高于0.3%、0.5% APP组(P<0.05),并在第8天达到活力高峰,贮藏末期0.3% APP与0.5 % APP组间无显著性差异(P>0.05)。表明适宜质量分数的APP处理能延缓PAL活力高峰的出现。
如图4B所示,鲜切芋艿在贮藏过程中总酚含量呈现先降低后升高趋势,可能是切分导致前期组织生理活动旺盛,增加了总酚的消耗及氧化,导致总酚含量降低,贮藏末期CK组显著高于0.5%、0.7% APP组(P<0.05),高于0.3% APP组,但与其无显著性差异(P>0.05)。这是由于APP处理能延缓PAL活力升高,从而抑制贮藏后期酚类物质的合成速度,抑制褐变。
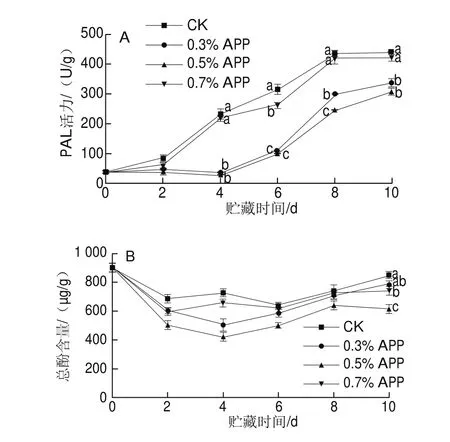
图4 苹果多酚处理对鲜切芋艿贮藏期间PAL活力(A)和总酚含量(B)的影响Fig. 4 Effect of APP treatment on PAL activity (A) and total phenol content (B) of fresh-cut taro slices during storage
2.5 APP 处理对鲜切芋艿POD和PPO活力的影响
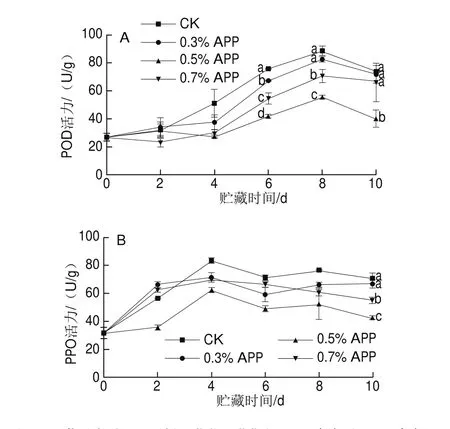
图5 苹果多酚处理对鲜切芋艿贮藏期间POD(A)和PPO(B)活力的影响Fig. 5 Effect of APP treatment on POD (A) and PPO (B) activities of fresh-cut taro slices during storage
POD和PPO能催化酚类化合物的氧化,导致组织发生褐变,可通过抑制氧化酶活力来延缓果蔬褐变的发生[28]。如图5A、B所示,鲜切芋艿贮藏期间POD和PPO活力呈先升后降趋势,贮藏至8 d时,各组的POD活力出现高峰,此时0.3%、0.5%和0.7% APP组POD活力分别为CK组的93.47%、62.77%和80.18%,从第6天开始,0.5% APP组的POD活力显著低于其他3 个组(P<0.05),贮藏末期CK组活力最高,且显著高于0.5% APP组POD(P<0.05)。PPO活力高峰出现在第4天,此时,0.3%、0.5%和0.7%分别为CK组的85.78%、74.41%、83.63%。4 d后各组PPO活力缓慢降低,整个贮藏过程中,0.5% APP组的PPO活力最低,且贮藏末期显著低于其他3 个组(P<0.05)。表明适宜质量分数的APP处理能够抑制鲜切芋艿酶促褐变的进程。
2.6 APP处理对鲜切芋艿LOX活力和MDA含量的影响
MDA含量可作为衡量膜脂过氧化程度的直接指标,MDA的积累与LOX活力变化有关[29-30]。如图6A、B所示,芋艿切片贮藏期间的LOX活力和MDA含量都呈上升趋势。贮藏末期CK组的LOX活力显著高于各APP组(P<0.05),CK组LOX活力分别是0.3%、0.5%、0.7% APP处理组的1.30、1.58、1.26 倍。第4天以后,CK组的MDA含量显著高于APP处理组(P<0.05),至贮藏末期CK组MDA含量依次为0.3%、0.5%、0.7% APP处理组的1.12、1.39、1.08 倍。因此,说明0.5% APP处理能够延缓芋艿切片贮藏过程中的膜脂过氧化进程。
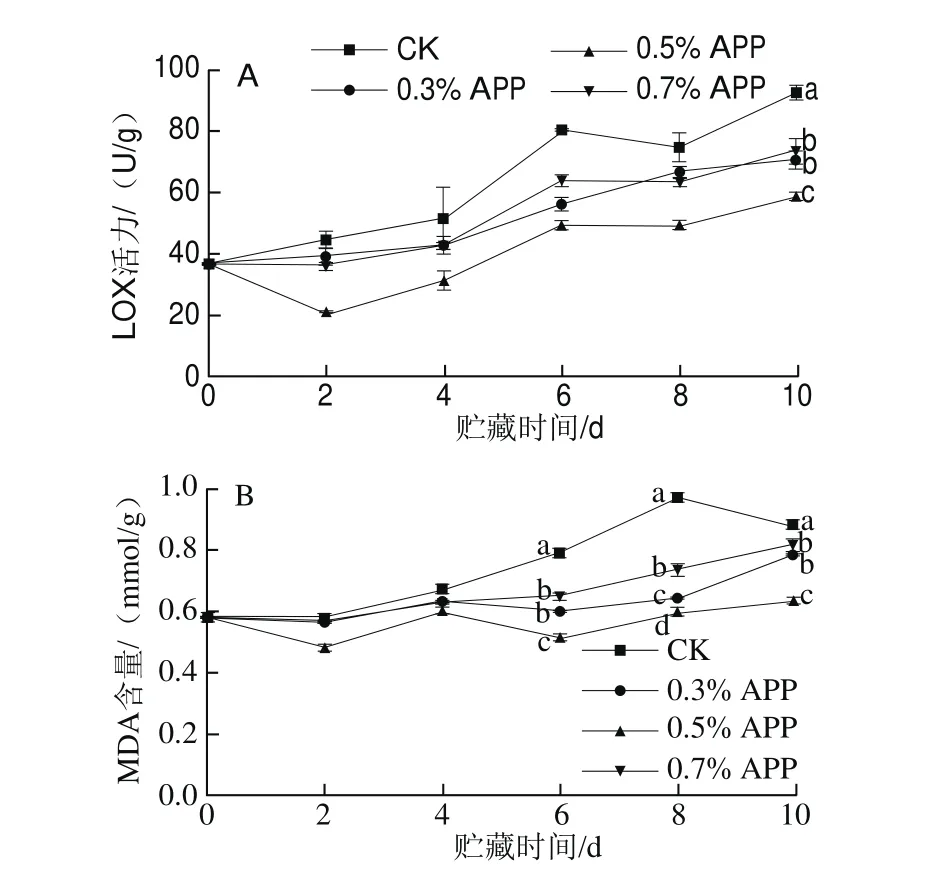
图6 苹果多酚处理对鲜切芋艿贮藏期间LOX活力(A)和MDA含量(B)的影响Fig. 6 Effect of APP treatment on LOX activity (A) and MDA content (B)on fresh-cut taro slices during storage
3 讨 论
细胞膜完整性和细胞结构的变化会影响果蔬采后组织硬度[31],切分伤口致使膜脂过氧化和衰老介导应激下的膜完整性丧失,导致渗透性溶质渗漏到细胞外,使组织出现失水和结构松弛,从而导致果蔬硬度下降[32]。贮藏后期CK组的芋艿切片硬度急剧下降,而APP处理抑制了硬度的下降,且0.5% APP在一定程度上提高了芋艿切片的硬度,主要是由于APP处理抑制了鲜切芋艿细胞膜结构的损害,因此也抑制其膜脂代谢有害产物的生成[33]。同时,切割导致组织结构完整性遭到损伤,生理代谢反应加快,加速了糖类物质的分解和消耗,导致贮藏期芋艿切片还原糖和可溶性糖含量降低,这与王梅等[34]的实验结果相似。
果蔬采后褐变主要分为酶促褐变与非酶促褐变两种类型,酶促褐变包括PPO、POD、PAL等酚酶参与的褐变,非酶促褐变主要包括酚类、黄酮类等抗氧化物质所引起的褐变。APP因富含花青素、绿原酸等抗氧化物质而具有较强的抗氧化活性和自由基清除能力,能控制果蔬采后褐变的发生[35-36]。APP抑制褐变的机理表现在控制由PPO、POD和PAL等酚酶参与的酶促褐变及延缓非酶促褐变物质的释放和氧化。贮藏期鲜切芋艿的POD和PPO活力呈现先升后降的趋势,贮藏期组织细胞可能遭到活性氧的攻击,因此贮藏前期POD、PPO活力升高,催化底物酚类物质的氧化,贮藏末期随着组织的衰老加剧而活力下降。APP处理在一定程度上抑制了贮藏期鲜切芋艿POD、PPO活力的升高,从而延缓了酚酶的催化反应,减缓鲜切芋艿褐变的进程。APP处理延缓了PAL活力升高,从而降低其代谢途径的中产物总酚的合成量,本研究中芋艿切片PAL活力的变化趋势与贮藏后期总酚含量升高相吻合。在谭谊谈等[13]的研究得出相似的结论,复合处理组(2.5%抗坏血酸+0.05%半胱氨酸+0.4%氯化钙)能显著降低PPO和POD的活力。此外,经1-甲基环丙烯处理后的鲜切芋艿,与对照组相比,其PAL活力高峰和总酚最大合成量均延迟了2 d[12]。而在Fan Panhui等[17]对鲜切火龙果的贮藏保鲜研究发现,APP处理鲜切火龙果能够延缓总酚含量的下降,而本实验APP处理能保持鲜切芋艿较低的总酚含量,这可能是不同植物组织中的总酚代谢存在差异所致。本实验发现APP处理能降低POD与PPO活力峰值,在一定程度上延缓鲜切芋艿的褐变进程,这与Zhang Zhengke等[18]的褐变研究结论相似。
LOX能够催化含特殊结构的不饱和脂肪酸的氧化,导致细胞结构完整性破坏,从而引发植物细胞膜脂过氧化,导致其代谢产物MDA大量生成而毒害组织。果蔬在切割损伤的信号激活下,膜脂过氧化加剧,使细胞区室化遭到破坏,酚类物质外泄,促使酚酶与底物结合而加速了酶促反应[37]。在鲜切荸荠[29]和梨[30]等的研究中发现LOX可通过氧化损伤膜脂而导致褐变加速。本实验发现APP处理能延缓鲜切芋艿LOX活力和MDA含量的升高,这与前人研究1-甲基环丙烯处理能抑制鲜切芋艿在贮藏期LOX活力升高[12]及APP处理能延缓新鲜荔枝MDA含量升高[18]的结论相似,过高或者过低浓度的APP处理都不能达到较好的保鲜效果,低浓度APP所含有效抗氧化成分低,不能较好地发挥其抗氧化能力;植物组织在渗透平衡条件下有序地进行细胞内外的物质交换,当渗透平衡被打破时,如细胞外渗透压低,将导致胞内物质外流[38-39]。有研究表明,相对于3 mL/kg乙醇,0.5 mL/kg乙醇处理效果好,高剂量条件下,乙醇渗透到果实体内,造成果蔬渗透伤害,破坏了果蔬代谢机制[40-41]。因此,推测高浓度的APP会导致细胞膜内外环境的渗透平衡失调,胞内物质大量外泄,营养流失,从而加速组织细胞衰老。
本实验结果表明,与CK相比,APP处理能维持鲜切芋艿贮藏期内较好的贮藏品质,其中0.5% APP能更好地维持鲜切芋艿的贮藏品质。
