CO2脱涩对柿果理化特性、酚类成分及抗氧化能力的影响
2019-07-20陈佳歆毕金峰郭崇婷陈芹芹
陈佳歆,周 沫,毕金峰,李 旋,郭崇婷,陈芹芹,辛 广*
(1.沈阳农业大学食品学院,辽宁 沈阳 110161 ;2.中国农业科学院农产品加工研究所,农业农村部农产品加工重点实验室,北京 100193 )
柿树属柿科(Ebenaceae)、柿属(Diospyros L.f.),原产于我国。柿树在我国的栽培历史已有1 000多年。2017年,我国柿果的总产量约为4.3×106t,约占世界总产量的75.7%[1]。柿果作为一种重要的传统水果,不仅含有多种糖类及矿物质(如碘、钙、磷、铁、锌等),还含有类胡萝卜素、膳食纤维、VC等活性成分[2-5],其中,黄酮、单宁、酚酸类物质含量丰富[6-9]。
目前研究已证明柿果中同时存在着多酚和高聚合度的黄烷醇,如花青素和缩合单宁[3]。鲜柿中的酚酸主要包括没食子酸、绿原酸、缬氨酸、原儿茶酸、咖啡酸、阿魏酸和对香豆酸等;单体黄烷醇包括儿茶素、表儿茶素、表没食子酸儿茶素等[10]。单宁是柿果中主要的酚类物质,其含量约占酚类物质总量的70%~75%[11]。Hagerman等研究表明,缩合单宁清除自由基的能力比简单酚类强15~30 倍[12]。田燕等的研究表明柿果单宁的抗氧化效果随着聚合度的增加而增强,高分子质量柿果单宁具有很好的体内外抗氧化效果[13]。许多研究也表明,柿中的多酚类化合物具有抗氧化、抗菌、减轻高血脂症以及预防动脉硬化等作用[14-16]。
虽然柿果在商业成熟期含有大量的多酚和单宁,并表现出较高的抗氧化等生物活性,但我国柿果品种多为涩柿,食用前必须要经过脱涩,进行人工后熟,除去涩味。柿果的脱涩方法主要分为两类:一类是直接脱涩,即利用化学物质直接渗入到单宁细胞中,与其中的可溶性单宁反应转化为不可溶单宁,类似的方法有乙醇脱涩、石灰水脱涩等;第二类是间接反应,其原理是利用果实的无氧呼吸产生的乙醇转化为乙醛,乙醛与呈现涩味的可溶性单宁发生缩合反应,使可溶性单宁溶解性下降,不能与口腔中的唾液蛋白酶结合,从而除去涩味,如CO2脱涩、温水脱涩等[17]。CO2脱涩因具有保硬、操作简便、脱涩效果好、节约能源等优势,是目前商业上最常用的脱涩方法。然而,目前国内外针对柿果原料的研究多基于脱涩前柿果,对于酚类物质在柿果脱涩过程中的变化以及脱涩后柿果的营养价值关注较少。
因此,本实验针对CO2脱涩过程中柿果理化特性、酚类成分含量及抗氧化能力的变化进行研究,考察脱涩时间对柿果硬度、水分含量、水分活度、pH值、可溶性固形物含量、糖类含量以及可溶性单宁、总酚、总黄酮等酚类物质含量的影响,采用梯度超滤法依据分子质量将柿果中酚类物质进行分类,进一步探究脱涩过程中柿果不同分子质量酚类物质、缩合单宁含量变化及脱涩对柿果抗氧化能力的影响,为柿果的加工利用提供理论依据。
1 材料与方法
1.1 材料与试剂
柿果采购于广西桂林丰华园有限公司,品种为月柿。原料采收时间为2017年10月,采收时颜色金黄、坚硬且未脱涩,挑选大小及颜色均一、表面无损伤、无病虫害的柿果,采收后立即运回实验室贮藏于4 ℃冷库备用。
没食子酸、芦丁、儿茶素、福林-酚试剂、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、2,4-6-三(2-吡啶)-S-三嗪(2,4,6-Tris(2-pyridyl)-S-triazine,TPTZ) 美国Sigma公司;氢氧化钠、盐酸、浓硫酸、苯酚、葡萄糖、甲醇、碳酸钠、亚硝酸钠、硝酸铝、过硫酸钾、三氯化铁(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
TA.XT 2i/50型物性分析仪 英国Stable Micro Systems公司;DH9-9023A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;WZB45型数显折光仪、PHS-3C pH计 上海精密科学仪器有限公司;水分活度测定仪美国Decagon公司;UV-1800型紫外分光光度计 日本岛津公司;3K15型冷冻离心机 美国Sigma公司;SB25-12DTN型超声波清洗器 宁波新芝生物科技股份有限公司;超滤离心管 德国Merck-Millipore公司。
1.3 方法
1.3.1 CO2脱涩处理
柿果采收后于一周内完成脱涩处理。每组随机挑选10 个柿果置于双管口干燥器(直径240 mm,高300 mm)内,干燥器上方连接两根胶管,其中一根胶管通入纯度为99.99%的CO2,另一根胶管深入容器底,用于排除空气。利用CO2浓度测定仪监测干燥器内的CO2体积分数。待干燥器内的CO2体积分数达到(95±2)%时,立刻将两管密封。随后将干燥器置于恒温培养箱内,并将培养温度设定为30 ℃。实验共分为6 组,每组的脱涩时间分别为0、12、20、28、36、44 h。取样后将柿果去蒂、去皮(厚度约为2 mm)、切块,用液氮冷冻后粉碎,保存于-80 ℃冰箱备用。
1.3.2 基本理化指标的测定
每组取10 个柿果进行硬度、pH值、可溶性固形物含量、水分含量及水分活度的测定。硬度的测定:将柿果去皮(厚度约为2 mm)后,采用质构仪进行测定,测定参数为:探头直径5 mm、刺穿深度6 mm、探头速率60 mm/min。在每个柿果的赤道位置上随机测定3 个点。取10 个柿果的平均值作为每组柿果的硬度。可溶性固形物含量的测定:将10 个柿果打浆、混合均匀后,利用数显折光仪(范围0~45 °Brix)进行测定,以蒸馏水调零。水分含量的测定:参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18]中方法,以鲜质量计。水分活度利用水分活度仪进行测定。pH值利用pH计进行测定。
1.3.3 糖类相关指标的测定
1.3.3.1 总糖含量的测定
采用苯酚-硫酸比色法。准确称量5.00 g样品,加入2 mL浓度为6 mol/L的HCl溶液及20 mL蒸馏水,振荡摇匀。将匀浆于96 ℃下水浴2 h,冷却后加入2 mL浓度为6 mol/L的NaOH溶液,振荡摇匀后10 000 r/min离心20 min,取上清液定容,待测。吸取1.0 mL稀释后的待测样品,加入1.0 mL 0.05 g/mL苯酚及5.0 mL浓硫酸,立刻摇匀,冷却至室温,放置20 min后于490 nm波长处测定吸光度。根据不同浓度的葡萄糖溶液反应测得的吸光度绘制标准曲线,计算待测样品的总糖含量。结果以每克干样品中葡萄糖的质量表示。
1.3.3.2 还原糖、可溶性糖含量的测定
按照NY/T 2742—2015《水果及制品可溶性糖的测定3,5-二硝基水杨酸比色法》[19]中方法进行测定。结果以每克干样品中葡萄糖的质量表示。
1.3.3.3 单糖含量的测定
准确称取5.00 g样品加入50 mL蒸馏水,超声20 min后10 000 r/min离心20 min,取上清液定容,待测。色谱柱为Carbo PacTMPA20(3 mm×150 mm);梯度洗脱条件:流动相A为水,流动相B为250 mmol/L的NaOH,0~20 min,94% A;20~20.1 min,20% A;20.1~30 min,20% A;30.1~40 min,94% A。流速0.5 mL/min;进样体积10 μL;柱温35 ℃;检测器为脉冲安培检测器,金电极[20]。结果以干样品计。
1.3.4 总酚含量的测定
准确称取2.00 g样品,加入20 mL体积分数80%甲醇溶液,匀浆。于室温、避光下水浴间歇超声2 h,在4 ℃下9 500 r/min离心20 min,取上清液定容,待测。取2 mL稀释后的样品加入1.0 mL体积分数10%福林-酚试剂,混匀;静置5 min后加入2.0 mL 0.04 g/mL Na2CO3溶液,混匀并于85 ℃下反应5 min,用蒸馏水定容至10 mL;以试剂空白作为对照,在765 nm波长处测定吸光度。以没食子酸作为标准品绘制标准曲线定量[21]。结果以每100 g干样品中没食子酸的质量表示。
1.3.5 黄酮含量的测定
样品液制备如1.3.4节方法。取0.5 mL稀释后的待测样品液加入0.5 mL 0.05 g/mL亚硝酸钠溶液,摇匀,静置6 min;然后加入0.5 mL 0.1 g/mL硝酸铝,摇匀,静置6 min;最后加入4 mL 0.04 g/mL NaOH,摇匀,静置10 min后,定容至10 mL;以试剂空白作为对照,在510 nm波长处测吸光度。以芦丁作为标准品绘制标准曲线定量[22]。结果以每100 g干样品中芦丁的质量表示。
1.3.6 可溶性单宁含量的测定
准确称取5.00 g样品,加入25 mL体积分数80%甲醇溶液,均质50 min。4 ℃ 9 500 r/min离心20 min。移取上清液定容,待测。吸取2 mL稀释后的上清液,加入2 mL 1 mol/L福林-酚试剂;5 min后,加入2 mL 0.1 g/mL Na2CO3,室温下静置1 h。用紫外分光光度计在760 nm波长处测定溶液吸光度。以(+)-儿茶素作为标准品绘制标准曲线定量[22]。结果以每100 g干样品中(+)-儿茶素的质量表示。
1.3.7 超滤样品的制备
提取液(原液)的制备同1.3.4节。前期预实验证明超滤次数为3 次可将不同分子质量的样品完全分离。提取液经0.45 μm滤膜过滤后,取5 mL于截留分子质量为10 kDa的超滤管中,于8 500 r/min离心20 min后,将超滤管上层的滞留物(即分子质量大于10 kDa样品)用80%(体积分数,下同)甲醇溶液洗出,定容至5 mL。重复上述步骤3 次后,用80%甲醇溶液将超滤膜上的滞留物洗出,定容至5 mL,即为重均分子质量(MW,以下简称分子质量)大于10 kDa的样品。将3 次超滤的滤液(分子质量小于10 kDa)合并,定容至15 mL,继续分离。取5 mL滤液于截留分子质量为3 kDa的超滤膜上,同样的操作超滤3 次,最后将超滤管上层的滞留物用80%甲醇溶液洗出,定容至5 mL,即为分子质量大于3 kDa且小于10 kDa的样品;将3 次超滤的滤液合并,定容至15 mL,即为分子质量小于3 kDa的样品。对这3 种分子质量样品的总酚含量、缩合单宁含量及抗氧化活性进行测定。
1.3.8 缩合单宁含量的测定
采用香草醛-盐酸法。准确称取5.00 g样品,加入40 mL 80%甲醇溶液,于室温下避光均质50 min。然后在4 ℃下10 000 r/min离心20 min,取上清液定容,待测。取1.0 mL稀释后的待测样品加入5.0 mL 5%盐酸-甲醇溶液和5.0 mL 0.005 g/mL香草醛-甲醇溶液,摇匀,室温避光放置20 min后,以试剂空白作为对照,利用紫外分光光度计在500 nm波长处测吸光度。以儿茶素作为标准品绘制标准曲线定量[24]。结果以每100 g干样品中儿茶素的质量表示。
1.3.9 抗氧化活性的测定
1.3.9.1 ABTS阳离子自由基清除能力的测定
样品液制备同1.3.4节方法。取0.8 mL稀释后的样品液与7.2 mL ABTS溶液混合均匀,静置6 min后于734 nm波长处测定吸光度。配制浓度分别为0、40、80、120、160、200 µmol/L的水溶性VE(Trolox)溶液进行标准曲线的测定,步骤同样品的测定。结果以每100 mg干样品相当于Trolox的物质的量表示[25]。
1.3.9.2 DPPH自由基清除能力的测定
样品液制备同1.3.4节方法。将2 mL稀释过的样品液与4 mL浓度为100 µmol/L的DPPH溶液混匀,暗处静置30 min后,于517 nm波长处测定吸光度。配制浓度分别为0、20、40、60、80、100 µmol/L的Trolox溶液进行标准曲线的测定,步骤同样品的测定。结果以每100 mg干样品相当于Trolox的物质的量表示[26]。
1.3.9.3 铁离子还原能力的测定
样品液制备同1.3.4节方法。将6 mL铁离子还原能力工作液与0.2 mL稀释后的样品液混匀,37 ℃保温30 min后,于593 nm波长处测定吸光度。配制浓度分别为0、100、200、300、400、500、600、700、800 µmol/L的Trolox溶液进行标准曲线的测定,步骤同样品的测定。结果以每100 mg干样品相当于Trolox的物质的量表示[27]。
1.4 数据统计与分析
采用SPSS 22.0软件进行数据的方差分析,用Duncan’s法进行多重比较,采用OriginPro 9.0软件绘图。数据以平均值±标准差表示,P<0.05表示差异显著。每组实验均重复3 次。
2 结果与分析
2.1 柿果脱涩过程中酚类成分含量的变化

图1 柿果脱涩过程中酚类成分含量的变化Fig. 1 Variations in contents of phenolic compounds in persimmon fruit during de-astringency
可溶性单宁是柿果涩味的来源[28]。由图1可知,在脱涩过程中,可溶性单宁的含量显著下降(P<0.05),脱涩44 h后柿果的可溶性单宁含量为7.08 mg/100 g(干样品),相当于0.09 g/100 g(鲜样品),低于文献[29]中给出的可溶性单宁阈值(0.10 g/100 g(鲜样品)),故可考虑在脱涩温度为30 ℃、CO2体积分数为(95±2)%时,以脱涩时间44 h为脱涩终点。其中,可溶性单宁含量的下降速率呈现先上升后下降的趋势:脱涩初期(0~12 h),可溶性单宁含量缓慢下降;脱涩中期(12~20 h)下降速率急剧加快;脱涩后期(20~44 h)下降速率减慢。这可能是由于在脱涩初期,乙醛在无氧呼吸初始阶段开始积累,只有少量可溶性单宁与其反应,故可溶性单宁含量下降速率较慢;而在脱涩中期,积累的乙醛与可溶性单宁开始大量反应,致使可溶性单宁的下降速率加快。CO2浓度、脱涩温度、柿果采收时间都会影响可溶性单宁下降达到阈值以下所需的脱涩时间,而温度越高、CO2浓度越高、柿果初始可溶性单宁含量越低,所需时间越短[5,29]。
在柿果中存在着大量黄酮类化合物的单体及聚合的黄烷-3-醇,如原花青素或缩合单宁[30]。随着脱涩时间的延长,柿果的黄酮含量呈显著下降趋势(P<0.05),与可溶性单宁的变化趋势类似,尤其在脱涩12~20 h期间显著下降(P<0.05)。总酚含量在脱涩过程中也呈显著下降的趋势(P<0.05),其下降速率的变化规律同可溶性单宁、黄酮含量的变化规律一致。
2.2 柿果脱涩过程中理化特性变化

表1 柿果脱涩过程中理化特性变化Table 1 Variations in physicochemical properties of persimmon fruit during de-astringency
柿果的硬度是其是否具有商业价值的重要指标,硬度过小则易软烂、不耐贮运。由表1可看出,柿果经CO2脱涩44 h后,其硬度无显著性变化。这与Chung等的研究结果[17]一致,有利于柿果的运输与后续加工。随着脱涩时间的延长,柿果的pH值、水分含量与水分活度同样变化不显著,而可溶性固形物含量整体呈显著下降趋势(P<0.05),由脱涩前的16.90 °Brix下降至44 h时的15.33 °Brix,这可能是因为脱涩过程中可溶性单宁含量的降低[31]。结果说明,CO2脱涩对柿果硬度、pH值、水分含量与水分活度这些感官品质影响不明显。
2.3 柿果脱涩过程中糖类含量的变化
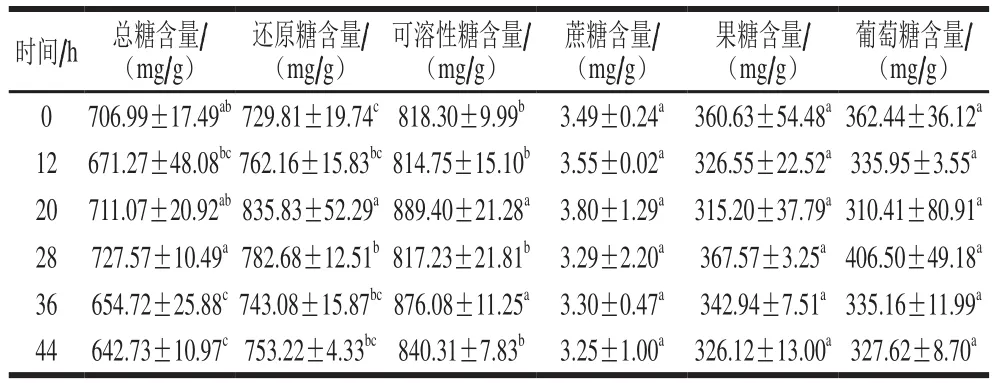
表2 柿果脱涩过程中糖类含量的变化Table 2 Variations in sugar contents of persimmon fruit during de-astringency
文献[32]报道,柿果中主要的糖为葡萄糖、果糖、蔗糖。由表2可以看出,柿果中葡萄糖和果糖的含量较高,蔗糖的含量较少。在脱涩过程中,总糖含量显著下降(P<0.05),由未脱涩时的706.99 mg/g下降至脱涩44 h后的642.73 mg/g,这与Bubba等的结果[5]一致。还原糖含量在脱涩过程中呈先上升后下降趋势。在脱涩0~20 h期间,蔗糖含量上升,同时果糖与葡萄糖的含量下降,可能存在果糖与葡萄糖向蔗糖的少量转化;在脱涩后期(20~44 h),蔗糖、果糖与葡萄糖的含量均呈下降趋势,与总糖含量的变化趋势一致。结果说明,柿果经CO2脱涩处理后由涩味变为甜味并非是由于糖类物质含量的增加,而可能是涩味消失所带来的味觉变化。而Novillo等的研究结果表明,脱涩对柿果糖类成分含量的影响取决于柿果的品种,部分品种的柿果脱涩前后的糖类含量无显著差异,而部分品种柿果的糖类含量在脱涩后下降了50%,总糖的减少可能是因为脱涩过程中可溶性单宁与可溶性糖之间形成了糖苷键[32]。而在本研究中,在脱涩初期可溶性单宁含量显著下降,而糖类含量无明显变化,说明柿果在脱涩过程中可溶性单宁未与或仅有少量与糖类结合,而更可能是可溶性单宁与蛋白质、果胶等大分子结合。综合2.2节与2.3节两部分的结果可知,CO2脱涩处理对柿果感官特性无明显影响,这为柿果的后续加工提供了条件。
2.4 柿果脱涩过程中不同分子质量酚类物质含量的变化

表3 脱涩过程中柿果不同分子质量酚类物质含量的变化Table 3 Variations in contents of phenolics with different molecular masses in persimmon fruit during de-astringency
由表3可知,分子质量大于10 kDa的酚类物质含量约为涩柿中总酚含量的90%,约为2 000 mg/100 g;而分子质量小于3 kDa的酚类物质含量只占涩柿中总酚含量的约10%;分子质量在3~10 kDa之间的酚类物质几乎不存在。随着脱涩时间的延长,柿果中分子质量大于10 kDa的酚类物质含量显著下降(P<0.05),其变化趋势与原液总酚含量(图1A)的变化趋势相一致,在脱涩36 h后,这部分酚类物质的含量几乎下降为0;而分子质量小于3 kDa的酚类物质含量的波动无显著性差异,基本保持在250 mg/100 g左右。
由表3可以看出,脱涩0~12 h时,分子质量大于10 kDa的缩合单宁含量下降了40%(P<0.05),而在脱涩20 h后,这部分缩合单宁含量降为0;分子质量小于3 kDa及分子质量在3~10 kDa之间的样品中均未检测到缩合单宁。结果表明,柿果中的缩合单宁主要以大分子质量(分子质量大于10 kDa)缩合单宁为主,且在脱涩过程中含量下降。推测柿果脱涩过程中总酚含量的显著降低主要是由于缩合单宁含量的下降所引起的;而脱涩对于小分子质量酚类物质的含量无显著性影响。实验结果表明,在CO2脱涩过程中,高浓度的CO2为柿果提供了无氧呼吸环境,无氧呼吸产生的乙醛的醛基与柿果中的高分子质量酚类(缩合单宁)的酚羟基发生缩合或聚合反应,使其逐渐变为无涩味的不可溶物质,随着脱涩时间的延长最终将柿果脱涩;但乙醛未与低分子质量的酚类发生反应,故其保留下来,成为脱涩后柿果中的主要酚类成分。另外,果胶和缩合单宁之间的络合反应也可能降低柿果中单宁的含量,从而起到降低涩味的作用[33-34]。
2.5 柿果脱涩过程中不同分子质量酚类物质抗氧化能力的变化
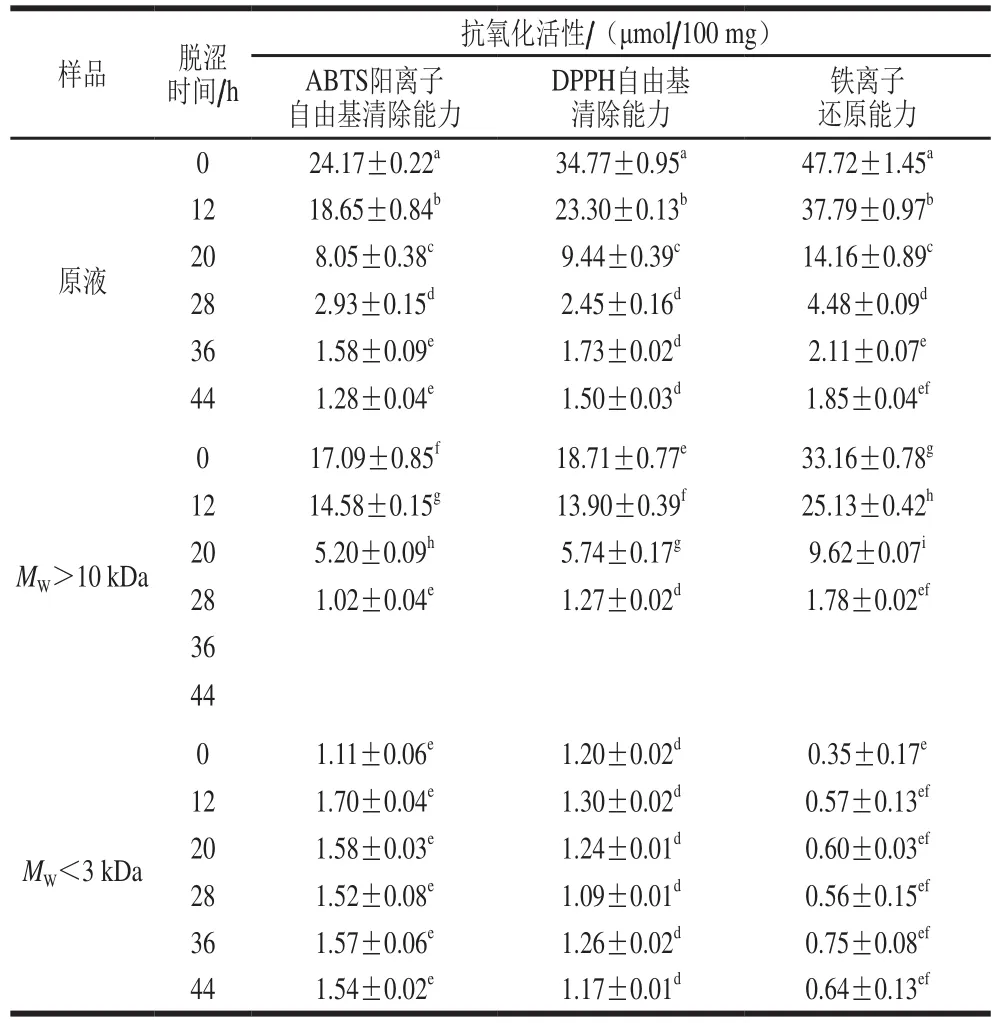
表4 脱涩过程中柿果不同分子质量酚类物质抗氧化能力的变化Table 4 Variations in antioxidant capacities of phenolic compounds with different molecular masses in persimmon fruit during de-astringency
生物活性化合物具有不同的抗氧化活性机制,如氢原子、单电子转移或金属螯合作用[35]。目前还没有一种统一的方法来评价所有机制,因此,本研究使用不同的方法来评价脱涩过程中柿果的抗氧化能力。由表4可以看出,脱涩过程中原液的ABTS阳离子自由基、DPPH自由基清除能力和铁离子还原能力均显著下降(P<0.05),且变化趋势与总酚含量的变化趋势基本一致,其中A BTS阳离子自由基清除能力由24.17 µmol/100 mg下降至1.28 µmol/100 mg;DPPH自由基清除能力由34.77 µmol/100 mg下降至1.50 µmol/100 mg;铁离子还原能力由47.72 µmol/100 mg下降至1.85 µmol/100 mg,脱涩后柿果的这3 种抗氧化能力比脱涩前分别下降了大约95%、96%、96%。分子质量大于10 kDa的酚类物质的抗氧化能力显著下降(P<0.05),并在脱涩36 h后降为0;而分子质量小于3 kDa的酚类物质的抗氧化能力在脱涩过程中无显著性变化。结果说明,脱涩前柿果的抗氧化能力主要来自于高分子质量缩合单宁,而柿果脱涩过程中,由于这部分单宁含量显著下降,故柿果的抗氧化能力明显下降。而小分子质量酚类物质的抗氧化能力在脱涩过程中基本无变化,这部分酚类物质是柿果脱涩后抗氧化能力的主要贡献者。陈湘宁等的研究结果也表明,柿子中含有的单宁等多酚类物质是使柿子具有抗氧化能力的重要因素[36]。脱涩过程使游离态单宁转化为结合态单宁,而结合态单宁是聚合黄烷醇和蛋白、果胶、纤维素等大分子物质的结合物,不可被有机溶剂提取[37]。已有文献报道水果或蔬菜的有机溶剂不可提取部分在酸解后具有较高的抗氧化活性:Matsumura等将柿干利用有机溶剂提取,并将剩余部分进行酸解以比较二者的多酚含量以及抗氧化活性,结果表明,柿果中溶剂不可提取部分酸解后的产物中多酚含量丰富,且其DPPH自由基清除能力为柿果总DPPH自由基清除能力的96.1%,表明柿果结合态单宁部分的水解物在体外具有高的抗氧化活性[38];Pérez-Jiménez等的研究也表明,不溶性高分子抗氧化物质是主要的膳食抗氧化物质,主要包括聚合的酚类物质或与生物大分子相结合的多酚、类胡萝卜素等[39]。因此,脱涩柿果中大量存在的结合态单宁在消化吸收过程中是否能发挥抗氧化功效尚需进一步研究。
3 结 论
柿果经CO2脱涩处理后,其硬度、水分含量、水分活度、pH值、可溶性固形物含量均无明显性变化,这说明CO2脱涩处理不会影响柿果的这些感官特性。经CO2脱涩后柿果中的蔗糖、果糖与葡萄糖含量均下降,与总糖含量的变化趋势一致,这说明柿果在脱涩过程中“由涩变甜”并不是糖类含量增加或糖类合成的过程,而是涩味消失所带来的味觉变化。在脱涩初期,可溶性单宁含量显著下降,糖类含量无显著性变化,说明脱涩过程中可溶性单宁未与或仅有少量与糖类结合,而更可能是与蛋白质、果胶等大分子结合造成其含量降低。脱涩过程中柿果的总酚含量显著下降,其中缩合单宁作为涩柿中主要的酚类物质,其含量在脱涩后期下降为0;而缩合单宁主要由分子质量大于10 kDa的部分组成,其含量下降伴随着柿果抗氧化能力的显著下降;缩合单宁含量下降率超过95%,推测其可能是柿果在脱涩过程中具有抗氧化能力的主要物质。而分子质量较小(小于3 kDa)的酚类物质是脱涩后柿果中主要的酚类物质,也是其抗氧化能力的主要贡献者。CO2脱涩是一种保硬的商业后熟方法,可考虑脱涩条件为温度30 ℃、CO2体积分数(95±2)%,以脱涩时间44 h时为脱涩终点,此时可溶性单宁含量下降至阈值以下,但柿果的品种、成熟期都会影响柿果中可溶性单宁含量,故还需要根据实际情况确定适宜的脱涩条件。综上,涩柿成熟时含有大量的酚类及单宁类物质,使柿果具有很强的抗氧化能力。柿果经脱涩后不会影响其感官特性,但会显著降低柿果的体外抗氧化活性。
