河南驻马店地区猪源肺炎克雷伯氏菌分离菌株生物学特性
2019-07-20高倞
高 倞
(河南省新蔡县动物卫生监督所,河南 新蔡 463500)
肺炎克雷伯氏菌(Klebsiella pneumoniae)可以引起猪、山羊、水貂、貉、牛、梅花鹿等多种动物及人发病,可以引起多种动物及人的败血症、脑膜炎、肺炎、支气管炎、泌尿系统及创伤感染等[1-2]。肺炎克雷伯氏菌是一种广泛分布于自然界中的人兽共共患的条件性致病菌,主要存在多种动物及人的呼吸道、消化道等,当外界条件改变时,机体抵抗力下降,可以引起该病的发生,发病率和死亡率均较高,成为威胁养殖业主要的细菌性传染病之一[3]。相关研究表明了肺炎克雷伯氏菌病出现严重耐药性,且多为多重耐药,并且对β-内酰胺类及碳青霉烯类抗生素产生了广泛的耐药,给该病防治带来了很大的困难[4]。本试验从驻马店地区不同养殖场中采集患呼吸道疾病猪肺脏、鼻拭子等病料组织74份中分离得到了43株肺炎克雷伯氏菌,因此,对分离的43株肺炎克雷伯氏菌进行了致病性、血清型、耐药性等部分生物学特性鉴定。为该地区猪肺炎克雷伯氏菌病的防治提供参考依据。
1 材料
1.1 菌株来源 从驻马店地区不同养殖场中采集患呼吸道疾病猪肺脏、鼻拭子等病料组织74份,进行肺炎克雷伯氏菌的分离鉴定。
1.2 主要试剂 7%绵羊脱纤血培养基、MIAC培养基、普通营养琼脂培养基、营养肉汤,均购自广东环凯微生物科技有限公司;ID32E肠杆科细菌鉴定试纸条,购自法国梅里埃生物科技公司;抗菌药物药敏纸片,购自上海宸功生物技术开发公司;细菌基因组DNA提取试剂盒、DNA DM-2 000marker、2×TaqMaster Mix,购自宝生物工程(大连)有限公司;常规的试剂及仪器均由本所微生物与传染病实验室提供。
1.3 实验动物 体重22±2g左右昆明系小鼠220只,购自北京维通利华实验动物有限公司,饲养于本实验室。
2 方法
2.1 细菌分离培养 从驻马店地区不同养殖场中采集患呼吸道疾病猪肺脏、鼻拭子等病料组织,无菌条件下划线接种于7%绵羊脱纤血培养基,37℃恒温培养12~18 h,挑取优势菌接种于MIAC鉴别培养基上37℃恒温培养12~18 h。挑取单个菌落接种于营养肉汤中进行纯化培养,染色镜检。
2.2 生化特性鉴定 按照ID32E肠道菌鉴定试条说明书,将纯化培养的分离菌株加入ID32E肠道菌鉴定试条中,在37℃培养12 h~24 h,用全自动生化鉴定系统仪进行生化特性鉴定。
2.3 细菌的16S rRNA PCR鉴定 用细菌基因组DNA提取试剂盒提取分离菌株的基因组DNA,以提取的分离菌株的基因组DNA为模板,用细菌的16S rRNA基因序列通用引物 5′-CCGTCTTCAGTTCCAGTGTG-3′/5′-GTGGCGGACGGGTGAGTAA-3′ 对分离菌株进行PCR检测,用1%琼脂糖检测其目的条带后,将分离菌株的目的基因回收后进行测序,测序结果与GenBank中登录的肺炎克雷伯氏菌参考株的基因序列进行同源性比较与分析。
2.4 细菌致病性试验检测 参考文献[5],对分离菌株人工感染小鼠进行致病性试验。采用平板计数法将菌液浓度调整为(108CFU/mL),每株分离菌腹腔注射5只小鼠,剂量为0.3 mL(108CFU/mL),对照组腹腔注射等量的营养肉汤。在攻毒12 h后,观察其每组的小鼠发病及死亡情况,对于死亡的小鼠进行细菌分离与鉴定。
2.5 细菌耐药基因PCR检测 参考文献[6],设计6对肺炎克雷伯氏菌荚膜血清型的引物,由生工生物工程(上海)股份有限公司合成(表1)。PCR体系为20 mL: 2 ×TaqMaster Mix 7 μL,上下游引物各0.5 μL,DNA 2 μL,ddH2O 10 μL。 用梯度 PCR 进行血清型检测,PCR产物送生工生物工程(上海)股份有限公司测序,测序结果与GenBank中登录的肺炎克雷伯氏菌参考株的基因序列进行同源性比较与分析。
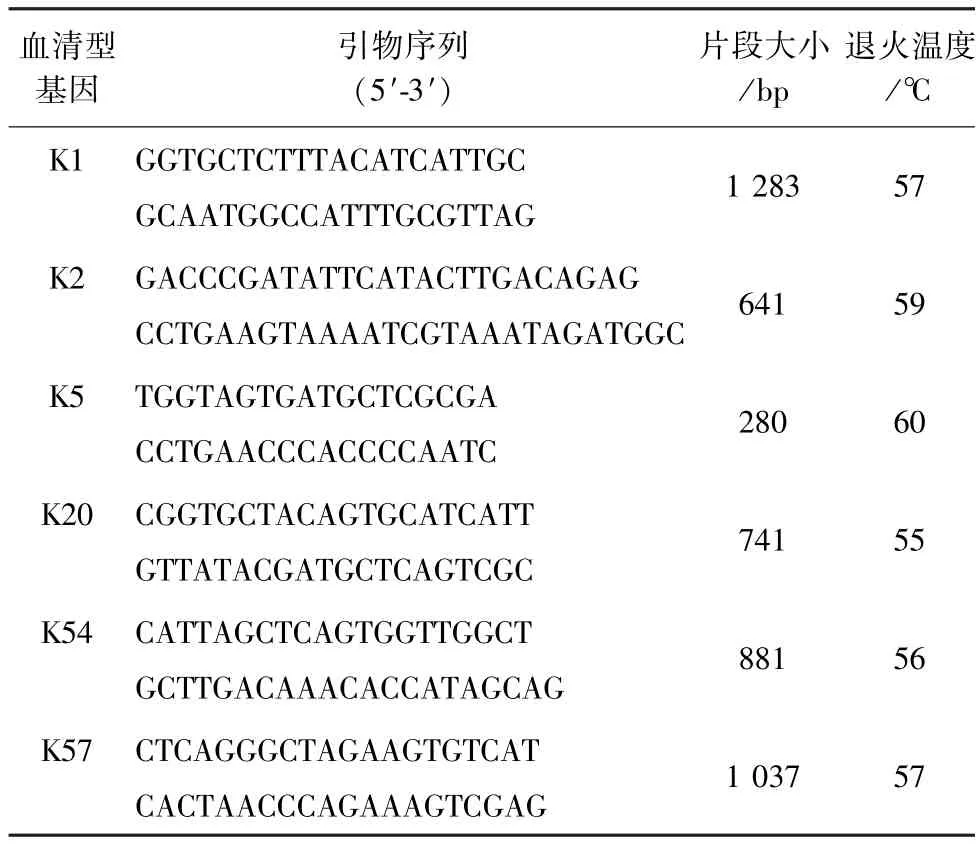
表1 引物序列
2.6 药敏试验 用美国临床检验标准委员会(NCCLS)推荐的标准K-B纸片法对分离的致病性病原菌进行药敏试验,参照CLSI的标准判断耐药(R)、敏感(S)或中介(I)进行结果判断,分析其耐药性。
3 结果
3.1 细菌分离培养结果 疑似肺炎克雷伯氏菌分离菌株在7%脱纤绵羊血培养基上长出圆形、扁平、明灰白色的半透明菌落,个别出现溶血现象;在MIAC培养基上为圆形、光滑、桃红色菌落;染色镜检分离菌株为两端钝圆粗短杆菌状的阴性菌。
3.2 生化鉴定结果 分离菌株均鸟氨酸脱羧酶、接触酶、尿素酶为阴性;甲基红试验、V-P试验均呈阳性;不发酵 D-麦芽糖、D-葡萄糖、L-阿拉伯糖、D-甘露醇、D-山梨醇、L-鼠李糖;分离菌株用全自动化微生物生化仪鉴定为肺炎克雷伯氏菌,评定结果合格率为98.9%~99.9%之间。经统计采集的74份病料中分离得到43株分离菌为肺炎克雷伯氏菌。
3.3 细菌的PCR鉴定结果 43株分离菌株均扩增出大约为1 500 bp左右的目的基因条带,与预期的一致(图1)。分离菌株的测序结果后与GenBank中登录的肺炎克雷伯氏菌参考株的基因序列同源性在97.9%~100.0%之间。证实了43株分离菌株为肺炎克雷伯氏菌。
3.4 细菌致病性试验检测结果 攻毒组的小鼠在攻毒后的2~6 d,出现不同程度的发病与死亡,从死亡的小鼠体内分离到了肺炎克雷伯氏菌,对照组小鼠无明显的症状及死亡。致病性试验结果表明,30株肺炎克雷伯氏菌分离株对小鼠具有致病性,为致病性肺炎克雷伯氏菌,占分离菌株的69.8%(30/43)。
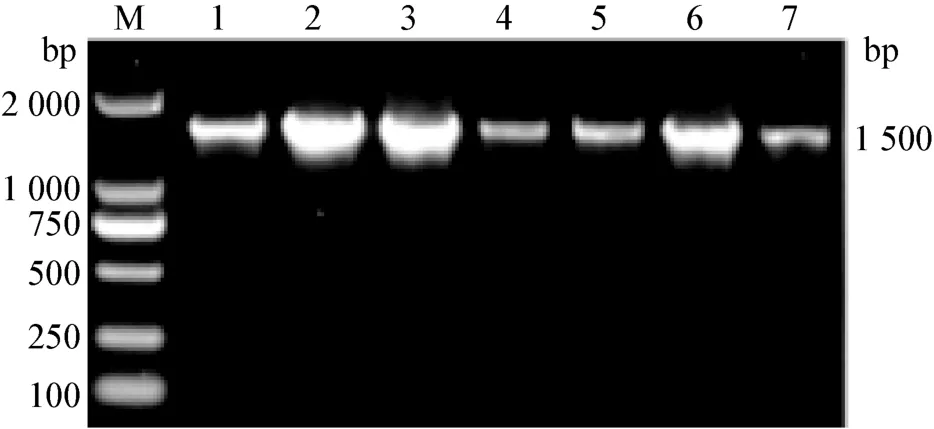
图1 分离菌株16S rRNA PCR结果
3.5 细菌血清型鉴定结果 由表2可知,分离的43株肺炎克雷伯氏菌属于6种血清型,定型的40株,占分离菌株的93.0%,3株检测出血清型。其中K20和K5为该地区肺炎克雷伯氏菌流行的主要血清型,分别占分离菌株的37.2%、27.9%。40株肺炎克雷伯氏菌血清型PCR产物测序结果与与Gen-Bank中登录的肺炎克雷伯氏菌参考株的血清型的基因序列同源性在98.9%~99.9%之间。

表2 分离菌株血清型鉴定结果
3.6 细菌耐药性分析结果 药敏试验由见表3可知,分离菌株对43株肺炎克雷伯氏菌分离菌株对氨苄西林、阿莫西林、大观霉素、多西环素、磺胺间甲氧嘧啶、阿米卡星、氟苯尼考7种药物耐药率较高,耐药率在51.2% ~100%之间;对头孢曲松、头孢噻呋、恩诺沙星、环丙沙星、多黏菌素4种药物的耐药率在18.6%~234.9%之间。
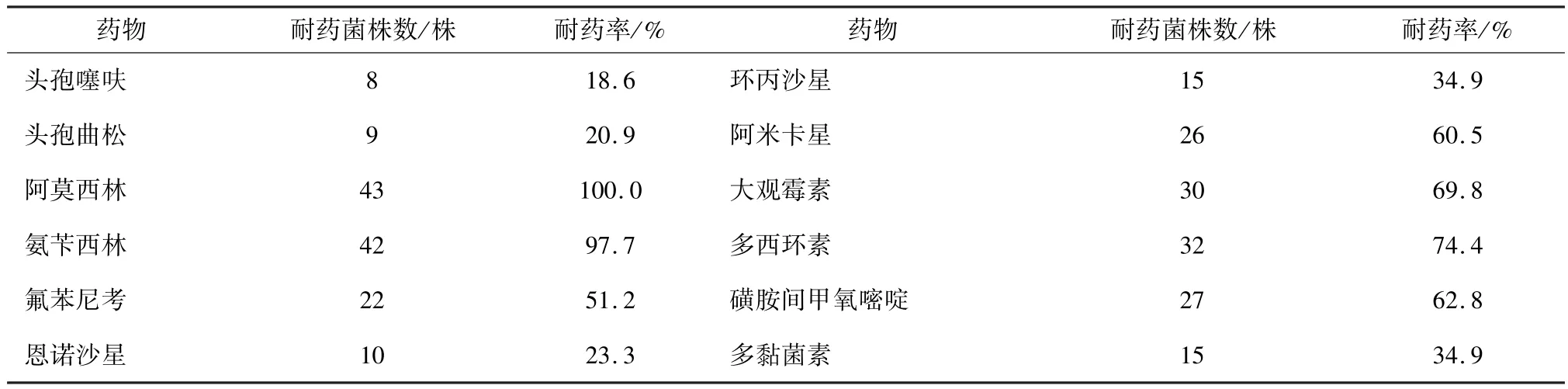
表3 分离菌株药敏试验结果
由见表4可知,43株肺炎克雷伯氏菌分离菌株呈现多种耐药性,耐12种药物的有3株、耐11种药物有5株、耐10种药物有11株、耐12种药物有12株、耐8种药物有6株,耐7种药物有4株,耐6种药物有2株,其中耐10、9种药物分离菌株最多,分别占分离菌株的25.6%、27.9%。

表4 多重耐药性结果
4 讨论
肺炎克雷伯氏菌属中主要包括3个亚种,分别为肺炎克雷伯氏肺炎亚种、臭鼻亚种及鼻硬结亚种,3个亚种中肺炎克雷伯氏肺炎亚种分布最为广泛,是引发多种动物发病的主要的病原菌之一[2-5]。相关研究表明了在临床中的感染仅次于大肠杆菌和绿脓杆菌,呈世界性分布,该菌当外界环境改变时,该菌可以导致动物体抵抗力下降,引起动物感染发病,严重者可以造成败血症,个别的呈现急性死亡。本试验从驻马店地区不同养殖场中采集患呼吸道疾病猪肺脏、鼻拭子等病料组织74份中分离得到了43株肺炎克雷伯氏菌,对分离的43株肺炎克雷伯氏菌进行了致病性、血清型、耐药性等部分生物学特性鉴定。通过人工感染小鼠致病性结果显示,分离的43株肺炎克雷伯氏菌中30株为致病性肺炎克雷伯氏菌,占分离菌株69.8%(30/43)。说明了该地区猪肺炎克雷伯氏菌感染严重且有一定致病性,且在该地区广泛流行,在猪的养殖过程中应引起重视。
本试验研究表明了分离的43株肺炎克雷伯氏菌属于6种血清型,定型的40株,占分离菌株的93.0%,3株检测出血清型。其中K20和K5为该地区肺炎克雷伯氏菌流行的主要血清型。与王建莉[6]报道存在一定差异性,可能与感染宿主不同或者与该菌流行的地域有关,国内关于猪源肺炎克雷伯氏菌血清型调查未见报道。
相关研究表明,肺炎克雷伯氏菌对药物耐药性的产生与扩散,多重耐药菌株出现的越来越多,降低了治疗效果[7]。本试验研究表明,43株分离菌株对氨苄西林、阿莫西林、大观霉素等7种药物耐药性较高,耐药率在51.2%以上,对其他药物的耐药率在18.6% ~234.9%之间,且呈现多重耐药性,耐10、9种药物分离菌株最多,分别占分离菌株的25.6%、27.9%。从而证实了该菌猪源肺炎克雷伯氏菌对常用抗菌药物产生很强的耐药性,呈现了多重耐药性。因此,在养殖过程中应该引起重视。冯娜等[5]、王羽等[5]、韩坤等[8]、刘海林[9]等报道的与本试验研究存在一定的差异性,可能与感染的宿主或者地域有关。本试验为该地区猪源肺炎克雷伯氏杆菌的防治提供理论基础。
