规模化猪场脐带血猪瘟病原检测及遗传变异分析
2019-07-20戴爱玲刘建奎王德永魏春华林日丹杨小燕
戴爱玲,刘建奎,王德永,魏春华,林日丹,杨小燕
(1.龙岩学院生命科学学院,福建 龙岩 364000;2.福建省生猪疫病防控工程技术研究中心,福建 龙岩 364000)
猪瘟(Classic Swine Fever,CSF)是由猪瘟病毒(Classic Swine Fever virus,CSFV)引起的一种高度接触传染病,发病率高,死亡率高,严重威胁着养猪业发展[1-3]]。世界动物卫生组织(OIE)将其列为A类传染病,我国定为Ⅰ类烈性传染病。我国自20世纪50年代成功研制猪瘟兔化弱毒疫苗(C株或HCLV)以来,猪瘟的流行得到有效控制,但是在长期免疫压力下,猪瘟病毒出现一定程度变异,临床表现日趋复杂[2],温和型和非典型猪瘟的广泛流行给猪瘟的临床诊断与防控提出挑战,因此及早检测被感染猪群,对于猪瘟的防控具有重要的意义。脐带血是母猪分娩后,仔猪断脐时残留在脐带中的血液,由于猪胎盘特性,绝大部分免疫球蛋白都无法通过胎盘屏障,但某些疫病能通过胎盘屏障感染仔猪。因此,脐带血检测对猪疫病早期预警及防控具有较高临床应用价值[4][。
猪瘟病毒囊膜糖蛋白E2是病毒识别和吸附宿主细胞的病毒结构蛋白,在CSFV增殖过程中具有重要作用,同时E2蛋白能够诱导机体产生中和抗体,E2结构蛋白抗原变异与免疫逃逸有关,是导致猪场CSFV持续感染的主要原因之一[5]。福建省某存栏母猪550头的规模化猪场,母猪猪瘟疫苗采取一年普免3次的免疫方式,ST传代细胞活疫苗2.5头份/头。该猪场哺乳仔猪出现个别弱仔、拉稀现象,发病仔猪经实验室检测为猪瘟病原阳性。为了明确哺乳仔猪的发病是否与CSFV经胎盘垂直感染有关,本试验连续收集分娩母猪的脐带血,应用荧光定量PCR检测脐带血CSFV,RT-PCR方法对阳性样品进行扩增、克隆以及CSFV E2基因测序,分析猪瘟病原遗传变异情况。
1 材料与方法
1.1 样品来源 脐带血收集于福建省某存栏母猪550头的规模化猪场,每头分娩母猪至少采集5头以上初生且未吃初乳的仔猪,每头仔猪采集2 mL,混合后-20℃保存,标明采集日期和对应母猪的耳号,共计采集117份脐带血。
1.2 主要试剂 M-MuL反转录酶、RAN酶抑制剂、Taq DNA聚合酶,购自宝生物工程(大连)有限公司;RNA提取试剂盒百泰克生物技术北京有限公司;凝胶回收试剂盒,购自天根生化科技(北京)有限公司;猪瘟病毒荧光定量PCR检测试剂盒,购自北京尚仪有限公司。
1.3 引物设计与合成 参考文献[6]设计合成1对特异性引物用于CSFV E2基因的扩增,扩增片段大小约为272 bp,引物由生工生物工程(上海)股份有限公司合成(表1)。
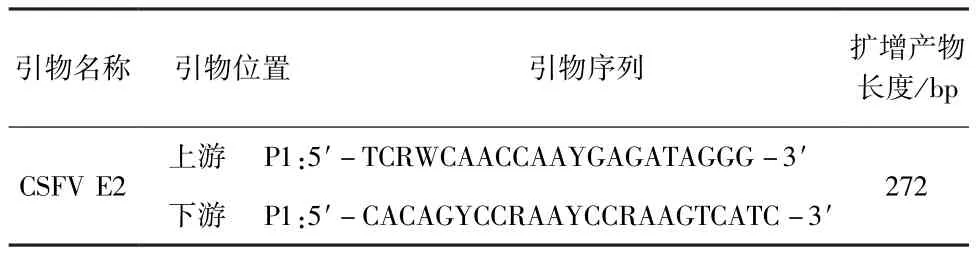
表1 CSFV E2基因引物序列
1.4 荧光定量PCR检测 取250 μL脐带血,按照RAN提取试剂盒方法提取病毒基因组RNA,参照猪瘟荧光定量RT-PCR试剂盒说明书进行荧光PCR检测。
1.5 RT-PCR鉴定 通过RT-PCR方法对荧光定量RT-PCR检测为阳性的样品进行CSFV E2基因扩增。应用反转录M-MμL酶将提取的RNA反转录为cDNA。以cDNA为模板进行RT-PCR扩增。PCR 的反应体系 25μL:10 × Buffer 2.5 μL,dNTP(2.5 mmol/L)2 μL。 模板 cDNA 2 μL,上下引物各1 μL(10 pmol/mL),Taq酶(5u/μL)0.2 μL,用DEPC水补齐25 μL。PCR扩增程序:96℃ 3 min;95℃ 45 s,56.2℃ 45 s,72℃ 45 s,35个循环;72℃ 10 min,用1%琼脂糖凝胶电泳检测。
1.6 目的基因克隆与序列分析 目的片段经胶回收后连接到pMD19-T载体上,将鉴定均为阳性的重组菌株送往北京睿博兴科生物技术有限公司测序。采用DNAStar软件对CSFV E2基因进行核苷酸序列和氨基酸序列同源性比对及分析,同时绘制出遗传系统发生树。本研究所用的国内外参考毒株见表2。

表2 CSFV E2基因参考株
2 结果
2.1 荧光定量PCR检测结果 采用荧光定量RTPCR方法对117份脐带血进行检测,结果表明,CSFV感染率为7.69%(9/117),部分荧光定量PCR结果如图1所示。

图1 部分样品CSFV E2基因荧光定量PCR结果
2.2 RT-PCR检测结果 应用RT-PCR对9份阳性样品进行CSFV E2扩增,产物经1%琼脂糖凝胶电泳鉴定,均在约270 bp处出现扩增条带,大小与预期结果相符(图2)。

图2 CSFV E2基因片段的RT-PCR扩增结果
2.3 目的基因序列测定及分析
2.3.1 核苷酸序列同源性分析 将5株CSFV E2基因(编号 1 ~ 5,样品号:2253、3137、2639、3573、3733)与20株CSFV参考毒株(表2)核苷酸序列进行比对,结果表明,5株CSFV E2基因之间的同源性为97.8%~100%,与参考株之间的同源性为80.0% ~97.5%,与94.4-IL-94-TWN株同源性最低为80.0%,与C株和HCLV株的同源性分别为95.6% ~96.7%、96.4% ~97.5%,与 Shimen株的同源性为92.7%~94.5%。
2.3.2 氨基酸同源性序列分析 将5株CSFV E2基因(编号1~5)推导的氨基酸序列与20株CSFV参考毒株(表2)序列进行比对。结果显示,5株毒株E2基因之间的氨基酸同源性为97.8%~100%,与参考株之间同源性为83.5% ~96.7%,与C株和HCLV株同源性为95.5% ~96.7%,与经典强毒株Shimen株的同源性为94.4% ~95.6%,与P97株基因型为3.4同源性最低为83.5%。
2.4 遗传进化树分析 为了进一步研究5株CSFV遗传特征,利用DNAStar软件对CSFV E2基因进行了比对和分析。结果表明,5个毒株均处于1.1亚群,与C株和HCLV株亲缘关系最近(图5)。
2.5 氨基酸序列分析 对5株CSFV E2基因推导的氨基酸位点和疫苗HCLV株E2基因氨基酸位点进行比对分析,结果显示,与HCLV相比,5株CSFV E2基因推导的氨基酸序列均存在D5→N、R88→G88和S89→F89的突变。此外,3137株在存在S3→T3的变异,3573株存在在15位点氨基酸T15→I15的变异,这些氨基酸位点变异可能导致分离株抗原发生变化(图6)。

图3 CSFV E2基因的核苷酸同源性分析

图4 CSFV E2基因的氨基酸同源性分析
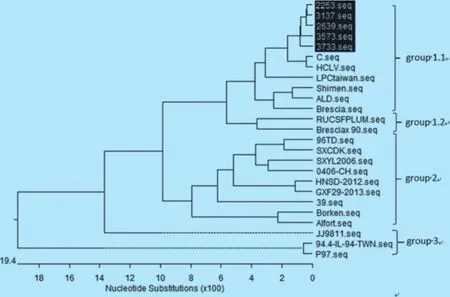
图5 CSFV E2基因核苷酸的遗传进化树

图6 5株CSFV E2基因与疫苗株HCLV E2基因推导氨基酸序列比对
3 讨论
猪瘟病毒在世界范围广泛流行,给养猪业造成巨大的经济损失。猪瘟病毒只有一个血清型,但是不同毒株之间的毒力差异较大,导致其流行形式发生变化,现临床上以温和型和非典型猪瘟为主,猪瘟带毒猪无明显临床症状,带毒妊娠母猪不仅造成繁殖障碍还会垂直感染仔猪,同时持续排毒的特点影响整个猪群的健康,所以对妊娠母猪猪瘟病原监测与病原特性分析对猪瘟防控显得尤为重要。已有应用脐带血检测技术在防控产房仔猪腹泻[4]、评估生产母猪重要病原感染状况的报道[7]。脐带血与血样和组织样品比较,获取方便、不会对猪群产生应激更具优势。因此,采用脐带血进行病原检测具有更好的临床应用价值。
本试验应用荧光定量PCR对117份脐带血进行检测,猪瘟病原阳性率为7.69%。根据9份阳性样品编号对应的母猪进行临床追溯调查,结果9头母猪中有6胎次及以上的母猪占55.6%(5/9)5头,3胎以下比例33.3%(3/9),平均产仔数8.3头,活仔率84.8%,窝产仔数低于7头的母猪有3头,早产母猪2头。表明该场脐带血猪瘟病原阳性的母猪生产性能较差,低于猪场母猪平均生产性能(平均总产仔为10.6头,平均活仔猪数为9.9头,总仔活率为93.5%)。由此可见,母猪猪瘟病毒带毒是引起母猪生产性能较低的主要因素之一。
CSFV E2基因是公认遗传分型靶标段,也是抗原变异核心区域,从分子水平对CSFV流行毒株进行遗传分型可以追踪病毒的来源[8]。研究表明,对CSFV E2基因进行核苷酸序列及遗传进化分析能在一定程度上能够揭示病毒变异情况。通过对5株CSFV E2基因扩增、克隆、测序,并与国内外毒株进行基因序列比较,5株CSFV E2基因之间核苷酸同源性均为97.8% ~100%,与C株和HCLV株同源性分别为95.6% ~96.7%、96.4% ~97.5%,与Shimen株的同源性为92.7% ~94.5%;氨基酸同源分析表明,5株CSFV E2基因推导的氨基酸之间同源性为97.8% ~100%,但是与疫苗株HCLV同源性为95.5%~96.7%,氨基酸变异位点分析表明其基因序列发生了较小程度的变异,与疫苗株HCLV相比较,均在 aa 5(D→N)、aa 88(R→G)、aa 89(S→F)位点发生突变,其中3 137株第3位氨基酸S突变成T,3573株在15位点氨基酸T变成I。遗传进化树表明,分离毒株与C株和疫苗株HCLV亲缘关系较近,且都处于1.1亚群。王琴等[9-10]通过对我国1985-2011年猪瘟病毒分子流行病学调查表明,我国猪瘟病毒具有遗传多样性,大部分地区流行的猪瘟病毒依然是基因2.1亚群和1.1亚群为主。本课题组对福建地区2013-2014年31株猪瘟病毒E2基因分型表明,福建地区以基因2.1亚群和1.1亚群为主,处于1.1亚群的23分离株与HCLV株亲缘关系较近[11]。2014-2015年李栋梁报道了河南省1株1.1亚群的CSFV E2与HCLV株亲缘关系较近[12]。SHEN等在研究中国华南地区猪瘟病毒E2基因时,与经典毒株(HCLV)比较,发现了4个氨基酸位点突变,表明处于1.1亚群且与HCLV株亲缘关系较近的毒株可能是弱毒株[13-14]。
综上所述,该猪场通过胎盘屏障感染仔猪的猪瘟病毒可能来源于疫苗株,这种现象应该引起重视。
