猪繁殖与呼吸综合征病毒接触感染仔猪模型的建立
2019-07-20夏文龙郭长明朱善元张鑫宇夏晓莉孙怀昌
夏文龙,吴 植,郭长明,朱善元,张鑫宇,夏晓莉,孙怀昌
(1.扬州大学兽医学院 江苏省重要动物疫病与人兽共患病协同创新中心,江苏 扬州 225009;2.江苏农牧科技职业学院 江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300)
猪繁殖与呼吸综合征(PRRS)是猪的一种高度接触性传染病,以母猪繁殖障碍、仔猪死亡率升高及各年龄猪呼吸道症状为主要特征。该病于1995年传入我国[2],现已成为现代化养猪场最重要的传染病,给我国养猪业带来了巨大的经济损失。猪繁殖与呼吸综合征病毒(PRRSV)是动脉炎病毒科成员,主要感染猪的单核-巨噬细胞系统,导致严重的免疫抑制[2]。另外,PRRSV具有毒株多、变异快等特点,也是难以净化和根除的主要原因。
PRRSV感染模型对其致病机制研究和疫苗评价具有重要意义。PRRSV传播方式包括直接接触和间接接触,其中直接接触感染性分泌液是最有效的传播方式[3]。然而,先前的PRRSV试验感染多用肌肉注射或滴鼻方式进行[4-5],感染途径不同于PRRSV的自然感染,另外,试验猪多饲养于普通环境中,对其疾病表现影响较大。本研究先以肌肉注射加滴鼻接种方法获得人工感染仔猪,然后将其与易感仔猪在隔离器内进行同居饲养,对接触感染猪的体温、临床症状、病毒血症、粪便排毒、器官病毒载量以及剖检和显微病变进行系统的检测分析,旨在建立PRRSV接触感染仔猪模型。
1 材料与方法
1.1 主要试剂 AxyPrep质粒DNA小提试剂盒和DNA凝胶回收试剂盒,购自 AXYGEN公司;DL-1 000 DNA Marker、rTaqDNA 聚合酶、pMD-18T 载体、MiniBEST Viral RNA/DNA Extraction Kit、Prime-Script RT Master Mix、SYBR PremixEx TaqII,购自TaKaRa公司;PRRSV ELISA检测试剂盒,购自IDEXX公司。
1.2 病毒、细胞和试验动物 猪圆环病毒2型(PCV2)、猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、高致病性猪繁殖与呼吸综合征病毒(HR-PRRSV)JXA1毒株均由本实验室保存;Marc-145细胞由本实验室保存;28日龄杜×长×大三元杂交断奶仔猪,购自江苏如东某PRRS非免疫猪场。
1.3 试验猪常见病原及PRRSV抗体检测 将7头28日龄断奶仔猪于负压隔离器中饲养3~5 d,观察健康状况良好,前腔静脉采集血液分离血清,用病毒RNA/DNA提取试剂盒提取病毒核酸,参考文献[6]设计合成 PCV2、PPV、PRV、CSFV 和 PRRSV 特异引物(表1),通过PCR/RT-PCR检测上述病原,采用ELISA试剂盒检测PRRSV特异抗体。
1.4 试验分组 将6头仔猪随机分为2组,第1组为接触感染组,将3头易感仔猪与1头PRRSV试验感染仔猪(肌肉注射+滴鼻接种105TCID50JXA1株PRRSV)于同一隔离器同居饲养;第2组为对照组,将3头仔猪于另一隔离器中饲养。
1.5 试验猪的临床观察及样品采集 同居饲养后每天定时测量记录直肠温度1次,每天观察临床症状3次并根据表2临床症状评分标准[7]进行评分;在感染后第 1、3、5、7、10、13 天,前腔静脉采集血液5 mL进行血清分离,采集的粪便样品(1 g/头)用10 mL PBS重悬,5 000 r/min离心10 min取上清用于病毒检测;两周后,对死亡和试验结束迫杀猪进行剖检,观察各组织器官大体病变并剪取小块肺脏组织制备病理切片;采集心、肝、脾、肺、肾、淋巴结,所有样品于-80℃冰箱冻存。

表1 试验猪病毒检测的PCR引物

表2 临床症状评分标准
1.6 临床样品的荧光定量RT-PCR检测 不同时间采集的猪血清和粪便悬液离心上清各取200 μL,每头猪的组织器官各取50 mg,利用试剂盒分别提取上述样品病毒RNA并进行反转录,参考本课题组已建立的荧光定量RT-PCR方法[6],检测PRRSV基因组RNA拷贝数,PCR反应程序为:95℃ 30 s;95℃ 5 s,60℃ 31 s,共40个循环,延伸结束收集荧光信号。
2 结果
2.1 试验猪常见病原及PRRSV抗体检测 采集各试验仔猪血清样品,利用PCR/RT-PCR检测常见猪病病毒,结果显示:作为阳性对照的 PCV2、PPV、PRV、CSFV、PRRSV均可扩增出预期大小的基因片段,而7头试验猪的血清样品均为检测阴性(图1);ELISA试剂盒检测结果显示,7头试验猪均为PRRSV抗体检测阴性,这些结果表明该仔猪可以用于PRRSV感染试验。

图1 试验仔猪的病毒检测
2.2 试验猪体温和死亡观察 在为期两周的试验过程中,每日监测各仔猪体温,结果显示(图2):未接种对照组的3头仔猪体温正常;肌肉注射+滴鼻接种JXA1株PRRSV的1头仔猪第2天体温升高至40.8℃,第5天升高至41.0℃并持续高热至第11天死亡。在接触感染后,第4天3头仔猪平均体温达40.6℃,第6天高于41.0℃并持续高热,分别于第12、13天死亡。表明和带病猪同居接触2天后,健康仔猪即可出现高热并且持续致死,死亡时间较人工攻毒猪推迟1~2天。
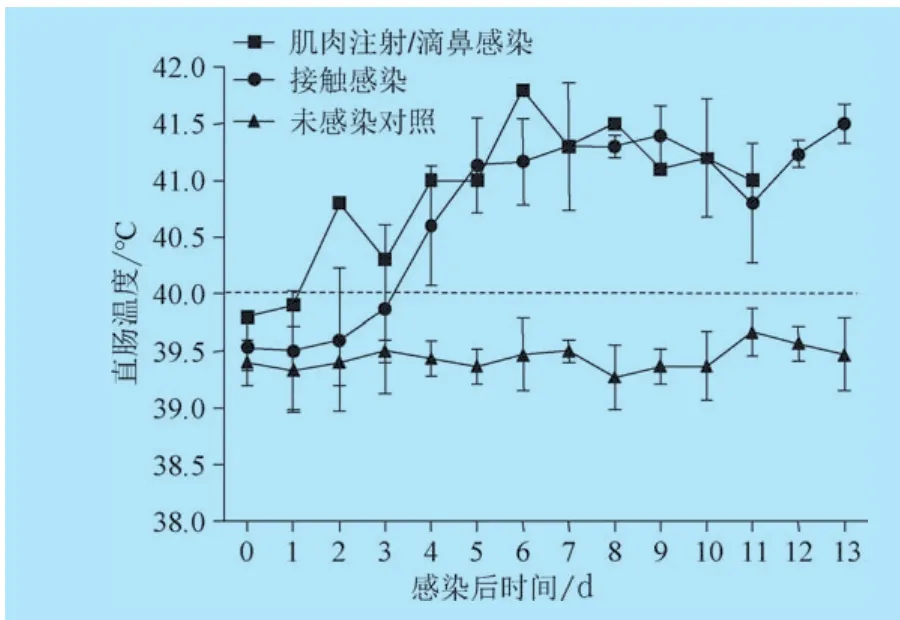
图2 试验仔猪的体温监测
2.3 试验猪临床症状评分 试验期间每日观察各仔猪临床症状并进行评分,结果显示(图3):空白对照组所有仔猪未出现明显临床症状;人工接种病毒的仔猪第2~5天表现出精神沉郁、食欲下降等轻微症状(共计3~6分),第6天开始出现喘气、咳嗽、呼吸困难、眼睑水肿、腹泻等PRRSV典型症状,持续直至死亡(共计14~16分);接触感染的3头仔猪第5~6天表现出轻微症状(共计4~5分),第7天开始临床症状明显严重直至死亡(共计14~16分)。表明JXA1株PRRSV能够通过同居接触感染健康仔猪并引起典型且一致的PRRS临床症状,潜伏期为3天左右。

图3 试验仔猪临床症状评分
2.4 试验猪病毒血症检测 定期采集试验仔猪血液并分离血清,用荧光定量RT-PCR进行病毒血症检测,结果显示(图4),空白对照组仔猪血清检测结果均为阴性;人工攻毒后24 h仔猪血清即为PRRSV检测阳性,第1~5天病毒血症逐渐上升(105.6~8.4拷贝/mL),此后稳定在较高水平(108.7拷贝/mL)直至死亡;接触感染仔猪在第3天检出PRRSV,第3~10天血清中PRRSV含量呈上升趋势(103.4-8.6拷贝/mL),并维持较高含量(108.7拷贝/mL)至死亡。表明健康仔猪与人工攻毒猪同居接触2 d左右即感染JXA1株PRRSV,并且二者的病毒血症发展趋势及PRRSV含量高峰值相似。

图4 PRRSV感染猪的病毒血症定量RT-PCR检测
2.5 试验猪粪便排毒检测 定期采集试验仔猪粪样,荧光定量RT-PCR检测结果显示(图5),空白对照组仔猪粪便检测结果均为阴性;人工接种仔猪第3天粪便为PRRSV检测阳性,第3~7天病毒含量逐渐升高(103.3~4.4拷贝/0.1 g),随后维持较高水平(104.5拷贝/0.1 g)至死亡;接触感染仔猪于第5天首次检出病毒,第5~7天PRRSV含量呈上升趋势(101.8~4.0拷贝/0.1 g),此后粪便排毒量稳定在较高水平(103.9~4.2拷贝/0.1 g)至死亡。表明仔猪接触感染PRRSV后,能够通过粪便持续排毒,并且排毒趋势及最高排毒量和人工攻毒猪相似。

图5 PRRSV感染猪的粪便排毒定量RT-PCR检测
2.6 试验猪病理变化观察 试验期间仔猪死亡后立即进行剖检,结果显示,死于人工接种和同居接触感染仔猪的病变明显且相似,腹股沟及肠系膜淋巴结明显红肿、出血,肾脏表面可见大小不一出血点(未列出),肺脏作为PRRSV主要侵害器官,表现为严重实变、红肿、出血,进一步对其进行病理切片观察,结果显示(见封二彩版图6),死于人工接种和同居接触感染仔猪均呈现典型间质性肺炎,肺泡壁增厚,淋巴细胞浸润;空白对照组仔猪扑杀后各器官无明显病变
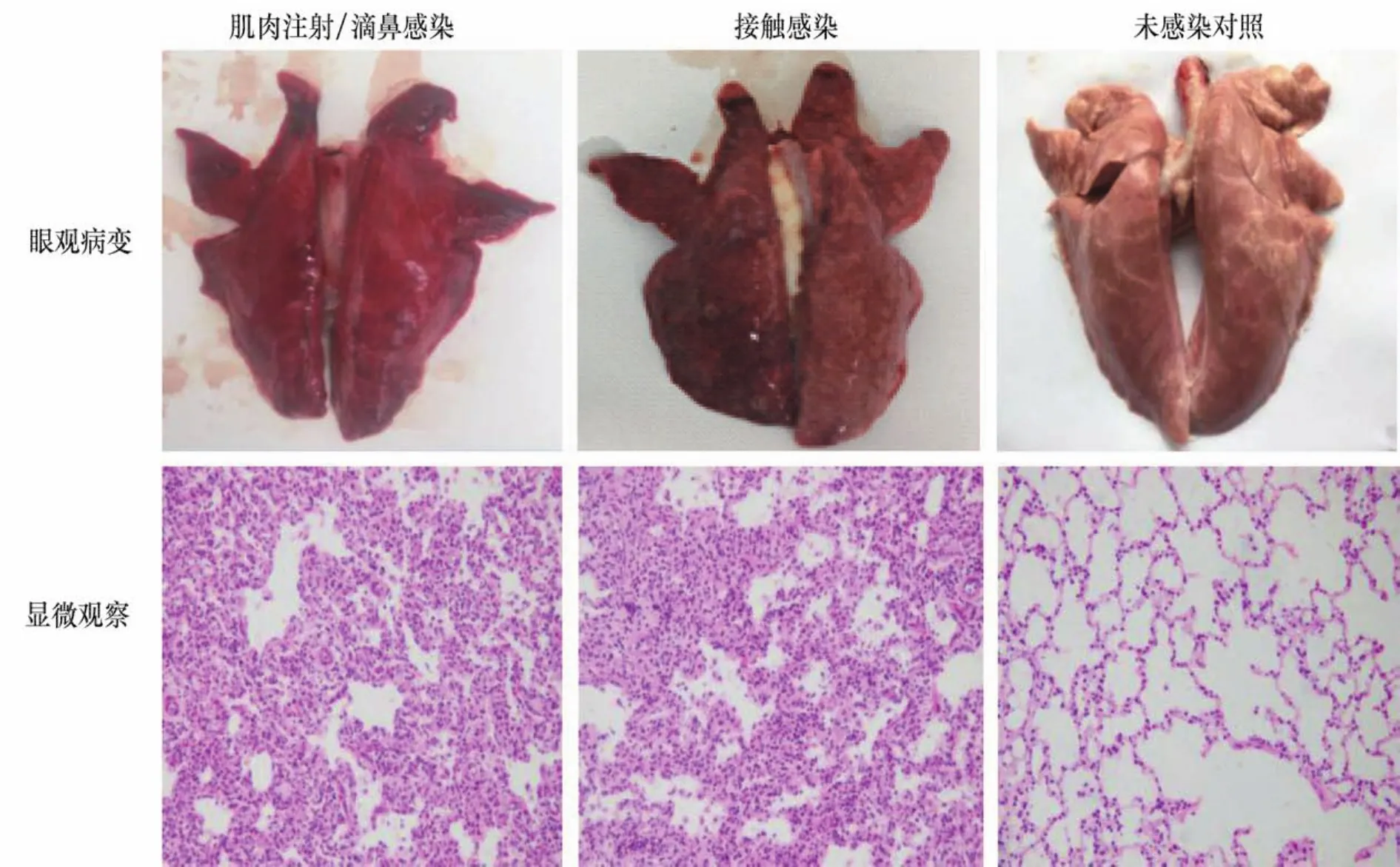
图6 试验猪肺脏病理变化观察
2.7 组织器官病毒载量检测 用荧光定量RTPCR对病死或试验结束后迫杀猪的主要组织器官进行PRRSV基因拷贝数检测,结果显示(图7),空白对照组所有仔猪相应组织器官均为PRRSV检测阴性;人工攻毒和接触感染猪主要器官均含大量病毒,其中肺脏含量最高,分别为107.5和106.9~7.7拷贝/mg。表明JXA1株PRRSV能够通过同居接触感染健康仔猪并在猪体内大量复制,而且死亡猪各器官病毒载量及分布和人工攻毒猪无明显差异。

图7 PRRSV感染猪组织器官病毒载量检测
3 讨论
仔猪对PRRSV的易感性与病毒毒力、宿主免疫状态和环境因素密切相关[6]。尽管PRRSV具有高度的接触传染性,但接触感染的实验研究尚无报道。先前的PRSSV人工感染多通过肌肉注射或滴鼻方式进行,不仅不能真实反映PRRSV的自然感染,而且成功率较低[8]。本研究先用人工接种法获得PRRSV感染仔猪,然后立即将其与易感仔猪进行同居饲养,旨在模拟PRRSV自然感染。临床观察结果显示,人工接种和接触感染仔猪不仅出现典型、一致的PRRS症状,而且都于感染后两周内死亡。本研究复制PRRS成功率高的可能原因主要有:一是使用的JXA1株不仅是高致病性PRRSV毒株,而且试验前经过3次易感猪传代复壮,所以其毒力较强;二是试验猪为PRRSV及其抗体检测双阴性,提示其易感性较高;三是试验猪在负压隔离器中饲养,受环境因素干扰较小。
临床观察结果显示,人工接种仔猪于第2天出现体温升高和临床症状,而接触感染仔猪于第4天体温开始升高,第5天出现PRRS典型症状,提示强毒株PRRSV自然感染的潜伏期为2~3 d。与人工接种猪相比,尽管接触感染猪的临床症状和病毒血症出现时间有所延迟,但体温升高程度、临床症状打分、病毒血症水平和病理变化无明显差异,表明同居接触感染更能反映PRRSV的自然感染。
目前对于PRRSV能否通过粪便排毒尚存争议,可能与猪的品种、病毒的毒力、采样以及检测方法有关[9-10]。在本试验中,接触感染仔猪在同居饲养后第5天为PRRSV RT-PCR检测阳性,而且维持在较高水平直至死亡,表明至少强毒株PRRSV确能通过感染猪粪便排毒。本课题组的前期研究结果显示[6],尽管PRRSV人工接种仔猪粪便从攻毒后第2天直至死亡都为RT-PCR检测阳性,但粪便样品需浓缩后才可分离到感染性病毒,可能与PRRSV在粪便中的稳定性较差有关[11]。因此,粪便排毒在PRRSV水平传播中的作用还有待进一步研究。
