胁迫条件下极端微生物修复石油烃污染土壤研究进展
2019-07-19桑义敏艾贤军王曙光朱玲梁存珍刘婧孔欣然
桑义敏,艾贤军,王曙光,朱玲,梁存珍,刘婧,孔欣然
1. 北京石油化工学院环境工程系,北京 102617;2. 北京化工大学环境科学与工程系,北京 100029
石油是世界上最普遍的土壤污染物之一,主要由有机和无机化合物组成,其主成分为碳氢化合物,约占其总成分的98%,石油成分的变化取决于油源储层中的硫、氮、氧和金属化合物等物质的不同组合(Gomes et al.,2018)。现代经济对石油的依赖程度较高,在原油开采、运输及再加工过程中存在较大的环境污染风险,据不完全统计,全球每年原油泄漏量在二十万吨至两百万吨之间(Fatima et al.,2016)。原油通过氧气胁迫和直接毒性作用等,对数量巨大的动、植物和微生物的生存情况构成了极大威胁。通常用于石油污染修复的技术主要有阻隔填埋、热脱附、土壤洗脱等技术,这些传统的石油烃污染修复技术处理效率较低、能耗较大且对环境有隐藏的风险性(Mandri,2007)。近年来生物修复受到了特别的关注,其中微生物修复石油污染土壤是一种环境安全、成本效益高的技术(Kumar et al.,2011)。然而,实际的石油污染土壤场地,往往存在于低温、盐碱等极端环境中,或是重金属-石油烃复合污染,或是重质石油组分(沥青质和树脂)占比过高,常规石油烃类降解微生物难以生存,大大增加了微生物修复的难度和挑战。耐冷菌、嗜冷菌、嗜盐菌、耐重金属菌、耐重质原油菌等极端微生物广泛存在于极地高寒、盐碱地以及有重金属、重质原油毒性存在的复合污染土壤环境中。这些微生物可以在极端条件下生长繁殖,形成一套与环境相适应的独特的分子机制和石油烃降解特征,对特殊环境中的污染物有良好的处理效果。在利用极端微生物修复极端、胁迫条件下的石油污染土壤方面,菌种性能尚不能满足需要,有些规律尚存在争议,有些机理机制还不明晰,推广应用尚存在一些障碍。本文将从低温、盐碱、重金属、重油等胁迫角度,按照“适应机制→降解机理→降解特性→修复实践”的思路,进行文献综述和总结分析,以期为胁迫条件下极端微生物修复石油烃污染土壤提供一定的借鉴和参考。
1 低温胁迫条件下石油烃污染土壤的微生物修复
全球不少于80%的生物圈为常年低于5 ℃的永久低温地区。与温热带环境相比,原油污染在寒冷气候条件下(包括极地和亚极地)对于环境的影响可能更加严重。寒冷气候的季节性、偏远性和低修复效率使寒冷地区的风险管理和修复成本大大增加(Princz et al.,2012)。微生物修复(利用微生物降解或解毒污染物)被认为是一种对寒冷地区破坏性较低的修复技术,因为在受碳氢化合物污染的寒冷气候土壤中,通常可以发现适应寒冷环境的碳氢化合物降解细菌。20世纪80年代Trevors(1982)从土壤、淡水和海洋系统中分离出的低温微生物,能广谱利用自然环境中存在的各种石油烃,并将其作为唯一的能源和碳源。中国北方地区有漫长的冬季,利用耐冷微生物对寒冷地区石油污染土壤进行生物修复、研究其冷适机制和降解特征,具有切实可行的实际意义。目前针对寒冷地区的烃类污染生物修复技术主要利用夏季非冻结时期,但是该时段往往不能贯穿整个修复周期(Chang et al.,2014)。
嗜冷菌必须生活在低温条件下且其最高生长温度不超过20 ℃,最适生长温度为5 ℃,在0 ℃可生长繁殖;耐冷菌最高生长温度高于 20 ℃,最适温度高于 15 ℃,在 0-5 ℃可生长繁殖(Margesin et al.,2001)。耐冷菌和嗜冷菌等低温细菌广泛分布于冰、雪、水、岩石及土壤等低温环境中,主要包括真细菌、蓝细菌、酵母菌、真菌、放线菌及藻类,其中以细菌居多(Buzzini et al.,2012)。徐成斌等(2014)通过对抚顺石油二厂曝气池活性污泥的驯化和分离,得到一株以柴油为碳源的低温降解菌株 Q21(假单胞菌属),经鉴定为琼式不动杆菌。黄磊等(2007)从渤海油船泄漏区域的海底泥中筛选到1株能降解柴油的低温菌T7-2(红球菌属),初步鉴定为红平红球菌。
1.1 嗜低温微生物的冷适机制
低温微生物长期生活在低温环境中,通过进化形成了一系列的适冷机制,保证其在低温条件下的正常生命活动(Antony et al.,2012)。为适应环境温度的变化,微生物必须调节细胞膜脂类组成,以调节细胞膜的流动性。生长温度的降低有助于短链形成、脂肪酸甲基分支增加、支链脂肪酸比例增加、环状脂肪酸比例减少(Chattopadhyay,2006;D'Amico et al.,2006)以及冷激蛋白、冷适应蛋白和DEAD-box RNA解旋酶的合成,以保持低温下RNA的正确折叠、蛋白质翻译等重要的生命活动。防止细胞溶质冻结的适应性也很重要,许多嗜冷菌产生的防冻蛋白抑制冰晶晶格的形成(Modig et al.,2010),而其他嗜冷菌则浓缩糖以降低细胞溶质冰点(Holmstrup et al.,2002)。此外,冷激蛋白似乎是低温适应的重要组成部分(D'Amico et al.,2006)。耐冷菌通过膜蛋白的磷酸化、去磷酸化等复杂代谢过程来快速感受温度变化,通过信号传导的方式辅助完成一系列适冷反应(Ray et al.,1994);其细胞膜中具有流动性的β-胡萝卜素,也能促进其对极端低温的适应性(Wang et al.,2014)。除了这些适应性机制,维持足够的代谢通量对于生化过程也非常重要。
为了解决代谢通量的问题,嗜冷酶往往表现出氨基酸特异性的取代,这些微小的取代仍能维持结构完整性,但足以增加灵活性和催化效率(Siddiqui et al.,2006);因此,嗜冷酶能够维持代谢功能。嗜冷微生物的嗜冷酶具有较少的脯氨酸和精氨酸,较低的脯氨酸与赖氨酸,比较少的二硫键(Georlette et al.,2003),有助于提高能量产生和储存效率等以适应低温环境(辛玉华等,2013)。与中温细菌相比,嗜冷菌的γ-proteobacteria编码AMP合成酶的基因拷贝数增加,而编码AMP降解酶的基因拷贝数降低,这是微生物向冷适应进化的必不可少的一个步骤(Parry et al.,2011)。为适应冷环境,微生物内部的生化变化还包括分子内相互作用的减少以及极性/非极性残基(residue)在体积、位置和大小等方面的改变(Farrell et al.,2004),这些变化通常牺牲了热稳定性而保持细胞在低温下的灵活性(Siddiqui et al.,2006)。
嗜冷菌对低温的另一种适应与能量代谢有关。随着温度降低,嗜冷菌细胞内三磷酸-5′-腺苷(ATP)水平呈升高倾向,即使生长速率与温度直接相关。鉴于热能降低、吉布斯自由能降低和水的粘度增加,温度条件一般会导致扩散速率降低。ATP浓度的增加可预测地减少到依赖酶的平均扩散距离,消除与温度有关的吉布斯自由能减少,从而推动生化反应(Amato et al.,2009)。
Parry et al.(2011)揭示了5′-腺苷一磷酸(AMP)的合成(带下划线的;深色箭头)基因与分解(粗体;虚线箭头)基因和相关生化过程(灰色文本和箭头),如图 1所示,箭头表示稳态条件下的有利反应方向。基因名称与酶一一对应:ushA,5′-核苷酸酶;gsk,肌苷激酶;ampD,AMP脱氨酶;purA,腺苷酸肉桂酸合成酶;purB,腺苷酸基琥珀酸;adk,腺苷酸激酶;apt,腺嘌呤磷酸核糖转移酶;amn,AMP核苷酶;pykF,丙酮酸激酶;atp N,ATP合成酶。嗜冷菌的嘌呤代谢途径与 5′-腺苷-单磷酸(AMP)合成酶有关,而嗜温菌的嘌呤代谢途径与AMP降解酶有关。
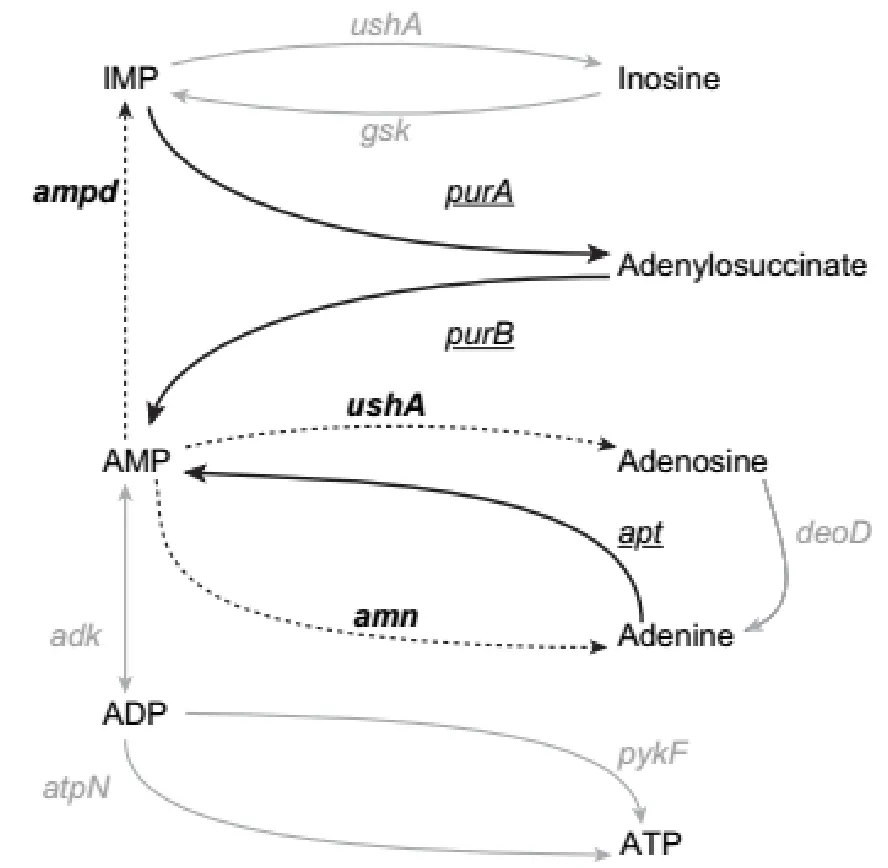
图1 5′-腺苷一磷酸(AMP)的合成基因与分解基因和相关生化过程Fig. 1 Schematic diagram of major AMP synthetic (underlined; dark arrows) and AMP degradative(bold; dashed arrows) genes and relevant biochemical pathways (gray text and arrows).
1.2 嗜低温微生物的石油烃降解机理
1.2.1 常温条件下的石油烃降解机理
石油烃在好氧条件下降解最快、最彻底。图2a显示了烃类好氧降解的主要机理。烃类污染物的初始胞内攻击是一个氧化过程,氧的活化和掺入是氧合酶和过氧化物酶催化的酶促关键反应。外围降解途径将烃类污染物逐步转化为中间代谢[如三羧酸(TCA)循环]的中间产物,如乙酰辅酶A、琥珀酸盐、丙酮酸盐。这些代谢产物与无机盐类一起,作为细胞合成、生物量增长的前驱物。石油烃类的降解过程由特定的酶系统来调节、主导。图 2b显示了氧合酶对烃类等外源性物质的初始攻击过程。其他相关机制还有微生物细胞与基质(油滴)的附着机理以及生物表面活性剂的产生机制,前者尚不清楚,后者已经得到了很好的研究(Das et al.,2011)。
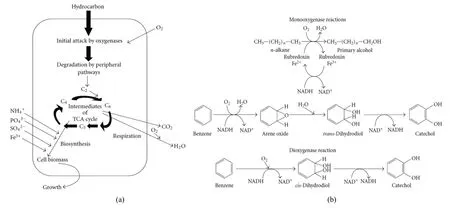
图2 微生物好氧降解石油烃的主要原理(a)及酶反应(b)Fig. 2 Main principle (a) and enzymatic reactions (b) of petroleum hydrocarbons aerobicly degradated by microorganisms
1.2.2 低温条件下的石油烃降解机理
石油烃低温降解菌的基因和酶对降解机理有重要影响。嗜冷酶在低温下具有高活性的分子机制,北极嗜冷菌Shewanella sp. AS-11的乙酸激酶(SAK)比中温菌E. coli K-12的乙酸激酶(EAK)更具柔韧性但更不稳定,低温下催化活力更高(Tang et al.,2012)。王世杰等(2011)认为低温微生物降解石油烃的功能基因主要存在于辛烷质粒(OCT质粒)、甲苯-二甲苯质粒(TOL质粒)、萘质粒(NAH质粒)和控制甲苯、对位或间位二甲苯的XYL质粒等线粒体或质粒上。而 Margesin et al.(2003)则认为低温石油烃降解菌的降解性能与其基因类型和生物活性或是其数量无相关性,与污染水平之间也没有相关性。此外,George et al.(2002)研究了 18种不同种油类的降解特性,结果表明与生物降解有关的动力学同位素效应是特定于某个位点的,且通常与某一位点的终端碳原子有关,它对同位素组成的影响随着碳原子数的增加而逐渐降低。
1.3 嗜低温微生物对不同组分石油烃的降解特性
低温环境中物质的粘性升高、溶解性降低,从而影响其生物可降解性(Foght et al.,1996)。石油是多种烃类组成的混合物,包括烷烃、环烷烃和芳烃等,其中以直链的烃类最易被氧化,芳烃和环烷烃的氧化较难。烃类降解菌分解轻质原油的能力高于分解重质原油(Atlas,1975),而原油的化学成分又能影响细菌的种类组成(Balks et al.,2002)。北极耐冷石油降解菌BJ1、BJ9和BJ19(假交替单胞菌属)可降解多环芳烃中萘、芴、二苯并噻吩、菲和屈等多种组分,对碳源的利用具有广谱性(那广水等,2010);BJ1、BJ9、BJ19和混合菌群对汽油和海燃油降解效果明显,而对原油和燃料油等降解效果较差。徐成斌等(2014)驯化和分离得到的低温降解菌株 Q21(假单胞菌属),其降解柴油的最适接种量是 10%,最适温度是 15 ℃,最佳 pH值为7.0,最适摇床转速为150 r·min-1,最佳盐度为0.5%-1.0%;能降解柴油中所含的 C9-C24之间大部分烷烃。黄磊等(2007)筛选的低温石油烃降解菌 T7-2(红球菌属),接种人工海水烃降解培养基后,通过补加氮源(NH4)2SO42.64 g·L-1、磷源Na2HPO42.5 g·L-1和酵母粉 0.015 g·L-1后,15 ℃振荡培养7 d,对烷烃的降解范围很广泛,C12-C36均有不同程度的降解,总降解率可以达到73.2%。Wang et al.(2014)筛选的NJ 41菌(动性球菌属)和NJ49菌(希瓦氏菌属),能在极端低温的南极环境下,将石油烃类物质由长链直链烃分解为短链直链烃。
1.4 低温胁迫条件下生物强化/刺激修复石油烃污染土壤
通过人为地向土壤中加入优势低温降解菌,可以极大地提高石油烃类污染物的降解效率。Mohn et al.(2001)通过现场土壤修复试验证实,添加耐冷混合菌刺激,极地寒冷地区土壤中超过80%的石油烃被降解。Ruberto et al.(2005)从南极污染土壤中分离出3株红球菌菌株并进行应用试验,其在低温环境中对石油烃类污染物的降解效果显著。
除了生物强化,向土壤中投加营养物质、最终电子受体以及表面活性剂等物质,以刺激微生物的生长,增加微生物生物量,从而提高石油烃降解率。(1)投加营养物质。向低温石油污染土壤中施入降解菌-堆肥制剂,可提高土壤中的石油烃去除率(吴蔓莉等,2017);向低温石油污染土壤中添加水和营养物质,也可刺激微生物、提高石油降解率(Stallwood et al.,2005)。(2)添加最终电子受体。添加 O2、NO3-、SO42-、Fe3+最终电子受体是寒冷地区微生物降解石油烃的重要操作方式。Jeong et al.(2015)通过向土壤喷洒含有嗜冷石油烃类降解菌和营养物质的表面活性剂泡沫,达到保温、加湿以及供氧作用,促使总石油烃去除率由46.3%提高至73.7%,一级反应动力学常数由0.019 d-1提高至0.044 d-1。(3)添加表面活性剂。向污染土壤添加表面活性剂可以降低油类表面张力,提高水溶性,使微生物可以更充分地接触石油污染物从而提高了降解效率(Kang et al.,2010)。Pepi et al.(2005)从南极分离出的ANT-3b菌(盐单胞菌属),在2%正十六烷培养基中常规生长时,可产生乳化糖脂表面活性剂,改善了石油烃类物质的可利用性,从而提高了降解效率。
2 盐碱胁迫条件下石油烃污染土壤的微生物修复
中国北方地区的油田土壤含盐量普遍较高,其中,中原油田污染土壤含盐量为7.07 g·kg-1(刘文霞等,2002);辽河油田土壤含盐度可达9.0 g·kg-1以上(潘文利等,1998);胜利油田所处的黄河三角洲盐渍化土壤含盐度达15.0 g·kg-1(刘其友等,2011);大庆油田和吉林油田所在的松嫩平原是中国典型的内陆盐碱湿地集中分布区,大庆地区的土壤基本都呈碱性,很多地区含盐量在8 g·kg-1以上(姜明等,2005)。高盐胁迫条件制约了石油烃降解菌的生长及其对石油烃污染土壤的修复能力,限制了高盐碱石油污染土壤生物修复技术的应用(Liu et al.,2011)。
根据耐盐性能的不同,嗜盐菌分为非嗜盐菌、轻度嗜盐菌、中度嗜盐菌和极端嗜盐菌共 4类(Chengbin et al.,2012)。中国西部具有十分丰富的嗜盐菌资源,主要分布在新疆盐湖亚区、青海盐湖亚区、西藏盐湖亚区和陕、甘、宁、蒙盐湖亚区、盐碱地等(李明慧等,2002)。从各类石油污染盐碱地中分离、筛选嗜盐碱微生物,是进行机理分析的重要前提。Wang et al.(2010)从中国胜利油田受原油污染的盐渍土壤中分离出两种可将原油作为唯一碳源的新型放线菌DQS3-9A1T和DQS3-9A2(分支杆菌属),可在土壤含盐量为1%-12%(w/v)范围内生长。Zhao et al.(2012)从原油污染的盐碱土壤中分离出一株A-1T菌株(盐单胞菌属),其属于中度嗜盐菌,在含盐量0.05%-27.5%(w/v)(最佳5%-8%)条件下存活。Wu et al.(2009)发现一株属于丝状菌属分支的新型耐盐菌菌株SLG5B-19T,在NaCl浓度在0-7%(w/v)范围内生长良好。Wu et al.(2012)分离出一株较高表面活性和耐盐性的盐碱地高效石油降解菌 BF40(沙雷氏菌属),其土壤原油去除率为0.22%-1.20%。付瑞敏等(2016)通过注入低能N+诱变野生株YJ8(沙雷氏菌属)并获得突变株YJ8-10(沙雷氏菌属),在NaCl浓度为80 g·L-1的高盐浓度中仍生长良好。Wang et al.(2007)从原油污染的盐渍土中分离出两株中度嗜盐菌株 SL014B-69T和 SL014B-62A2(两株菌均属盐单胞菌属),可适应的 NaCl浓度为1%-20%(w/v),温度为10-42 ℃,pH为8.0-9.0。Gomes et al.(2018)从含油样品中分离出141种嗜盐菌菌株,研究发现该类菌株具有较高的分类学和遗传多样性,具有进一步应用于生产生物表面活性剂或生物修复技术的突出潜力。
2.1 嗜盐碱微生物的适盐碱机制
嗜盐菌对高盐环境的适应机制体现在以下几个方面:(1)嗜盐菌调节渗透压平衡方式:一是在细胞内积累高浓度的K+抵抗胞外的高渗环境;二是在细胞内积累或产生相容性介质以适应高盐环境(曹军卫等,2004);(2)嗜盐菌对高浓度 Na+的依赖性:嗜盐菌细胞壁糖蛋白中的酸性氨基酸的羧基需要 Na+来稳定,故高 Na+浓度可以维持细胞壁结构完整,同时保证细胞功能正常(王伟伟等,2015);(3)大多数嗜盐菌能迅速合成和降解糖、氨基酸等小分子溶质,构成渗透压调节剂,帮助细胞从高盐环境中获取水分,并且稳定和保护菌体内酶的活性;(4)嗜盐菌的细胞蛋白还可特异地结合许多低分子量的亲水性氨基,使细胞质呈现溶液状态,以便在高盐环境中发挥其功能(Oren,2002);(5)嗜盐菌可通过细胞膜上的转运系统从周围环境中吸收相容性溶质以节省从头合成所需的能量(Pflüger et al.,2004)。JNPH-3(Halorubrum 属)菌株专一性依赖高浓度的Na+,对Cl-依赖性较弱,K+浓度变化对菌体生长无显著影响,其菌体通过自身产生四氢嘧啶的机制来调节渗透压(张晓梅等,2010);NY-001(盐单胞菌属)中度嗜盐菌可以从环境中吸收相容性溶质以对抗高盐环境,其潜在的转运体系与相容性溶质合成体系共同构成了以相容性溶质为媒介的抗盐系统(王魁荣等,2010)。
嗜盐碱微生物中存在着细胞外被(cell coat)(图3a)和离子反向运输机制(图 3b),其中前者可将细胞外碱性环境与细胞内的中性环境隔离,后者则在生长和发育过程中维持较为稳定的胞内钠离子浓度(Mirete et al.,2016)。
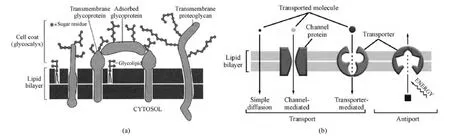
图3 耐盐碱微生物的细胞外被(cell coat)及离子正常/反向运输机制Fig. 3 Sketch of the cell coat (a) and difference between normal transport and antiport (b)
2.2 嗜盐碱微生物的石油烃降解机理
土壤盐分和石油碳氢化合物(TPH)浓度是影响土壤细菌多样性和群落结构的两个主要环境因子。盐分含量与土壤微生物生物量碳(MBC)及微生物生物量氮(MBN)具有负相关关系,但对细菌香农均匀度指数的影响较小。TPH浓度与土壤MBC呈负相关,与MBN和香农指数呈正相关,但对均匀度指数无影响。尽管随着盐碱化程度的增加,某些物种的多样性得到加强,但是土壤盐分对大多数种群具有抑制作用,而土壤TPH对群落多样性具有选择性影响。放线菌、g-变形菌、厚壁菌、热球菌及其他一些未知菌种是盐碱化和油污双重胁迫下的优势菌(Gao et al.,2014)。
Ebadi et al.(2017)研究表明,含盐土壤会降低石油烃微生物降解的速率和程度;但是,在添加氮肥、磷肥以及产生生物表面活性剂/耐盐菌种的条件下,能明显增强石油烃微生物降解的速率和程度(见图4)。
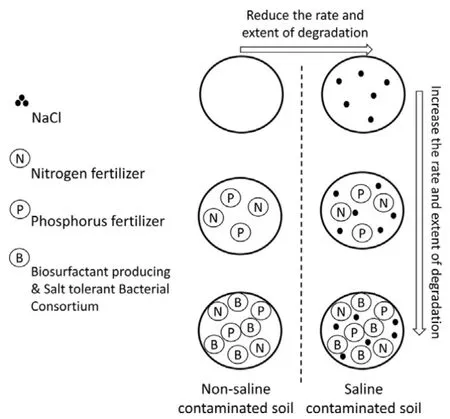
图4 盐碱土壤环境中的烃类微生物降解机理Fig. 4 Main principle of petroleum hydrocarbons aerobicly degradated by microorganisms in saline contaminated soil
2.3 嗜盐碱微生物对不同组分石油烃的降解特性
首先,不同种类嗜盐碱微生物对石油烃的总体降解效率有所区别。谢鲲鹏等(2009)分离到的属于假单胞菌属的耐盐原油降解菌LSD-3,在原油浓度为 0.5 g·L-1、NaCl浓度为 30 g·L-1、pH 值为 8、温度为30℃、接种量为3%等最适条件下,经过5 d的培养,原油的降解率为68%。
其次,不同种类嗜盐碱微生物对不同组分石油烃的降解特征也不同。胡春辉等(2017)在辽河口湿地油田石油污染土壤中分离到一株耐盐柴油高效降解菌株L7(不动杆菌属),经鉴定其为不动杆菌,在最适条件下培养 5 d后的柴油降解效率为61.5%,菌株L7具有高效降解中长链烷烃的能力,对碳链长度在 19-25的饱和烷烃降解效率接近100%。Liu et al.(2019)通过22周的柱模拟,正构烷烃(C8-C40)和 16PAH的降解率分别达到42.45%和34.61%。短碳链烷烃(C8-C12)主要被土壤表层(0-30 cm)微生物降解,只有少数部分迁移到深层(30-60 cm)土壤中。长链烷烃天生不易降解或迁移到深层土壤中。含有3个以上芳香环的多环芳烃很难被降解。好氧菌、假单胞菌、滨海杆菌是表层土壤中主要的石油降解菌,而类杆菌、乳球菌、嗜碱菌等厌氧菌在深层土壤中起着至关重要的作用,镰刀菌和曲霉是0-60 cm深土壤中主要的石油降解菌。通过对实验室柱模拟的研究,环境变量对微生物对石油污染的响应有着深刻的影响,特别是盐度、粘土含量和厌氧条件分别影响0-30、30-60和60-80 cm深土壤微生物群落组成的主要因素。
最后,温度、盐度等条件也会影响嗜盐碱微生物对石油烃的降解特性。Anderson(2013)的研究表明沙漠土壤温度和盐度的波动将直接影响其中微生物的活性和多样性,从而影响生物修复的效率。Minaitehrani et al.(2009)研究表明,NaCl含量对微生物降解重质原油污染土壤的效果有较大影响,随着 NaCl含量增多,微生物对石油污染土壤的分解作用逐渐降低。
2.4 盐碱胁迫条件下生物强化/刺激修复石油烃污染土壤
将筛选培育出的优势耐盐石油降解菌,应用于生物强化土壤修复实践中,并进行降解性能及降解条件优化等方面的研究探索,是目前科技工作者的一项重要工作。Dastgheib et al.(2011)分离出一株耐盐菌株 Qtet3(食烷菌属),可以在用 2.5%浓度NaCl溶液灌溉的石油污染土壤中生长和存活,且其石油烃类降解率可达 26.1%。刘其友等(2011)在石油污染土壤中投加复合菌株CM-13(复合菌株,无属名),当其接种量为土壤质量的 10%时,修复效果较好,对石油污染物质的加速降解作用显著。此外,微生物的生长与营养盐的量存在最佳匹配值,土壤中氮的最佳含量为0.20%,磷的最佳含量为0.05%,石油类的降解率随着麦糠投加量的增大而逐渐增大,当麦糠量为土壤体积分数的25%时,对土壤的修复效果最好。
Ebadi et al.(2017)将数种产生生物表面活性剂的铜绿假单胞菌菌株组合形成菌群,可以减轻盐度对生物降解的不利影响,经菌群处理过的土壤对植物产生的毒性降低了30%。从含油样品中分离出的嗜盐菌菌株具有在生物表面产生活性剂或生物修复的潜力(Zhao et al.,2009)。利用卤代菌群落进行植物和微生物增强重质原油污染盐渍土的修复也很有效(Cai et al.,2016)。郭若勤等(2009)在含油量高达19.51 g·kg-1(干土)、含盐量高达8.26 g·kg-1(干土)的土壤中,投加嗜盐菌和驯化土著菌的修复效果比不投加嗜盐菌的高出9.8%,表明嗜盐菌和驯化土著菌的共同作用提高了土壤的生物修复效果。不同修复技术的耦合对原油污染盐渍土的降解效果更佳。
3 重金属胁迫条件下石油烃污染土壤的微生物修复
地壳中含量在1000 mg·kg-1以下的金属被称为微量元素,根据其密度可分为微量金属元素和重金属元素。重金属污染主要源于采矿、工农业废物、矿物燃料、采油等活动(Nouri et al.,2008)。石油勘探和开采、原油泄漏等会导致大量重金属进入土壤环境,石油污染往往伴生重金属污染(Essiett et al.,2010)。委内瑞拉和加拿大的原油中发现了钒,炼油厂和耗油热电厂的大气排放亚微观颗粒中发现了广泛的重金属(Banat et al.,2006)。台湾以石油为燃料的热电厂的大气排放物中存在砷、镉、铬、镍和铅等元素(Wang et al.,2010)。在石油开采的地方,土壤中含有铬、铅、镉、镍、锌和铜等重金属元素(Grujić et al.,2004)。在油田石油泄漏的原生污染区,重质碱土金属(Sr、Ba)和镧系元素(Ce、La)的富集是其主要特征。石油中所含重金属比例不高,但难于被生物降解,一旦进入土壤,就会长久残留,不断积累,对人类和其他生物造成极大危害(Agbogidi et al.,2013)。重金属的毒性效应,会对石油烃的微生物自然降解和修复产生不利影响(Vodyanitskii et al.,2012)。
3.1 石油烃降解菌的重金属适应机制
受到石油烃-重金属污染的土壤,往往富集多种耐重金属且能降解石油烃的真菌和细菌,它们可通过多种作用方式共同对抗土壤重金属的毒害作用。这些石油烃降解菌已发展出多种金属耐受机制,包括排除、生物吸附、主动去除、沉淀或细胞内外空间的生物累积(Rajkumar et al.,2009)。此外,酶解毒功能是另外一种金属耐受机制,如可将二价汞生物还原成汞(Achakzai et al.,2012)。从细胞结构的角度,整个解毒机制分三类:(1)细胞外部沉淀机制,通过分泌胞外物质改变环境条件等使重金属发生沉淀作用;(2)细胞表面吸附机制,通过各种作用将重金属离子吸附固定在细胞表面,减少细胞内部的吸收,涉及到络合、配位、离子交换、无机微沉淀、氧化还原及静电吸附等多种吸附机制;(3)细胞内部解毒机制,涉及到重金属的运输和解毒机制等,较为复杂。在实际应用中,各自独立运作的几种机制通常共同作用,从而起到更强的降解作用(Javanbakht et al.,2014)。
石油烃降解菌对重金属的生物吸附作用可概括为3点:细胞外吸附、细胞内吸附、细胞表面吸附(Cai et al.,2008)。细胞外吸附主要利用活细胞分泌的糖蛋白和多肽或生物多聚体作为生物吸附剂,以实现对重金属离子的去除作用(Volesky,2001);细胞内吸附主要由细胞自身代谢途径,使金属生物沉淀或通过生物转化使其低毒或易于回收(Vijver et al.,2004);细胞表面吸附主要通过表面生物大分子吸收转运、空泡吞饮等功能,以实现重金属离子的去除作用(Kang et al.,2006)。
此外土壤微生物可以保护联合修复工艺中的植物免受重金属的有害影响,甚至增加超蓄积植物对金属的吸收(Weyens et al.,2009)。抗金属根瘤菌(Rhizobacteria)通过诱导硫醇类化合物(Courbot et al.,2004)、过氧化物歧化酶(Vallino et al.,2009)或金属硫蛋白(Ramesh et al.,2009)等来增强寄主植物的金属耐受性。
3.2 重金属胁迫条件下石油烃降解菌的微生物作用机理
重金属的不同形态具有不同的流动性、生物可利用性和潜在的环境污染性,关系到石油-重金属复合污染土壤修复过程中微生物的降解效率以及是否需要增加辅助工程解决重金属污染等问题,因此必须考虑重金属有效态及形态的变化(Vodyanitskii et al.,2012)。石油污染土壤中的金属形态、含量和分布受有机质、水分、大团聚体以及电导率等因素影响较大(Yao et al.,2016),也受季节变化的影响(Ideriah et al.,2013)。有机物对重金属环境行为的影响十分复杂,高分子有机物通过络合或螯合、吸附、截留等作用,钝化土壤中重金属;低分子有机物通过螯合、络合作用活化土壤中重金属。原油污染土壤中的金属离子与土壤颗粒的结合比较松散,流动性因子较高,金属的流动因子顺序为Cd>Zn>Pb>Ni>Mn>Cu>Cr(Iwegbue,2011)。
石油烃-重金属复合污染盐碱土的微生物修复过程中,土壤中有效态Cd2+、Ni随培养时间延长,有效态含量呈起伏变化,且土壤中有效态 Cd2+与Ni的变化规律存在明显差异(陈雪兰等,2013)。培养60 d后,土壤Cd2+的可氧化态含量均下降,可还原态含量均略有增加,低浓度时弱酸提取态Cd2+含量降低,残渣态Cd2+含量增加,高浓度时变化趋势相反。培养60 d后,Ni的弱酸提取态、可还原态、可氧化态 3种形态总量呈下降趋势,残渣态Ni含量则增加,Ni的形态分布由不稳定向稳定方向迁移,活性降低。
石油烃-重金属复合污染盐碱土壤的生物修复过程中,微生物对石油烃的降解机理同于非极端条件的降解机理。微生物对重金属的修复机制包括生物吸附、细胞内积累、酶催化转化、生物浸出和生物矿化、氧化还原反应(Lloyd,2002)。利用微生物/植物对土壤进行解毒或去除重金属,可改善土壤质量并恢复土壤功能(Ye et al.,2017),虽然修复时间较长但成本效益高,可用于强化自然衰减过程。(1)细菌等微生物有能力影响重金属的迁移率和对植物的可用性,可以通过铁载体、有机酸、生物表面活性剂、生物甲基化和氧化还原等途径将重金属转化为生物可利用的或可溶的形态,促进植物对土壤结合金属的吸收(Gong et al.,2018)。(2)细菌等微生物具有多种促生长能力,包括磷增溶、固氮、固铁、植物激素和ACC(L-氨基环丙烷-L-羧酸)脱氨酶合成(Li et al.,2011),可改善植物生长,增加植物生物量,进而促进植物修复。例如,抗金属根瘤菌能够通过产生各种物质刺激植物生长和金属积累,即单环丙烷-1-羧酸(ACC)脱氨基酶和铁磷酸盐、吲哚乙酸(IAA)(Rajkumar et al.,2012)。
3.3 重金属胁迫条件下石油烃降解菌的微生物作用特性
土壤中金属的浓度不会显著地影响植物在污染土壤中对原油的去除能力(Atagana,2011)。Jiang et al.(2008)从一种重金属污染土壤中分离出一种耐重金属细菌株Burkholderia sp.J62(伯克氏菌属),并将其应用于一种受铅和镉污染的土壤修复中。该菌株增加了两种金属在溶液培养和土壤中的细菌增溶作用,产生吲哚乙酸、铁载体和1-氨基环丙烷-1-羧酸脱氨酶,并溶解无机磷酸盐。此外,该菌株显著提高了玉米(Zea mays)和番茄(Lycopersicon esculentum)植株的生物量,提高了植物组织中铅和铜的积累。Babu et al.(2013)用从樟子松(Pinussylvestris var. mongholica)根部分离出的细菌菌株接种于土壤中,显著增加了赤杨木(Alnus japonica)幼苗的生物量和重金属(砷、铜、铅、镍和锌)的积累作用。伯克氏菌(Burkholderia)强化了土壤中重金属的去除效率:铅31%,砷32%,锌44%,镉37%,锰52%,铜24%(Yang et al.,2016)。Ma et al.(2015)研究发现伴矿景天(Sedum plumbizincicola)显著增强了镉的摄取(43%),而芽孢杆菌(Bacillus)则增强了伴矿景天对锌的积累(18%)。
丛枝菌根(AM)真菌能促进作物产量增加,有助于抵抗土壤中传播的病原体,并在某些情况下促进作物对包括重金属和碳氢化合物在内的土壤污染物的耐受力。盆栽玉米植株接种丛枝菌根真菌可以促进原油污染和未污染土壤中植株的生长。种植密度对于AM接种植物后的原油污染土壤中的重金属降解具有促进作用(Abdul et al.,2016)。但是,关于AM真菌对植物吸收金属(包括从受污染土壤中提取重金属)的影响特性,目前没有形成一致的结论(Liu et al.,2007)。
3.4 重金属胁迫条件下生物强化/刺激修复石油烃污染土壤
石油、重金属类物质对于多数生物有较大毒害作用,仅有少数特殊物种能够有效修复石油烃-重金属污染土壤,而污染土壤中的生物降解速率又与土壤中微生物种类和数量有很大关系,所以筛选耐重金属毒性的优质石油烃类降解生物具有重要的实际意义(郭晓燕等,2010)。张勤等(2007)从中国东北石油污染重金属土壤中分离出3个具有营养多样化、不需要有机生长因素的假单胞菌菌种P.mendocina(D84016)、P. stutzeri(AB126690)、P.aeruginosaSA-1(DQ854840),该菌种与有机污染物的降解以及重金属抗性有关。Raju et al.(2015)从亚马逊雨林中的石油污染地筛选出两株高效铜去除微生物UEAB3和UEAB6(Geomyces属),经鉴定这两种丝状真菌为液体培养基中铜金属的最佳生物吸附剂,其适用于受原油污染的土壤的生物修复以及针对金属铜的额外去除作用。高宪雯等(2013)研究表明微生物能有效促进石油-重金属复合污染盐碱土壤中石油烃的降解效率。Ekperusi et al.(2016)研究结果表明,蚯蚓可以有效降解原油污染土壤中的重金属。
向污染土壤添加营养物质、覆盖堆肥、调节土壤pH以及改善土壤含水率等,均能增强生物降解效率。Udosen et al.(2001)研究表明,对于石油烃-重金属污染土壤的生物强化修复,微生物在降解过程中会产生有机酸以降低土壤的pH值,而受污染土壤的pH值变化,可能会促进重金属在土壤中的去除效果;用堆肥处理过的土壤修复效果远强于用锯屑和灰分处理后的修复效果。单一的植物修复技术或是微生物修复技术,对于石油烃-重金属复合污染土壤的修复作用很难达到较高的水平,因此在不断的尝试中植物-微生物联合修复技术应运而生。Achakzai et al.(2012)将丛枝菌根(arbuscular mycorrhizas,AM)真菌Glomus mosseae接种到原油-重金属污染土壤中,并协同种植高密度的玉米植株,极大地提高了石油烃、重金属污染物的去除效率。
4 重质原油胁迫条件下石油污染土壤的微生物修复
石油是世界上的主要能源,环境中的主要污染物(Rahman et al.,2002)。原油通过氧气胁迫和直接毒性作用等,对数量巨大的动、植物和微生物的生存构成极大威胁(Rozas et al.,2000)。API(American Petroleum Institute,用以表示石油及石油产品密度的一种量度,简称API度)度小于20°且硫含量通常超过 2%(按重量计)的原油被视为重油。API度小于 10°的原油,密度大于水,被认为是超重油,它们以固体或半固体状态存在。常规原油包含 67%-97%饱和烃和芳香族化合物,2%-33%树脂和 0.1%-12%沥青类物质;而重油含有24%-64%的饱和烃和芳香烃,14%-39%的树脂和11%-45%的沥青类物质(Santos et al.,2014)。树脂和沥青质主要由环烷芳烃和脂环链组成,最难降解。相较于普通原油,重质原油中的有毒有害成分更高(Minaitehrani,2008),针对重质原油污染土壤的微生物修复方面的相关研究极为必要。重油生物降解研究的主要障碍是寻找能够在较短的培养时间内降解重油组分(沥青质和树脂)并能经受恶劣条件的高效微生物。
4.1 重质原油胁迫条件下的微生物适应机制
重油中含有大量的非烃组分,其组分类别和占比的任何变化都可能显著改变重油的特性。微生物降解重质原油的途径应该是先改变其性质。Al-Sayegh et al.(2016)利用一种专性降解菌或者多种组合降解菌,以重油作为碳源和底物,通过氧化芳香环、螯合金属和切断分子间的内部键/链改变重质原油的物理性质,从而将重质原油转化为较轻组分,降低原油的粘度,从而达到降解重质原油的目的。
微生物接触、利用石油疏水底物的一般机制是细胞与烃类直接接触的界面结合,或者是生物表面活性剂主导条件下的细胞与乳化烃类的界面结合(Wentzel et al.,2007)。生物表面活性剂是微生物为吸附、乳化、湿润、分散或溶解水不溶物(作为食料)而产生的表面活性化学物质,其主要通过增加油的表面积提高非水相液体(NAPL)、多环芳烃和其他降解产物的生物利用率(Joshi et al.,2010)。与合成表面活性剂不同,生物表面活性剂是安全、可生物降解的。许多生物表面活性剂不含有胶团(micelles),可直接将表面活化的多环芳烃传递到微生物表面,而不像人工合成表面活性剂胶团内的多环芳烃一样难以被生物利用(Makkar et al.,2003)。
4.2 重质原油胁迫条件下的微生物降解机理
微生物降解过程中需以原油作为碳源。高效石油烃类降解菌往往优先降解易于降解的烃类物质,而非重质原油(Ali et al.,2013)。重油微生物降解机理是一个复杂的过程,涉及使用一种或多种生物制品(如气体、酸、溶剂、生物表面活性剂和生物类群等)进行的多种生化反应。微生物技术在石油工业中的应用包括生物脱硫、生物硝化、生物金属化和生物降解方面(Singh et al.,2012),这些代表了重油的生物升级过程。关键的微生物吸收机制是界面张力(IFT)降低、选择性堵塞、粘度降低、生物降解和润湿性改变,影响的因素有孔隙、渗透性、压力、温度、溶解气体、pH、盐度和API重力(Gao et al.,2011)。
微生物降解过程可以产生多种产物,促进重油进一步降解。例如,链球菌BT-003(链球菌属)产生的有机酸、生物气和多糖(生物聚合物)等产物有助于重油的生物降解。该类产物可使重油乳化,重油粘度从 8000-15000 mPa·s降至 50-250 mPa·s(Xu et al.,2009)。甲基营养芽孢杆菌 USTB菌株产生的糖脂类生物表面活性剂,在约为 38 mg·L-1的临界浓度条件下,将水的表面张力降低到28 mN·m-1,展现了其乳化活性,提高了重油的生物降解能力(Chandankere et al.,2014)。
4.3 重质原油胁迫条件下的微生物降解特性与修复效果
油组分的生物降解效率一般按以下顺序降低:正构烷烃、支链烷烃(branched-chain alkanes)、支状烷烃(branched alkanes)、低分子量正构烷烃、单芳烃、环烷烃、多环芳烃和沥青质。Rahman et al.(2002)研究表明C8-C11完全降解,其次是C12-C21、C22-C31和C32-C40,其降解率分别为100%、83%-98%、80%-85%和57%-73%。Parviz et al.(2011)从重质原油中分离出一种新型耐油菌株ERCPPI-1(肠杆菌属),它在浓度为0.25%-10%重油、温度高达70 ℃、压力高达6000 Pa、pH值为4-10、盐度高达15%的环境中具有良好的生物降解能力。细菌菌株garciaella petrolearia TERIG02比大多数微生物更倾向于有毒的沥青和芳香化合物,当沥青是唯一的碳源时,可以将重油粘度(50 ℃时为2637 cp)降低37%,当添加糖蜜时降低42%。生物气体和生物溶剂是降低表面和界面张力和乳化过程的主要原因。阴沟肠杆菌 ERCPPI-1菌株以重质原油为唯一碳源,经21 d培养,在重质原油0.25%(w/v)浓度下,降解率最高可达76.3%,产生生物表面活性剂,具有较高的油扩散和乳化性能。然而,在10%的重质原油浓度下,菌株的降解率仅为 19.1%(Abdullah et al.,2016)。
采用一种以上的细菌菌株来提高生物降解能力是一种有吸引力的选择。Rahman et al.(2002)研究表明,混合细菌菌团(在原油浓度为 1%时,BH原油降解率为78%)比单独菌株(在同一浓度下,假单胞菌 DS10-129降解率为 66%和黄杆菌DS5-73降解率为 41%之间)具有更高的细菌生长速率和原油降解率。Cameotra et al.(2008)研究表明,在微生物、营养液以及生物表面活性剂的共同作用下,原油的总体降解率超过98%。Tavassoli et al.(2012)研究表明,在5种菌株的混合培养体系中,沥青质的生物降解率为48%,超过了有史以来最高的沥青质生物降解结果(35%)。一般而言,与好氧条件下的微生物生长相比,厌氧条件下的烃类降解微生物生长缓慢。然而链球菌 BT-003菌株的实验结果证明,厌氧条件下的重油降解效果具有与好氧降解相媲美的可能性(Xu et al.,2009)。
5 结论及展望
利用极端微生物修复各类极端环境下的石油污染土壤,目前主要停留在分离培养和降解特性研究阶段,对于降解机制和生存机制等的机理理解不充分,菌种特性待提升,工艺参数待优化,理论研究与实际应用存在较大脱节。日后的创新研究可聚焦于以下几个方面:(1)加强高效降解菌的筛选、育种以及极端酶基因工程等工作,探索极端条件下微生物的降解机制和生存机制;(2)培育能够降解重质石油组分(沥青质和树脂)并能在较短的培养时间内承受恶劣环境的高效微生物;(3)石油降解是由多种微生物共同代谢完成,应加强对菌群构建的研究,寻找不同种降解菌合适的混合比例,以达到较好的石油去除效果;(4)极端条件及其工艺参数的选择,应来源于生产实践,并为生产实践服务;(5)加大面向实际修复工程的应用基础研究和技术研发,促进石油污染土壤的生物修复技术工程化应用;(6)注重相关学科的交叉与渗透,注重新技术、新方法、联合修复技术的使用;(7)加强生物修复石油烃污染土壤的风险评估工作。
