低磷饲料添加谷氨酸对松浦镜鲤幼鱼肠道消化酶活性及肠道形态的影响
2019-07-17李晋南王常安王连生赵志刚徐奇友
李晋南,王常安,王连生,赵志刚,罗 亮,徐奇友
低磷饲料添加谷氨酸对松浦镜鲤幼鱼肠道消化酶活性及肠道形态的影响
李晋南,王常安,王连生,赵志刚,罗 亮,徐奇友
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 1500701)
【目的】探讨低磷饲料中添加谷氨酸对松浦镜鲤肠道消化酶活性及肠道形态的影响。【方法】将初始体质量(5.07±0.02)g的松浦镜鲤450尾随机分为5组,其中4个实验组在低磷(NaH2PO3质量分数1.5%)饲料中分别添加质量分数0%、0.5%、1.0%和2.0%的谷氨酸(Glu),分别为G0、G0.5、G1.0、G2.0组,同时以正常磷饲料(2.0% NaH2PO3)为对照(C组),实验周期为8周。【结果】G1组前肠和后肠的蛋白酶活性显著高于G0组,与C组差异不显著;G1前肠脂肪酶活性显著高于G0、G0.5和G2组,C和G1组中肠脂肪酶活性显著高于G0组;C和G1组中肠淀粉酶活性显著高于其他各组(< 0.05),各组间前肠和后肠淀粉酶活性差异不显著(< 0.05)。各添加组的松浦镜鲤幼鱼前肠和后肠的皱襞高度显著高于G0组,且前肠的皱襞高度与C组相比差异不显著;C组后肠的皱襞高度显著高于其他各组(< 0.05)。G2组前肠的绒毛宽度与C组相比差异不显著(> 0.05),其他各组的松浦镜鲤幼鱼前肠的绒毛宽度显著低于C组(< 0.05);中肠和后肠的绒毛宽度各组间没有显著差异(> 0.05)。各添加组的松浦镜鲤幼鱼前肠的基层厚度与C组比没有显著差异(> 0.05)。中肠和后肠的基层厚度各组间没有显著差异(> 0.05)。肠体指数和肠长指数各组间没有显著差异(> 0.05)。添加Glu组的前肠绒毛高度及密度均显著增加,且排列整齐。【结论】低磷饲料中添加谷氨酸可以增加松浦镜鲤幼鱼肠道消化酶活性并改善肠道形态结构。
松浦镜鲤幼鱼;谷氨酸;磷;消化酶;肠道形态
磷是鱼类等水产动物必需的常量元素,是骨骼和鱼鳞的重要组成成分,由于水体中磷含量较少,且鱼类对水中磷的吸收能力较差,因此饲料磷是养殖鱼类最主要的磷源。饲料中磷的添加量过低影响鱼的正常生长发育,过高则向水体中排泄磷,加重水体磷污染。因此,如何提高饲料磷的利用率,降低饲料中无机磷的使用,减少磷向水体中的排放,受到越来越多的关注。
氨基酸除作为构建模块外,还有较多特殊功能,是维持、生长、繁殖和免疫反应所必需的代谢调节剂[1-2]。功能最广泛的氨基酸是谷氨酸家族,特别是精氨酸、谷氨酸(Glutamate,Glu)和谷氨酰胺(Glutamine,Gln)。其中谷氨酸和谷氨酰胺在哺乳动物中有重要作用,且可相互转化[3-5]。在鱼类中,这种相互转化对氨体内平衡至关重要[6-7]。此外,谷氨酸和谷氨酰胺是肠道中重要能量来源[3],但谷氨酰胺有热不稳定性[8-9]。谷氨酸有多种生物功能,在蛋白质合成、细胞代谢中起重要作用[10]。研究表明,饲料中添加谷氨酸钠可增加断奶仔猪空肠的肠绒毛高度[11],饲料中添加谷氨酸可显著提高草鱼()肠道抗氧化能力,消化、吸收能力,以及生长性能[12]。迄今,对低磷饲料条件下,Glu对肠道消化功能的影响鲜见报道,笔者探讨低磷水平下添加Glu对松浦镜鲤(L)幼鱼肠道消化酶活性及肠道组织形态的影响,为Glu在水产饲料中的应用提供依据。
1 材料和方法
1.1 材料
1.1.1 试剂 Glu购自Sigma,纯度≥98.5%。
1.1.2 实验动物及日粮 松浦镜鲤幼鱼,体质量(5.07±0.02)g,取自中国水产科学院黑龙江水产研究所。正常组与低磷组饲料均为以鱼粉和豆粕为主要蛋白源,鱼油和豆油为脂肪源,羧甲基纤维素为黏合剂,配制而成的等氮等能饲料。正常组饲料添加质量分数2%的NaH2PO3,各低磷组饲料在添加质量分数1.5% NaH2PO3基础上分别添加0%、0.5%、1.0%和2.0%的Glu,分别记为G0、G0.5、G1、G2组。具体饲料配方见表1。饲料原料经粉碎按配比混合均匀,少量组分别采用逐级扩大法混合,用颗粒机制成直径2 mm的颗粒饲料,置于-20℃冰箱中保存待用。

表1 基础饲料配方及营养组成(干基)
1.3 实验设计与饲料管理
取健康松浦镜鲤幼鱼450尾,预饲2周后随机分组。实验饲料分为5组,低磷实验组(G0、G0.5、G1、G2组),以及正常磷对照组(C组)。每实验组设3个重复组,每个重复组设幼鱼30尾。实验为期8周,每天定时投喂4次,以饱食无残饵为准。实验在室内控温循环水族箱里进行,温度为(23±1)℃,24 h不间断供氧,溶氧大于5 mg/L,氨氮小于0.02 mg/L,每日吸污,每周以曝气后的水换水2/3,每日记录鱼摄食和死亡情况。
1.4 肠道消化酶的测定
养殖实验结束后,停饲24 h,每缸随机取鱼3尾,于冰盘中迅速剖取前肠、中肠和后肠,用预冷的质量分数0.86%生理盐水洗净肠道中的内容物,滤纸吸干水分,测量肠质量。按质量比1∶9加入生理盐水,以FJ-200CL高速组织匀浆机匀浆,以4 ℃、4 000 r/min条件离心10 min,取上清液,于-20℃条件下保存,用于蛋白酶、淀粉酶和脂肪酶测定。
蛋白酶活性测定采用福林-酚(Folin-phenol)法[13]。活性单位:在37℃下,每分钟水解酪素产生相当于1 μg 酪氨酸所需的酶量为1个酶活性单位。
淀粉酶和脂肪酶活性测定采用南京建成生物工程研究所试剂盒按照试剂盒说明书进行。淀粉酶活性单位:在37℃下,组织中每毫克蛋白与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。脂肪酶活性单位:在37℃下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位。组织蛋白含量采用考马斯亮蓝法测定[13]。
1.5 肠道形态的测定及统计分析方法
肠道组织切片的制备:按1.4方法取前肠、中肠和后肠组织,于Bouin氏液中固定24 h后,经乙醇逐级脱水、二甲苯透明、石蜡包埋、切片(5 μm)、HE染色、脱水、透明、中性树脂封片。用LeicaMD 4000B显微镜观察并拍照,采用Motic Images Plus 2.0软件,每段肠样测量10个以上完整皱襞高度、绒毛宽度、基层厚度。
肠道指标计算:实验结束时,每缸随机取鱼3尾,测量实验鱼体质量、体长、肠质量和肠长,计算肠体指数(Intestinal somatic index,ISI)、肠长指数(Intestinal length index,ILI)。
肠体指数= 肠质量/体质量×100%;
肠长指数= 肠道长/体长×100%;
数据用平均值±标准差表示。实验结果用SPSS 20.0软件进行单因素方差分析和Duncan’s多重比较,显著性水平为0.05。
2 结果与分析
2.1 低磷饲料中添加Glu对松浦镜鲤肠道消化酶的影响
表1可见,各组间前肠蛋白酶活性差异无统计学意义(0.05);C组和G1组中肠蛋白酶活性显著高于其他各组(0.05);G1组后肠的蛋白酶活性显著高于G0组(0.05),与其他组相比差异无统计学意义(0.05)。C和G1组前肠脂肪酶活性显著高于G0、G0.5和G2组(0.05);C和G1组中肠脂肪酶活性显著高于G0组(0.05);后肠脂肪酶活性各组间差异无统计学意义(0.05)。C组中肠淀粉酶活性最高,G1组次之,其他各种间差异无统计学意义(0.05);各组间前肠和后肠淀粉酶活性差异无统计学意义(0.05)。

表2 低磷饲料中添加Glu对松浦镜鲤肠道消化酶活性的影响
注:同列中标有一个相同小写字母或无字母者则组间差异无统计学意义(> 0.05)
Note: In the same column, the values with a same small letter-superscripts or without any letters mean no significant difference between them (> 0.05)
2.2 低磷饲料中添加Glu对松浦镜鲤肠道形态的影响
表3可见,各组前肠和后肠的皱襞高度显著高于G0组(0.05),且前肠皱襞高度与C组相比差异无统计学意义(0.05);C组后肠皱襞高度显著高于其他各组(.05)。G2组前肠绒毛宽度与C组相比差异无统计学意义(0.05),其他各组前肠绒毛宽度显著低于C组(0.05);中肠和后肠的绒毛宽度各组间差异无统计学意义(0.05)。G0组前肠基层厚度显著低于C组(0.05),其他各组间差异无统计学意义(0.05)。各组间中肠和后肠基层厚度差异无统计学意义(0.05)。
肠体指数和肠长指数在各组间的差异均无统计学意义(0.05)。
2.3 肠道组织切片观察
各前肠组织切片如图1所示。图1可见,添加质量分数0.5%、1.0%和2.0% Glu组的前肠绒毛均发育良好,排列整齐紧密,与对照C组相比,差异不显著。而G0组的前肠皱襞高度显著下降,绒毛密度较稀疏。
各组中肠组织切片如图2所示。图2可见,各组中肠的肠绒毛均发育良好,排列整齐紧密,各组间无显著差异。
各实验组后肠组织切片如图3所示。图3可见,G0组后肠的皱襞高度显著低于其他组,其他各组后肠的肠绒毛均发育较好,排列较为紧密。

表3 低磷饲料中添加Glu对松浦镜鲤肠道形态的影响
注:同列中标有一个相同小写字母或无字母者则组间差异无统计学意义(> 0.05)
Note: In the same column, the values with a same small letter-superscripts or without any letters mean no significant difference between them (> 0.05)
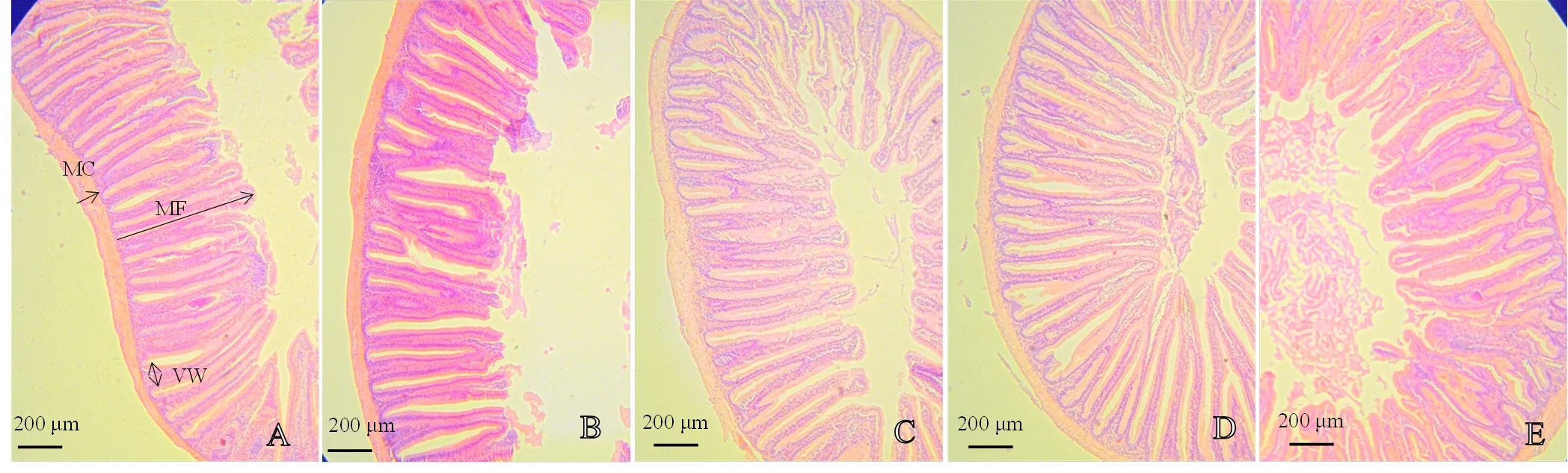
MF:皱襞高度Fold height;VW:绒毛宽度Villus width;MC:肌层厚度Muscular thickness;A:C组;B:G0组;C:G0.5组;D:G1组;E:G2组

A:C组;B:G0组;C:G0.5组;D:G1组;E:G2组
A: C group; B: G0 group; C: G0.5 group; D: G1 group; E: G2 group
图2 松浦镜鲤中肠组织切片
Fig. 2 Tissue slice of midgut of Songpu mirror carp

A:C组;B:G0组;C:G0.5组;D:G1组;E:G2组
A: C group; B:G0 group; C:G0.5 group; D:G1 group; E:G2 group
图3 松浦镜鲤后肠组织切片
Fig. 3 Tissue slice of hindgut of Songpu mirror carp
3 讨论
磷是鱼类所需的矿物质之一,在动物体内参与碳水化合物、脂肪和氨基酸的代谢,同时与能量转化、体液的稳态和核酸的正常功能有密切联系[14]。鱼类饲料中需添加适量的磷方可满足正常生长需求。目前,淡水鱼类饲料配方中饲料总磷质量分数为0.94% ~ 1.28%,而淡水鱼类对饲料总磷实际利用量仅为0.3% ~ 0.4%,因此需添加磷酸盐补充有效磷,效率最高的磷酸二氢钙(MCP)使用量(质量分数)多为1.8% ~ 2.5%[15]。在鲤鱼配合饲料行业标准(2002)中指出,鱼种前期饲料中的总磷需要量大于等于1.4%,而鱼种后期饲料中总磷需要量大于等于1.2%,而GBT36782-2018(《鲤鱼配合饲料》)规定,鲤鱼苗种、鱼种和成鱼配合饲料中的总磷质量分数为0.9% ~ 1.8%。建鲤(var.)饲料中有效磷为0.55%可满足其营养需求[16]。Kim研究表明,饲料中添加质量分数2%的MCP镜鲤生长性能最佳,其总磷质量分数大于1.4%,有效磷质量分数为0.67%[17]。Ogino等[18]研究表明,鲤鱼幼鱼饲料中有效磷质量分数为0.6% ~ 0.7%即可满足其营养需求。本研究中,幼鱼规格较小(约5 g),根据2002年的行业标准,正常磷添加组添加质量分数2%的磷酸二氢钠,其总磷质量分数为1.2%,有效磷质量分数为0.61%,可满足鲤鱼正常的生长需要。而当磷酸二氢钠质量分数为1.5%时,其总磷质量分数为1.02% ~ 1.07%,有效磷质量分数为0.50%,磷水平低于鲤鱼生长需求,因此对其肠道消化和吸收功能有一定影响。G0组肠道皱襞高度、绒毛宽度,以及消化酶活性均低于对照C组亦说明质量分数0.50%的有效磷不能满足镜鲤幼鱼生长需求。
鱼类的生长性能与肠道的消化吸收能力密不可分[19],肠道消化酶活性是肠道消化和吸收能力的重要指标[20-21]。动物体生长发育与消化酶活性存在一定的正相关性[22]。本研究探讨低磷条件下添加Glu对肠道消化酶活性的影响,结果显示,在低磷饲料中添加质量分数1%的Glu显著提高了肠道中肠和后肠的蛋白酶活性,前肠和中肠的脂肪酶活性,以及中肠的淀粉酶活性。李晋南等[13]研究表明,添加质量分数1.5%的Glu可显著提高松浦镜鲤前肠的脂肪酶活性。Zhao等[12]对草鱼()的研究也表明,饲料中添加Glu可显著提高草鱼的肠道胰蛋白酶和脂肪酶活性,以及生长性能。Glu是Gln的前体物,以往的研究发现,饲料中添加Gln可促进动物肠道发育和提高消化酶活力[11-12,23]。Lin等[24]对建鲤幼鱼的研究也表明,鱼肠道蛋白酶和脂肪酶活力随饲料Gln添加量上升而提高。
此外,对于无胃鱼类松浦镜鲤,其皱襞高度和基层厚度等肠道形态结构均可影响动物体的生长发育和营养物质的消化吸收[25]。鱼类肠道形成皱襞的数量和高度,微绒毛长度及密度等均可影响对营养物质的吸收能力,是水产动物肠道发育和吸收能力的重要标志[26]。Zhao等[12]研究表明,饲料中添加质量分数0.8%的Glu可显著增加前肠和中肠皱襞高度,Rezaei等[11]研究表明,谷氨酸盐可增加断奶仔猪空肠绒毛高度。本研究显示,低磷饲料中添加Glu显著提高了松浦镜鲤前肠和后肠皱襞高度,且有增加前肠绒毛宽度和基层厚度的趋势,说明Glu有改善肠道形态结构作用。肠体指数(ISI)和肠长指数(ILI)也是衡量肠道健康的一个重要指标[13],但是低磷对ISI和ILI的影响鲜有报道,本研究显示,各实验组中ISI和ILI差异均无统计学意义,说明低磷并未影响ISI和ILI,且低磷水平下添加Glu亦未影响二指数变化。但切片结果可见,添加Glu组的前肠绒毛高度及密度均增加,且排列整齐,说明添加Glu可增加肠道吸收面积,提高肠道消化吸收能力。
综上,低磷饲料中添加Glu可增加松浦镜鲤肠道消化酶活性,同时改善肠道形态结构,提高肠道消化吸收功能。
[1] MEIJER A J. Amino acids as regulators and components of nonproteinogenic pathways.[J]. Journal of Nutrition, 2003, 133: 2057–2062.
[2] LI P, MAI K, TRUSHENSKI J, et al. New developments in fish amino acid nutrition: towards functional and environmentally oriented aquafeeds[J]. Amino Acids, 2009, 37(1): 43-53.
[3] NEU J, SHENOY V, CHAKRABARTI R. Glutamine nutrition and metabolism: where do we go from here?[J]. Faseb Journal, 1996, 10(8): 829-837.
[4] YOUNG V R, AJAMI A M. Glutamine: The emperor or His clothes?[J]. Journal of Nutrition, 2001, 131(9 Suppl): 2449–2459.
[5] TAPIERO H, G MATHÉ, COUVREUR P, et al. Dossier: Free amino acids in human health and pathologies II. Glutamine and glutamate[J]. Biomedicine & Pharmacotherapy, 2002, 56(9): 446-457.
[6] ANDERSON P M. Urea and glutamine synthesis: environmental influences on nitrogen excretion [M] // Wright P A, Anderson P M, ed. Fish Physiology, Vol. 20. New York: Academic Press, 2001: 239–277.
[7] TERJESEN B F. Nitrogen excretion [M] // FYNN R, KAPOOR B, ed. Fish Larval Physiology. New York: Science Publishers, 2008: 263–302.
[8] SOWDEN M K, BAXTER J H, BERGANA M M, et al. Stability of Nacetylglutamine and glutamine in aqueous solution and in a liquid nutritional product by an improved HPLC method[J]. Journal of Food Science, 2002,67: 384–389.
[9] OEHME M, GRAMMES F, TAKLE H, et al. Dietary supplementation of glutamate and arginine to Atlantic salmon (L.) increases growth during the first autumn in sea[J]. Aquaculture, 2010, 310(1/2): 156-163.
[10] BROSNAN J T, BROSNAN M E. Glutamate: a truly functional amino acid[J]. Amino Acids, 2013, 45: 413-418.
[11] REZAEI R, KNABE D A, TEKWE C D, et al. Dietary supplementation with monosodium glutamate is safe and improves growth performance in postweaning pigs[J]. Amino Acids, 2013, 44: 911-923.
[12] ZHAO Y, HU Y, ZHOU X Q, et al. Effects of dietary glutamate supplementation on growth performance, digestive enzyme activities and antioxidant capacity in intestine of grass carp ()[J]. Aquaculture Nutrition, 2015, 21(6):935-941.
[13] 李晋南, 徐奇友, 王常安, 等. 谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响[J]. 动物营养学报, 2014, 26(5): 1347-1352.
[14] HALVER J E, HARDY R W. Fish Nutrition [M]. New York: Academic Press, 2002: 264-274.
[15] 叶元土, 蔡春芳. 淡水鱼类饲料原料模块化分析技术(下)[J]. 水产前沿, 2010 (7): 34-39.
[16] 杨雨虹, 郭庆, 黄金善, 等. 鲤鱼饲料磷的需要量研究[J]. 东北农业大学学报, 2006(1): 48-51.
[17] KIM J D, KIM K S, SONG J S, et al. Optimum level of dietary monocalcium phosphate based on growth and phosphorus excretion of mirror carp,[J]. Aquaculture, 1998, 161: 337–344.
[18] OGINO C, TAKEDA H. Mineral requirements in fish: III. Calcium and phosphorus[J]. Bull Jpn Soc Sci Fish, 1976, 42: 793–799.
[19] RUNGRUANGSAK-TORRISSEN K, MOSS R, ANDRESEN L, et al. Different expressions of trypsin and chymotrypsin in relation to growth in Atlantic salmon (L.)[J]. Fish Physiol Biochem, 2006, 32: 7–23.
[20] ZHAO J, LIU Y, JIANG J et al. Effects of dietary isoleucine on growth, the digestion and absorption capacity and gene expression in hepatopancreas and intestine of juvenile Jian carp (var.)[J]. Aquaculture, 2012, 368-369: 117-128.
[21] TANG L, WANG G X, JIANG J, et al. Effect of methionine on intestinal enzymes activities, microflora and humoral immune of juvenile Jian carp (var.) [J]. Aquaculture Nutrition, 2009, 15(5): 477-483.
[22] 叶元土, 张勇, 张字, 等. 酶制剂EA-II和生物制剂 BA-I对鲤肠道、肝胰脏的蛋白酶和淀粉酶活力的影响[J]. 大连水产学院学报, 1993, 8 (1): 79-82.
[23] QI X, QING Z, HONG X, et al. Dietary glutamine supplementation improves growth performance and intestinal digestion/absorption ability in young hybrid sturgeon (female ×male)[J]. J Appl Ichthyol, 2011, 27: 721–726.
[24] LIN Y, ZHOU X Q. Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp (var.) [J]. Aquaculture, 2006, 256: 389-394.
[25] 李晋南, 魏玉强, 徐奇友, 等.-酮戊二酸对松浦镜鲤肠道形态与功能的影响[J]. 水产学杂志, 2016, 29(4): 43-47
[26] 王蕾, 刘坚, 侯永清, 等.-酮戊二酸对LPS慢性应激仔猪小肠黏膜形态与功能的影响[J]. 畜牧兽医学报, 2010, 41(1): 46-52.
Effects of Glutamate Supplementation in Low Phosphorus Diets on Intestinal Digestive Enzyme Activities and Intestinal Morphology of Juvenile Songpu Mirror Carp (L.)
LI Jin-nan, WANG Chang-an, WANG Lian-sheng, ZHAO Zhi-gang, LUO Liang, XU Qi-you
(,,150070,)
【Objective】To study the effects of glutamate (Glu) supplementation in low phosphorus diets on intestinal digestive enzyme activities and intestinal morphology of Songpu mirror carp (L). 【Method】 Four hundred and fifty Songpu mirror carps (body weight 5.07±0.02 g) were randomly divided into triplicate groups of 5 dietary treatments with 30 fish per triplicate. The fish in 4 groups were fed graded levels of Glu (0, 0.5%, 1% and 2% diet) (G0, G0.5, G1, G2) in low phosphorus diet (1.5% NaH2PO3) and the fish in the control group was fed normal phosphorus diet (2% NaH2PO3) without Glu (C). The experiment lasted for 8 weeks. 【Result】The activities of protease in midgut and hindgut of G1 group were significantly higher than that of the G0 group (<0.05) but not significantly different from the C group (>0.05). The activity of lipase in foregut of G1 group was significantly higher than that of G0, G0.5 and G2 groups (<0.05). The activities of lipase in midgut of the C and G1 groups was significantly higher than that of the G0 group (<0.05).The activities of amylase in midgut of C and G1 groups were significantly higher than those of other groups (<0.05). The fold height in foregut and hindgut of Glu supplementation groups were significantly higher than that of the G0 group (<0.05) and not significantly different from the C group (>0.05). The fold height in hindgut of the C group was significantly higher than that of other groups (<0.05). The villus width in foregut of G2 group was not significantly different from that of the C group (>0.05). But the villus width in foregut of other groups was significantly lower than that of the C group (<0.05). The muscular thickness in foregut of Glu supplementation groups was not significantly different from that of the C group (>0.05). In addition, no significant difference was shown in the villus width and muscular thickness of midgut and hindgut among the groups (>0.05). There was no significant difference in intestinal somatic index and intestinal length index among the groups (>0.05). The villus height and density in the foregut of Glu supplement groups increased significantly and arranged neatly.【Conclusion】The optimal Glu supplementation in low phosphorus diet could promote intestine development and digestive enzyme activities in juvenile Songpu mirror carp.
juvenile Songpu mirror carp; glutamate; phosphorus; digestive activities; intestinal morphology
S963.73
A
1673-9159(2019)04-0020-07
10.3969/j.issn.1673-9159.2019.04.004
2019-01-22
中央级公益性科研院所基本科研业务费专项(HSY201605);国家自然科学基金项目(31702353);黑龙江省优秀青年基金项目(YQ2019C035);现代农业产业技术体系建设专项(CARS-45); 黑龙江省应用技术研究与开发计划重大项目(GA18B202)
李晋南(1983―),女,博士,助理研究员,主要研究方向为水产动物营养与饲料。E-mail:lijinnan123@163.com
王连生(1984—),男,博士,副研究员,主要研究方向为水产动物营养与饲料。liansheng0429@163.com
李晋南,王常安,王连生,等. 低磷饲料添加谷氨酸对松浦镜鲤幼鱼肠道消化酶活性及肠道形态的影响[J]. 广东海洋大学学报, 2019, 39(4): 20-26.
(责任编辑:刘庆颖)
