添加KCl对高盐胁迫下红豆草生长及生理特性的影响
2019-07-17伍国强李辉雷彩荣蔺丽媛金娟李善家
伍国强,李辉,雷彩荣,蔺丽媛,金娟,李善家
(兰州理工大学生命科学与工程学院,甘肃 兰州730050)
盐胁迫是制约全球农作物生长和产量的主要环境因素之一[1]。全球盐碱地面积超过8.3亿hm2,约占世界可耕地面积的26%[2]。我国是世界上土壤盐碱化最为严重的国家之一,盐碱地面积达0.99亿hm2,主要分布在西北、华北、东北及沿海地区[3]。近年来,由于气候变化和水资源的不合理利用,进一步加剧了土壤盐碱化程度,严重影响着农牧业生产和生态环境建设[4]。Na+是盐碱化土壤中最丰富的阳离子之一[5-6]。绝大多数作物,尤其是甜土植物(glycophytes)对Na+很敏感。土壤中高浓度Na+会扰乱植物对K+的吸收,产生离子毒害及渗透胁迫并诱发氧化胁迫,从而抑制生长、甚至导致植物的死亡[7-8]。研究表明,植物可通过调节体内K+/Na+稳态平衡[9]、积累有机渗透调节物质(如脯氨酸、可溶性糖等)[10]以及增强抗氧化能力[11]来抵御盐胁迫。深入研究植物耐盐的生理机制对我国北方地区盐碱地的改良和生态环境建设具有重要意义。
红豆草(Onobrychis viciaefoia)别名为驴豆、驴喜豆,属于豆科多年生草本植物[12],在我国北方干旱和半干旱地区广为种植。因其富含蛋白质、氨基酸,且粗脂肪、钙和磷含量较高,为各类家畜所喜食,素有“牧草皇后”之美誉[13]。尽管红豆草具有一定的耐盐性,但其幼苗对盐分比较敏感[14],这就限制了在盐碱地上进行大面积的种植。前期研究发现,当NaCl浓度低于50 mmol·L-1时,红豆草将吸收的Na+积累在根中,限制Na+转运至地上部,以保护叶片免受Na+毒害,从而维持其正常生长;然而,当NaCl浓度为100和200 mmol·L-1时,红豆草根系被动吸收的大量Na+转运并积累至地上部叶中,但其Na+区域化及对K+的选择性转运能力较弱,使得幼苗体内K+、Na+稳态紊乱,造成Na+毒害,从而抑制其生长[15]。研究表明,添加KCl使盐胁迫下麻疯树(Jatropha curcas)幼苗的Na+吸收和转运受到抑制,维持较高K+/Na+,从而避免Na+对细胞质的毒害,进而改善光合特性[16]。然而,添加KCl能否减缓高盐胁迫对红豆草幼苗的毒害作用尚不清楚。
鉴于此,本研究以红豆草为材料,采用水培试验研究了高盐胁迫(100 mmol·L-1NaCl)下不同浓度(5、10、25和50 mmol·L-1)KCl对红豆草幼苗生长及相关生理指标的影响,以阐明K+减缓高盐胁迫对其幼苗毒害作用的生理机制,为我国盐渍化地区红豆草的栽培与管理提供科学依据。
1 材料与方法
1.1 植物材料培养和处理
供试红豆草品种为“甘肃红豆草”。挑选颗粒饱满、均匀一致的种子,播在装有蛭石的塑料盘(5 cm×5 cm×5 cm,8孔/盘)中,每孔播7~8粒种子,浇灌蒸馏水,待2片子叶完全展开后,浇灌Hoagland营养液进行培养。待第1片真叶出现后,进行间苗,每孔留3棵苗。培养室的条件如下:昼夜温度(28±2)℃/(23±2)℃,光照时间16 h·d-1,光强为500~600μmol·m-2·s-1,空气相对湿度为60%~80%。
本实验室前期研究发现,低浓度NaCl(15~50 mmol·L-1)对红豆草幼苗生长没有影响,而高浓度(100和200 mmol·L-1)则明显抑制了其生长[15]。因此,本试验选择100 mmol·L-1NaCl作为高盐胁迫条件。4周龄的红豆草幼苗分别用不含NaCl和KCl(对照)、含有100 mmol·L-1NaCl(100 Na)、5 mmol·L-1KCl+100 mmol·L-1NaCl(5 K+100 Na)、10 mmol·L-1KCl+100 mmol·L-1NaCl(10 K+100 Na)、25 mmol·L-1KCl+100 mmol·L-1NaCl(25 K+100 Na)和50 mmol·L-1KCl+100 mmol·L-1NaCl(50 K+100 Na)的Hoagland营养液处理7 d。每个处理设8次重复,每个重复含有3棵苗,每两天更换一次处理液,以保持恒定的NaCl和KCl浓度。
1.2 指标测定
1.2.1 鲜重、干重和含水量测定 参考Wu等[14]的方法略有修正,冲洗植物表面后,将根置于10 mmol·L-1CaCl2溶液中置换8 min,冲洗干净后用吸水纸吸干表面水分,将幼苗分为地上部和根两部分,称取鲜重(fresh weight,FW);然后将样品装在信封中,杀青后,烘干至恒重,称取干重(dry weight,DW)。组织含水量按如下公式计算:含水量(g·g-1DW)=(鲜重-干重)/干重。
1.2.2 Na+、K+浓度和K+/Na+测定 参考Wang等[17]的方法略有修正,将恒重干样品置于试管中,捣碎成粉末状,添加100 mmol·L-1冰乙酸,密封试管,沸水浴2 h。过滤,取上清液稀释适当倍数后,在火焰光度计(2655-00,Cole-Parmer Instrument Co,USA)上测定Na+和K+浓度。K+/Na+的计算参考Yue等[18]的方法。1.2.3 叶绿素、脯氨酸、可溶性蛋白、可溶性总糖和丙二醛含量测定 采用分光光度法[19]、磺基水杨酸法[20]、考马斯亮蓝G-250法[21]、蒽酮比色法[22]和硫代巴比妥酸法[23]分别测定叶绿素、脯氨酸、可溶性蛋白、可溶性糖和丙二醛(malondialdehyde,MDA)含量。
1.2.4 蔗糖、果糖和葡萄糖含量以及转化酶和合成酶活性测定 采用Liu等[24]的方法测定蔗糖、果糖和葡萄糖含量。采用Leskow等[25]的方法测定细胞壁蔗糖转化酶、液泡蔗糖转化酶以及细胞质蔗糖转化酶活性。参照刘芳等[26]的方法测定蔗糖合成酶(sucrose synthase,SS)和蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)活性。
1.2.5 SOD、POD、CAT和APX活性测定 采用氯化硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)法[27]在560 nm下比色测定超氧化物歧化酶(superoxide dismutase,SOD)活性,以抑制NBT光化还原的50%为1个酶活性单位;采用愈创木酚法[28]测定过氧化物酶(peroxidase,POD)活性,将每分钟OD470值增加0.01定义为1个活性单位;参考Aebi[29]的方法测定过氧化氢酶(catalase,CAT)活性,以每分钟OD240值减少0.01定义为1个活性单位;参考Nakano等[30]的方法测定抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性,以每分钟OD290值降低0.01定义为1个酶活性单位。
1.3 数据分析
采用SPSS 19.0软件(SPSS Inc.,USA)对试验数据进行单因素方差分析,采用Duncan法检验差异显著性(P<0.05),采用Excel 2010作图。
2 结果与分析
2.1 添加KCl对盐胁迫下红豆草幼苗鲜重、干重和含水量的影响
与对照相比,盐胁迫(100 mmol·L-1)使得红豆草幼苗地上部鲜重和干重分别下降了51.7%和25.6%,根鲜重和干重分别下降了49.7%和32.8%(P<0.05)(表1)。然而,添加不同浓度KCl(5~50 mmol·L-1)不同程度减轻了盐胁迫对红豆草幼苗生长的抑制作用。其中,添加25 mmol·L-1显著增加了盐胁迫下红豆草幼苗地上部、根的鲜重和干重,分别增加了76.0%、28.5%、66.9%和51.0%(P<0.05)。盐胁迫下,红豆草幼苗地上部和根的含水量较对照分别降低了39.3%和28.1%。然而,添加10和25 mmol·L-1KCl使地上部含水量分别提高了22.6%和45.0%(P<0.05)。添加50 mmol·L-1KCl则对地上部和根的含水量的影响差异不显著(表1)。由此可见,添加适量KCl能够有效地减缓盐胁迫对红豆草幼苗生长的抑制作用。
2.2 添加KCl对盐胁迫下红豆草幼苗叶绿素含量的影响
在100 mmol·L-1NaCl胁迫下红豆草幼苗总叶绿素含量较对照显著降低了32.8%(P<0.05)。然而,添加10和25 mmol·L-1KCl使得盐胁迫下的红豆草幼苗总叶绿素含量分别上升了11.7%和30.0%(P<0.05)(图1A)。进一步分析表明,盐胁迫也显著地降低了红豆草的叶绿素a/b值。然而,添加25 mmol·L-1KCl则显著地提高叶绿素a/b值(P<0.05)(图1B)。由此表明,盐胁迫下KCl可能通过提高植物光合作用的能力来促进植物生长。
2.3 添加KCl对盐胁迫下红豆草幼苗Na+、K+浓度及可溶性糖含量的影响
与对照相比,100 mmol·L-1NaCl显著增加了红豆草幼苗地上部和根中的Na+浓度(P<0.05)。低浓度(5和10 mmol·L-1)KCl对盐胁迫下红豆草幼苗Na+积累量的影响不显著。然而,高浓度(25和50 mmol·L-1)KCl则使幼苗地上部Na+浓度分别降低了52.3%和37.2%(P<0.05),根部Na+浓度则没有明显变化(表2)。另外,盐胁迫下红豆草幼苗地上部和根K+浓度较对照分别降低了51.2%和61.4%(P<0.05)。然而,添加5~50 mmol·L-1KCl均显著地增加了红豆草根的K+浓度(P<0.05)。当KCl浓度为10和25 mmol·L-1时,地上部K+浓度分别增加了74.6%和161.0%,根部K+浓度则分别增加了110.3%和146.2%(P<0.05)(表2)。进一步研究发现,盐胁迫使得红豆草幼苗地上部和根K+/Na+较对照降低了91.2%和98.8%(P<0.05)。然而,添加25 mmol·L-1KCl显著地增加了盐胁迫下红豆草幼苗地上部K+/Na+(P<0.05)(表2)。这些结果表明,盐胁迫下添加适量KCl可以通过减少红豆草幼苗对Na+的吸收、增加对K+的积累,使其体内维持较高的K+/Na+,从而增强其耐盐性。
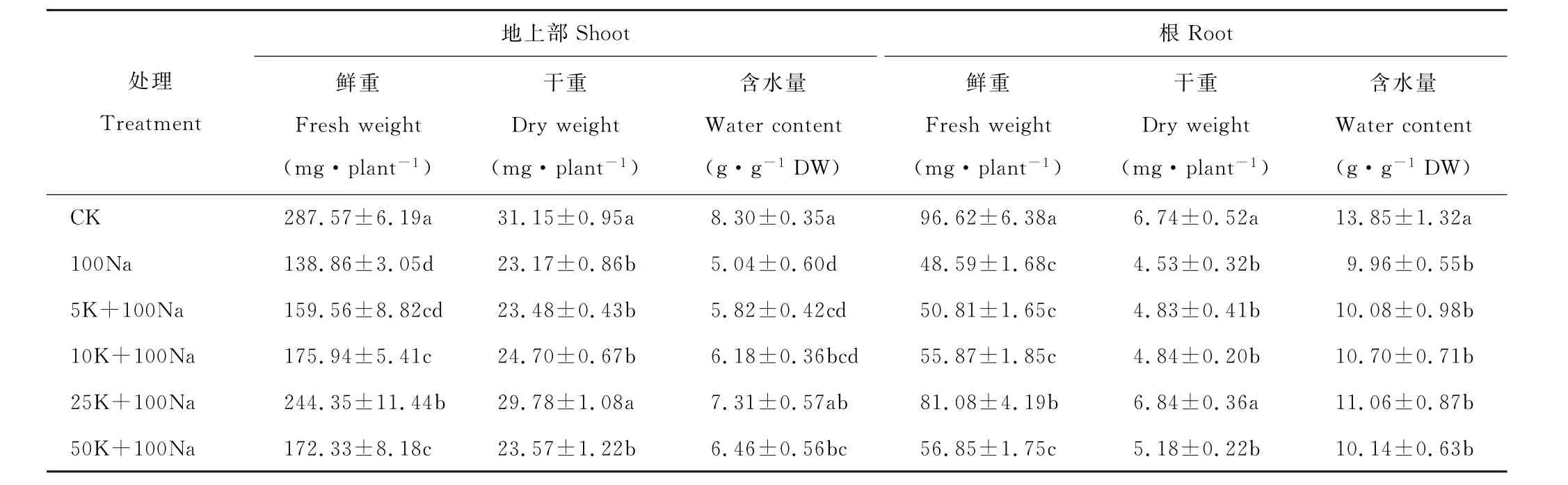
表1 不同浓度KCl对盐胁迫下红豆草幼苗鲜重、干重和含水量的影响Table 1 Effects of different concentrations of KCl on fresh weight,dry weight and water content of sainfoin seedlings under salt stress

图1 不同浓度KCl对盐胁迫下红豆草幼苗叶绿素含量的影响Fig.1 Effects of different concentrations of KCl on total chlorophyll content and Chl a/Chl b of sainfoin seedlings under salt stress
与对照相比,盐胁迫显著降低了红豆草幼苗叶的可溶性糖含量(P<0.05)。随着KCl浓度增加,盐胁迫下红豆草幼苗地上部可溶性糖含量呈增加趋势。当KCl浓度为25 mmol·L-1时,地上部可溶性糖含量提高最多,为51.6%(P<0.05)(表2)。然而,盐胁迫下添加KCl对根中的可溶性糖含量影响差异不显著(表2)。
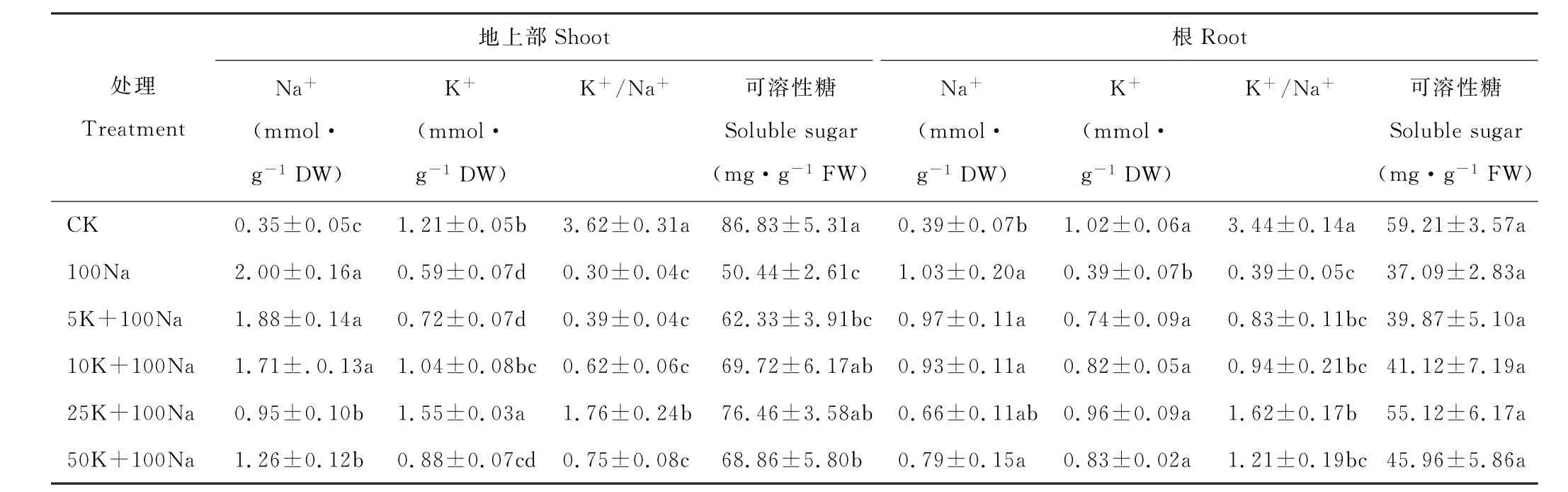
表2 不同浓度KCl对盐胁迫下红豆草幼苗Na+、K+浓度、K+/Na+和可溶性糖含量的影响Table 2 Effects of different concentrations of KCl on Na+and K+concentrations,K+/Na+and soluble sugar content of sainfoin seedlings under salt stress
2.4 添加KCl对盐胁迫下红豆草幼苗脯氨酸和可溶性蛋白含量的影响
盐胁迫下红豆草幼苗叶中的脯氨酸含量较对照略有下降,但其差异不显著。然而,添加10、25和50 mmol·L-1KCl则使盐胁迫下幼苗叶中的脯氨酸含量分别增加了69.8%、65.5%和69.4%(P<0.05)(图2A)。与对照相比,盐胁迫显著地降低了红豆草幼苗叶中的可溶性蛋白含量(P<0.05)。另外,盐胁迫下红豆草幼苗叶中的可溶性蛋白含量较对照显著下降了65.7%(P<0.05)。然而,添加10、25和50 mmol·L-1KCl使得叶中可溶性蛋白含量分别增加了1.1、2.8和1.6倍(图2B)。由此可见,外源KCl能够增加盐胁迫下红豆草幼苗叶中的脯氨酸和可溶性蛋白含量。
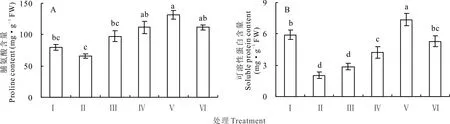
图2 不同浓度KCl对盐胁迫下红豆草幼苗脯氨酸和可溶性蛋白含量的影响Fig.2 Effects of different concentrations of KCl on proline and soluble protein contents of sainfoin seedlings under salt stress
2.5 添加KCl对盐胁迫下红豆草幼苗丙二醛含量的影响
盐胁迫下,红豆草幼苗叶中的丙二醛(MDA)含量最高,达5.65 nmol·g-1FW。然而,当添加不同浓度KCl后,盐胁迫下红豆草幼苗叶中的MDA含量均有不同程度地下降(P<0.05)(图3)。当KCl浓度为25 mmol·L-1时,MDA含量最低,为1.51 nmol·g-1FW,仅为单独盐胁迫的26.7%(P<0.05)(图3)。由此表明,添加KCl可显著降低盐胁迫下红豆草叶中的MDA含量,减轻脂质发生过氧化反应的程度。
2.6 添加KCl对盐胁迫下红豆草抗氧化酶活性的影响
盐胁迫下,红豆草幼苗叶中的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性分别较对照减少了12.7%、30.8%、57.2%和48.2%(P<0.05)(图4)。添加5 mmol·L-1KCl则使盐胁迫下幼苗叶中的SOD和CAT活性分别提高了13.2%和35.4%(P<0.05)(图4A,4C);而对POD和APX活性的影响差异不显著(图4B,4D)。当添加25 mmol·L-1KCl时,SOD、CAT和APX的活性较单独盐胁迫分别提高了20.7%、125.4%和71.1%(P<0.05)(图4A,4C,4D)。这些结果表明,盐胁迫下添加KCl显著地增强了抗氧化酶的活性,提高清除体内活性氧的能力。
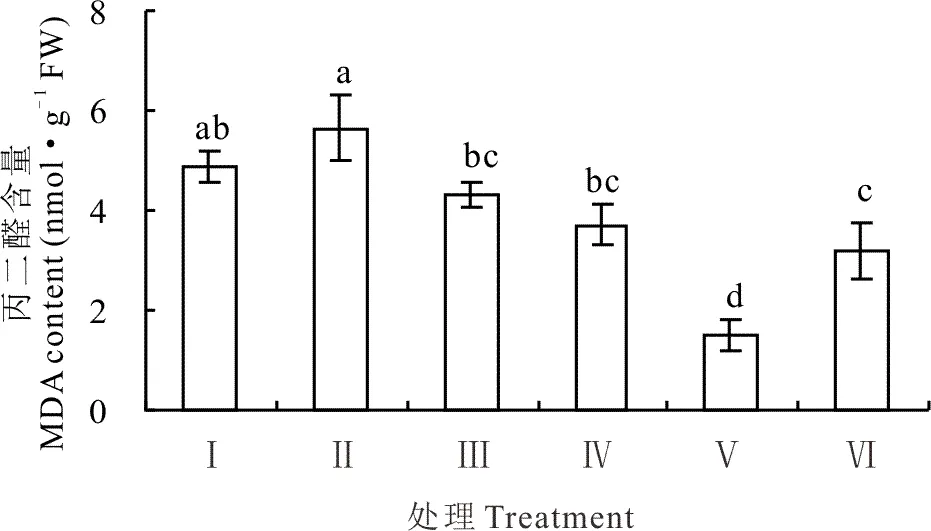
图3 不同浓度KCl对盐胁迫下红豆草幼苗叶中丙二醛含量的影响Fig.3 Effects of different concentrations of KCl on malondialdehyde content of leaf in sainfoin seedlings under salt stress

图4 不同浓度KCl对盐胁迫下红豆草幼苗叶片SOD、CAT、POD和APX活性的影响Fig.4 Effects of different concentrations of KCl on activities of SOD,CAT,POD and APX in leaf of sainfoin seedlings under salt stress
2.7 添加KCl对盐胁迫下红豆草幼苗叶片蔗糖、果糖和葡萄糖含量的影响
盐胁迫下,红豆草幼苗叶中的蔗糖和葡萄糖含量较对照分别降低了31.3%和29.3%(P<0.05)。添加不同浓度的KCl后红豆草叶中蔗糖和葡萄糖含量表现出相类似的变化趋势:随着KCl浓度的增加呈现先缓慢升高后降低的趋势;在25 mmol·L-1KCl下其含量分别较单独盐胁迫提高32.1%和51.8%(P<0.05)(图5A,5C)。盐胁迫下,添加KCl后红豆草幼苗叶中的果糖含量略有下降,但差异不显著(图5B)。
2.8 添加KCl对盐胁迫下红豆草幼苗叶片转化酶和合成酶活性的影响
盐胁迫下红豆草幼苗叶片细胞壁转化酶、细胞质转化和液泡转化酶的活性较对照分别增加了72.5%、116.9%和43.5%(P<0.05)。当添加10 mmol·L-1KCl时,红豆草幼苗叶片细胞壁转化酶、细胞质转化酶活性和液泡转化酶活性较单独盐胁迫分别下降了19.1%、50.4%和36.0%(图6)。然而,添加25 mmol·L-1KCl使盐胁迫下的3种转化酶的活性分别降低了38.0%、62.2%和57.0%(P<0.05)(图6)。由此表明KCl通过降低相关酶的活性而调节叶片糖的合成,进而增强盐胁迫下红豆草幼苗对碳的利用。
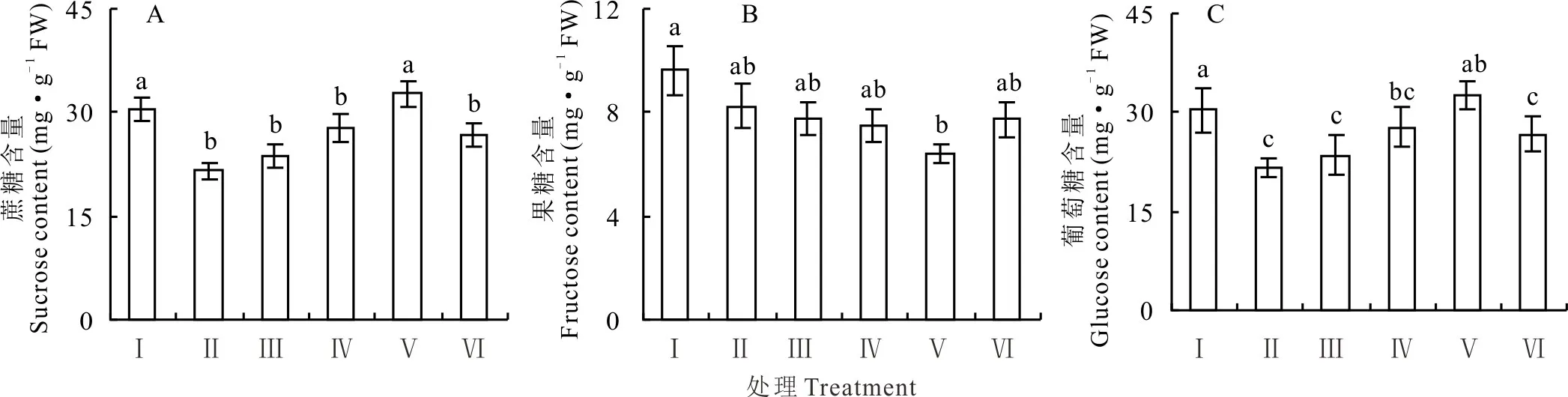
图5 不同浓度KCl对盐胁迫下红豆草幼苗叶片蔗糖、果糖和葡萄糖含量的影响Fig.5 Effects of different concentrations of KCl on contents of sucrose,fructose and glucose in leaf of sainfoin seedlings under salt stress
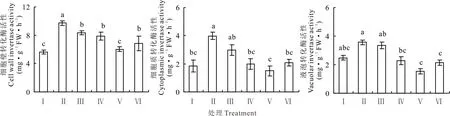
图6 不同浓度KCl对盐胁迫下红豆草幼苗叶片转化酶活性的影响Fig.6 Effects of different concentrations of KCl on invertase activity in leaf of sainfoin seedlings under salt stress
在100 mmol·L-1NaCl胁迫下,红豆草幼苗叶片蔗糖合成酶和蔗糖磷酸合成酶的活性分别较对照降低了60.6%和45.8%(P<0.05)(图7)。然而,添加10、25和50 mmol·L-1KCl均显著增加了叶片蔗糖合成酶和蔗糖磷酸合成酶的活性(P<0.05)(图7),其中25 mmol·L-1时的增加幅度最大。另外,5 mmol·L-1KCl则显著增加了蔗糖合成酶的活性,但对蔗糖磷酸合成酶活性的影响差异不显著。这些结果表明,NaCl胁迫下添加适量KCl能够增强蔗糖合成酶和蔗糖磷酸合成酶的活性,从而促进叶片蔗糖的合成。
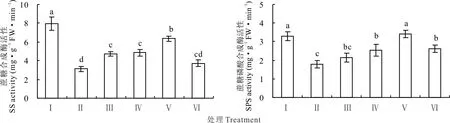
图7 不同浓度KCl对盐胁迫下红豆草幼苗叶片蔗糖合成酶和蔗糖磷酸合成酶活性的影响Fig.7 Effects of different concentrations of KCl on activities of SS and SPSin leaf of sainfoin seedlings under salt stress
3 讨论
K+在植物的生长发育及生理生化代谢过程中起着重要的作用。在高Na+条件下,由于K+亏缺使植物体内叶绿素含量下降,光合能力减弱,导致植物生长受抑[6]。盐胁迫下,提高K+的积累量以及维持体内较高K+/Na+是评价植物耐盐性的一个重要指标。前期研究表明,在低盐(5~50 mmol·L-1)条件下,红豆草幼苗通过维持体内K+、Na+稳态平衡抵御盐胁迫;而在高盐(100和200 mmol·L-1)胁迫下,红豆草地上部叶中积累大量Na+,但由于其Na+区域化及K+选择性转运能力较弱,破坏植物体内Na+、K+稳态,产生离子毒害,从而抑制植物生长[15]。本研究结果表明,在高盐(100 mmol·L-1NaCl)胁迫下红豆草幼苗地上部和根的鲜重、干重和含水量均有所下降,生长明显受到抑制(表1)。添加适量KC1后红豆草幼苗地上部和根的鲜重、干重和含水量均明显提高,耐盐性显著增强(表1)。进一步研究发现,添加25 mmol·L-1KCl显著降低了盐胁迫下红豆草幼苗地上部和根Na+积累,提高了K+含量和K+/Na+(表2)。由此可见,适量K+供应能够缓解盐胁迫对红豆草幼苗的毒害作用。究其原因:一方面,适量KCl通过提高溶液的K+/Na+,增强植物对K+、Na+选择性吸收和转运能力,促进高Na+条件下对K+的吸收,从而维持体内K+、Na+稳态平衡[31];另一方面,添加KCl使得植株积累更多的K+,并将其作为一种重要的无机渗透调节剂,降低细胞渗透势,增强细胞吸收能力,从而保持盐胁迫下幼苗体内良好的水分状况[32]。
植物遭受盐胁迫后体内过量积累的Na+会引起细胞膜去极化,发生膜质过氧化并产生活性氧(reactive oxygen species,ROS),导致氧化胁迫,使膜蛋白受损,细胞结构损害[6]。MDA是植物细胞膜脂过氧化最重要的产物之一,其含量越高说明细胞膜脂过氧化程度越大[33]。本研究发现,盐胁迫下红豆草幼苗叶中的MDA含量有所增加;然而,添加适量KCl则显著地降低了MDA积累量(图3)。由此表明,添加KC1能够有效地减缓由高盐引起的氧化胁迫。盐胁迫下,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等抗氧化保护酶在植物体内清除ROS方面起着重要作用[33]。这些抗氧化保护酶活性高低与植株耐盐的程度有关,另外在一定程度上也指示了植株遭受胁迫的程度。在小麦(Triticum aestivum)中,100 mmol·L-1NaCl胁迫下添加5~10 mmol·L-1K+能够显著提高两个耐盐性不同品种幼苗叶的SOD、CAT和POD活性,且耐盐性品种中的活性明显高于盐敏感品种[34]。本研究发现,与对照相比,100 mmol·L-1NaCl处理使红豆草幼苗叶片的SOD、POD、CAT和APX活性显著降低(图4),说明高浓度的盐致使红豆草体内的抗氧化酶系统受损,清除ROS能力下降,导致植株生长发育受阻。然而,添加25 mmol·L-1KCl使盐胁迫下红豆草植株叶片SOD、CAT和APX活性均显著增加(图4)。这就表明,外源K+可通过调节抗氧化酶的活性来及时清除盐胁迫诱导产生的ROS,减轻盐胁迫对幼苗的伤害作用。
植物体内积累较高的有机物质(如可溶性糖、脯氨酸、可溶性蛋白等)是植物适应盐胁迫的一个重要策略[15]。在本研究中,盐胁迫显著降低了红豆草根和叶中的可溶性糖含量(表2)以及叶中的可溶性蛋白含量(图2B);然而对脯氨酸含量影响不明显(图2A)。Wu等[10]在向日葵(Helianthus annuus)中研究发现,高盐胁迫显著降低了植株体内可溶性糖含量;而增加了脯氨酸含量。然而,赵佳伟等[35]在不同品种北美豆梨(Pyrus calleryana)中研究发现,可溶性糖和脯氨酸含量随NaCl浓度增加均逐渐增大,而可溶性蛋白含量随盐浓度的增加呈先上升后下降的变化。由此可见,不同植物种类的可溶性糖、脯氨酸和可溶性蛋白对盐胁迫的响应有所差异。本研究还发现,添加适量KCl使盐胁迫下的红豆草幼苗可溶性糖、脯氨酸和可溶性蛋白积累量均显著增加(表2和图2)。积累在红豆草体内的这些有机物质,一方面,作为一类重要的渗透调节物质,降低细胞的渗透势,增强细胞吸收能力,减缓细胞质中过量Na+的毒害作用[36];另一方面,作为一类关键的保护物质,维持细胞膜的稳态平衡,减轻膜质过氧化造成的伤害作用。这可能是添加K+减缓高盐对红豆草幼苗生长抑制作用的重要原因。进一步研究发现,盐胁迫下红豆草幼苗叶中的蔗糖和葡萄糖含量显著降低;然而,添加25 mmol·L-1KCl则明显提高了盐胁迫下幼苗体内这两种糖尤其是蔗糖的积累量(图5A,5C),造成这一结果可能是由于盐胁迫使得红豆草叶片细胞内外出现不平衡,外源K+可促进蔗糖和葡萄糖的积累,以提高植株吸水能力、减缓盐胁迫造成的伤害。蔗糖既是光合作用的产物,又是呼吸作用的底物,它为植物的生长发育提供碳骨架和能量,并能增强植物抗逆性[37]。在植物细胞中,蔗糖合成与分解的代谢平衡主要依赖于转化酶(如细胞壁转化酶、细胞质转化酶和液泡转化酶)、蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)的协同作用[38]。本研究发现,NaCl胁迫提高了红豆草幼苗叶片中的3种转化酶活性(图6),而降低了SS和SPS活性(图7),从而使蔗糖的含量降低。然而,添加适量KCl使得红豆草叶中的SS和SPS活性增强(图7)、转化酶活性减弱(图6)。由此表明,外源添加K+能够通过调节糖代谢酶活性来促进叶片蔗糖合成,从而增强盐胁迫下红豆草幼苗对碳的利用。本研究还发现,盐胁迫下添加25 mmol·L-1KCl致使红豆草幼苗叶中的果糖含量降低(图5B),这可能与K+能够增强蔗糖磷酸合成酶活性密切相关,从而使果糖向蔗糖合成方向转化[39]。然而,有关KCl促进红豆草幼苗蔗糖合成的分子调控机制还不清楚,尚需进一步深入探究。
4 结论
与对照相比,盐胁迫抑制了红豆草幼苗的生长,使得叶和根中的Na+浓度显著增加,而K+浓度和K+/Na+明显降低;叶中的可溶性糖和可溶性蛋白含量以及POD、CAT和APX活性显著下降;蔗糖和葡萄糖含量明显减少,细胞壁、细胞质和液泡转化酶活性增加,而SS和SPS活性降低。然而,在盐胁迫下,添加适量KCl显著增加了红豆草幼苗的鲜重、干重和组织含水量;降低了植株体内Na+积累,而增加了K+含量和K+/Na+;提高了SOD、CAT和APX的活性,降低了丙二醛的含量;增加了蔗糖和葡萄糖含量,降低了细胞壁、细胞质和液泡转化酶的活性,增强了SS和SPS的活性。添加K+可通过增强植株对K+、Na+的选择性吸收,提高抗氧化能力及促进蔗糖的合成与积累,以减轻高盐胁迫对红豆草幼苗的毒害作用。
