调控民猪ZBED6 基因转录元件的筛选与分析
2019-07-17张冬杰李忠秋
张冬杰,刘 洋,汪 亮,李忠秋,刘 娣,*
(1.黑龙江省农业科学院畜牧研究所,黑龙江哈尔滨 150086;2.农业农村部种养结合重点实验室,黑龙江哈尔滨 150086;3.东北农业大学动物科技学院,黑龙江哈尔滨 150030)
胰岛素样生长因子2(Insulin-like Growth Factor-2,IGF2)是20 世纪70 年代发现的一种促生长因子,在胎儿生长发育、肌肉生长以及基因印迹等方面具有重要的调控作用[1]。2003 年,van Laere 等[2]研究发现,猪IGF2 基因内含子3 中的单碱基突变(G3072A)会导致骨骼肌中IGF2 表达量上调3 倍、瘦肉率升高、皮下脂肪减少。究其原因是单碱基突变(G3072A)破坏了转录调控因子锌指蛋白ZBED6(Zinc Finger BED-Type Containing 6,ZBED6)的结合位点,使其无法正常结合到IGF2 基因上,至此,ZBED6 基因作为IGF2 的转录抑制因子进入人们的视线。
ZBED6 是锌指蛋白家族的一员,在胎盘哺乳动物中极其保守。ZBED6 基因无内含子,是从一个驯化的DNA 转座子进化而来,位于ZC3H11A(Zinc Finger CCCH-Type Containing 11A)基因的第1 个内含子中,其编码蛋白包含2 个BED 结构域和1 个hATC 二聚体功能域。如果在小鼠的C2C12 成肌细胞中沉默ZBED6,IGF2 的表达水平会显著上升、细胞增殖能力增强、伤口愈合进程加快。同时发现,ZBED6 在C2C12 细胞基因组上的结合位点超过2 000 个,其中包括很多与发育和转录调控相关的基因[3]。ZBED6 除了通过IGF2 参与调控骨骼肌生长外[4],还会抑制胰岛素的产生、细胞聚合以及神经元的分化[5];在同一物种内的表达也具有明显的时空特异性[6]。由此可知,ZBED6基因的生物学功能非常复杂,需要不断探索。
为了深入研究猪ZBED6 基因的生物学功能,本研究通过构建系列缺失载体、利用重叠PCR 以及双荧光素酶检测技术开展了民猪ZBED6 基因自身转录调控的研究,以期获得调控ZBED6 转录的分子元件,为后续该基因的生物学功能研究以及基因编辑等提供理论参考。
1 材料与方法
1.1 实验材料 民猪基因组DNA,为本实验室保存。
1.2 民猪ZBED6 基因启动子区的克隆 在NCBI 中检索猪的ZBED6 基因(GenBank:XR_001304140.2)的5'侧翼序列信息。利用Primer5.0 软件分别设计上、下游引物A 和R1,预期扩增长度为2 032 bp,位置为-2 053~-21 bp(以翻译起始密码子“A”为+1),两端分别引入酶切位点Kpn Ⅰ和Hind Ⅲ。引物序列(下划线为内切酶识别序列):A:5´-GGTACCGCATTCCTTGGAA AGGCAGGG-3´,R1:5´-AAGCTTTCGTAGCAGAAT CTGTTAGTGGGTT-3´。
以民猪基因组DNA 为模板扩增ZBED6 基因启动子区域。PCR 反应体系20 µL:DNA 1 µL,2×Taq Master Mix 10 µL,上、下 游 引 物(10 µmol/L)各0.5 µL,ddH2O 补齐;PCR 反应条件:95℃预变性5 min;95℃变性30 s,58.3℃退火30 s,72℃延伸120 s,共计30 个循环;最后72℃延伸10 min。扩增结束后,使用1%的琼脂糖凝胶电泳检测PCR 产物,观测到目的条带后,使用胶回收试剂盒回收目的条带。将回收后的目的片段连入pMD18-T 载体构建克隆质粒pMD18-ZBED6,反应体系10 µL:Solution Ⅰ5 µL,pMD18-T 0.5 µL,胶回收产物4.5 µL;反应条件:16℃过夜连接。连接结束后将连接产物转入大肠杆菌DH5α 感受态细胞,转化产物涂于LB 固体培养基,37℃倒置过夜培养,培养结束后挑取阳性克隆菌落,PCR 鉴定,将阳性克隆送交吉林省库美生物科技有限公司测序。将序列正确的克隆菌株加入LB 液体培养基内,重新摇菌扩繁后,小规模提取质粒,用于后续载体的构建。
1.3 报告基因质粒pGL3-Basic-ZBED6 的构建 将pGL3-Basic 空载体和pMD18-ZBED6 质粒分别经Kpn I 和HindⅢ双酶切后,使用T4 连接酶过夜连接,酶切体系10 μL:Hind Ⅲ 0.5 μL;Kpn I 0.5 μL;10×M Buffer 1.0 μL;质粒1.0 μL;ddH2O 7.0 μL。反应条件:37℃水浴10 min。连接体系25 μL:10×T4 DNA 连接Buffer 2.5 μL,DNA片段5 μL,载体1 μL,T4 DNA 连接酶1 μL,ddH2O 15.5 μL,反应条件:14℃过夜连接。连接结束后将连接产物转化至大肠杆菌DH5α 感受态细胞中,筛选阳性重组质粒,经菌液PCR 验证后,严格按照无内毒素质粒提取试剂盒说明书操作,提取无内毒素质粒,使用紫外分光光度计进行纯度的检测,检测合格后,置于-20℃保存备用。
1.4 民猪ZBED6 基因启动子区系列缺失载体的构建以引物A 和R1 所扩增的片段为基础,设计7 对系列缺失引物,引物信息见表1,其中R1 为通用下游引物,以重组质粒pMD18-ZBED6 为模板扩增系列截短型片段,反应体系及反应条件同上,退火温度均为55℃。反应结束后各系列片段按照1.2.2 方法分别连入pGL3-Basic 载体内。第1 轮构建了5 个截短型质粒,分别命名为pB(-1897/-21)-ZBED6、pC(-1863/-21)-ZBED6、pD(-1808/-21)-ZBED6、pG(-1777/-21)-ZBED6 和pH(-1462/-21)-ZBED6。第2 轮构建了2 个截短型质粒,分 别 命 名 为pE(-1800/-21)-ZBED6 和pF(-1787/-21)-ZBED6。
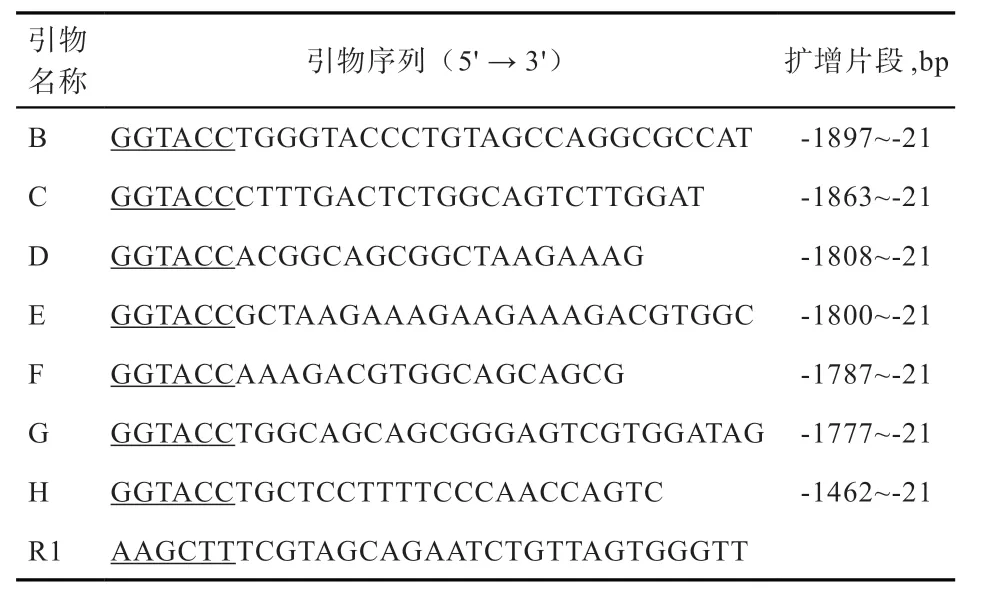
表1 扩增ZBED6 基因截短型启动子所用引物
1.5 猪肾源PK15 细胞的体外培养 按照Lipofectamine ™ 2000 Transfection Reagent 严格进行转染,转染前1 d 将细胞以4×105~8×105个细胞/孔的密度接种于DMEM 培养基中(24 孔板),第2 天转染时的细胞要达到80%~90%汇合,按照脂质体∶报告基因质粒∶pRLTK 为2 μL∶0.5 μg∶0.00125 μg 的比例共转染于猪PK15细胞中,转染4~6 h 后换成含有血清的培养基继续培养,24 h 后收集细胞,进行荧光素酶活性检测。以上实验独立重复3 次。
1.6 荧光素酶活性检测 严格按照普洛麦格公司生产的双荧光素酶报告基因检测系统(Dual-Luciferase Reporter Assay)产品说明书操作:取出24 孔板,弃掉原有细胞培养液,PBS 洗涤细胞1 次,每孔加入100 μL 细胞裂解液,37℃烘箱中放置15 min 后,收集细胞裂解液,离心5 min,取50 μL 上层细胞裂解液加入荧光测定管中,加入30 μL 检测试剂(Firefly Luciferase,LAR Ⅱ),轻轻混匀后测定发光值,再加入30 μL Stop&GLo,测定Renila 荧光素酶发光值,二者的比值即为荧光素酶相对活性(RLA),RLA 的数值为3 次重复实验结果的平均值±标准差。
1.7 民猪ZBED6 基因启动子区调控元件的预测 根据3 个转录因子预测网站(http://www.gene-regulation.com/pub/programs/alibaba2/index.html、http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3、http://jaspar.genereg.net)对ZBED6 基因的启动子区进行预测分析。根据预测结果,探讨该基因启动子区可能存在的调控元件。
1.8 民猪ZBED6 基因启动子区调控元件的筛选与验证根据在线软件的预测结果,设计并合成用于ZBED6 基因启动子区各转录因子结合位点缺失的引物,引物序列见表2。利用重叠延伸PCR 法获得定点突变片段,重叠延伸PCR 主要通过3 个PCR 反应完成:①以Adf-1调控元件的突变为例,首先以pMD18-ZBED6 质粒为模板,用正向侧引物A 和突变引物Del- Adf-1-R 进行PCR1 扩增,扩增产物含有突变位点及其上游片段;②以pMD18-ZBED6 质粒为模板,用反向侧引物RS 和突变引物Del-Adf-1-F 进行PCR2 扩增,扩增产物含有突变位点及其下游片段;③分别胶回收PCR1 和PCR2 扩增产物,等比例混合后,以此为模板,使用正反向引物A 和RS 进行PCR3 扩增,扩增产物即为引入目的突变的靶序列,然后按照上述方法连入pGL3-basic 载体。其他调控元件缺失载体的构建均按照此方法进行。
2 结 果
2.1 民猪ZBED6 基因启动子区的克隆测序 以猪耳组织样DNA 为模板,以特异性引物A 和R1 进行ZBED6基因5′侧翼区扩增,1%琼脂糖凝胶电泳检测后在2 000 bp 左右发现单一、明亮的条带,与预期的2 032 bp相符。将目的片段纯化、克隆测序后与NCBI 数据库中猪的ZBED6 基因(登录号为XR_001304140.2)序列相比,相似度为99.26%,说明序列扩增正确。
2.2 报告基因质粒pGL3-Basic-ZBED6 的构建 从图1可见,双酶切后,有一条长约2 000 bp 的片段从质粒中成功切下,与连入的ZBED6 基因片段大小相符,说明目的片段已成功连入pGL3-Basic 载体。
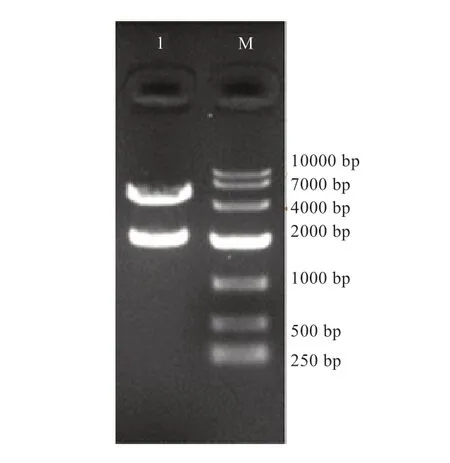
图1 pA(-2053/-21)-ZBED6 质粒酶切鉴定图谱
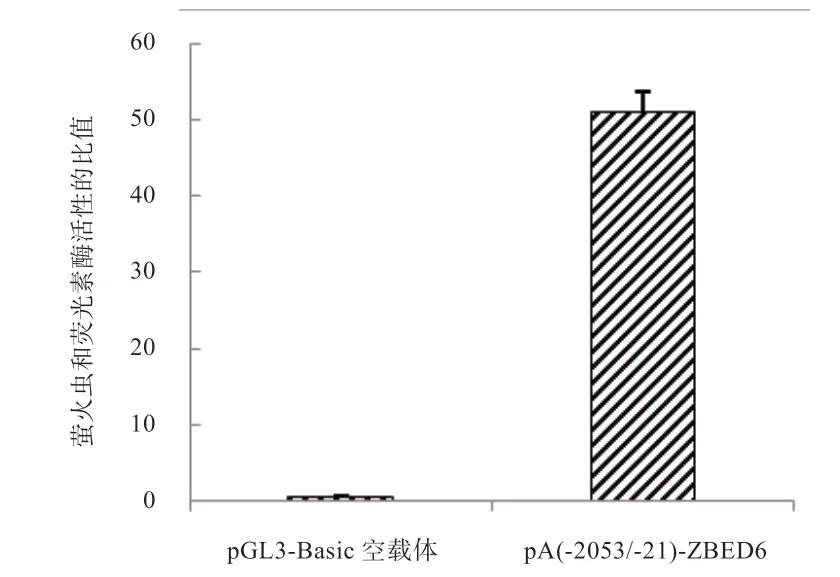
图2 pA(-2053/-21)-ZBED6 双荧光素酶活性分析
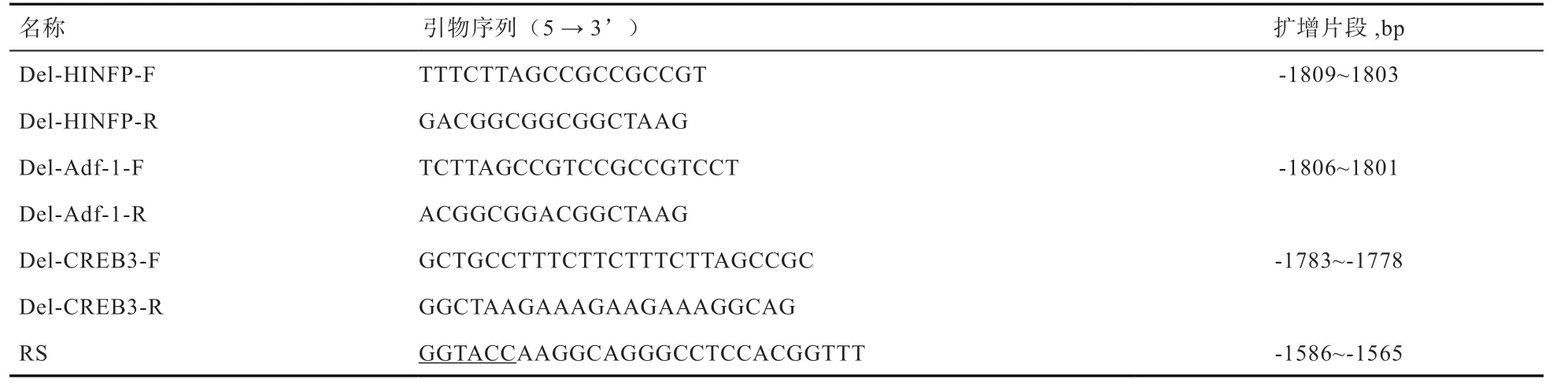
表2 ZBED6 基因启动子区调控元件缺失突变所用引物
2.3 荧光素酶活性检测 如图2 所示,与空白对照相比,pA(-2053/-21)-ZBED6 具有明显的启动子活性,表明-2 053~-21 bp 片段内含有调控民猪ZBED6 基因转录的调控元件。2.4 第1 轮系列长度缺失载体的构建 如图3 所示,第6 泳道是最长的原始片段pA(-2053/-21),长度为2 032 bp,从右至左,依次截短,至第1 泳道为最短的pH 片段,长度为1 441 bp。
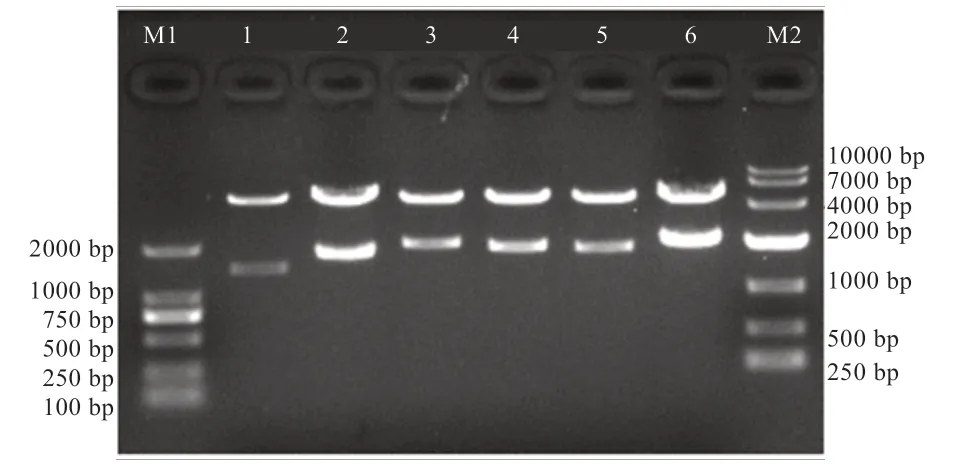
图3 民猪ZBED6 基因启动子截短型报告基因质粒酶切鉴定图谱
2.5 第1 轮系列载体的双荧光素酶活性分析 如图4 所示,重组质粒pB(-1897/-21)-ZBED6 和pC(-1863/-21)-ZBED6(P<0.05)、pC(-1863/-21)-ZBED6(P<0.05)和pD(-1808/-21)-ZBED6(P<0.05)、pD(-1777/-21)-ZBED6 和pG(-1808/-21)-ZBED6(P<0.01)之间的双荧光素酶活性存在显著差异,预测-1 897~-1 863 bp、-1 863~-1 808 bp 以 及-1 808~-1 777 bp 存 在 调 控ZBED6 基因转录的增强子,其中-1 808~-1 777 bp 片段距离“ATG”起始密码子最近,而且该片段的缺失造成了启动子活性的极显著降低,因此后续研究主要以该片段为主。
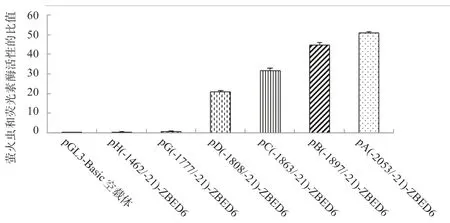
图4 截短型启动子荧光素酶活性分析
2.6 第2 轮系列长度缺失载体的构建及双荧光素酶活性的测定 根据第1 轮重组质粒的双荧光素酶活性测定结果,推测在-1 808~-1 777 bp 存在1 个正调控元件,据此构建第2 轮系列长度缺失载体。如图5 所示,pD 截短至pE 后启动子活性降低(P<0.01);pE 截短至pF后启子活性降低(P<0.05);pF 截短至pG 后启动子活性降低(P<0.05)。根据荧光信号的强弱,推测pD 和pG 之间即-1 808~-1 777 bp 存在重要的转录增强子,尤其是-1 808~-1 800 bp。
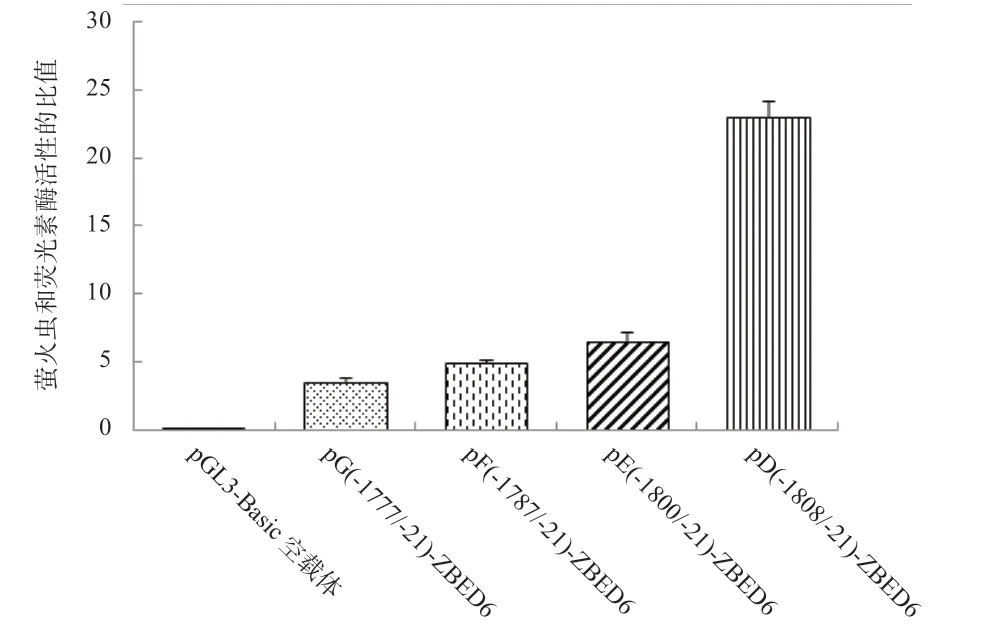
图5 截短型启动子荧光素酶活性分析
2.7 核心区域的调控元件预测 根据上述检测结果,利用在线生物学软件对-1 808~-1 777 bp 区间潜在的转录因子结合位点进行了预测。综合3 个网站的预测结果,初步选定结合位点为-1 805~-1 798 bp 的Adf-1、-1 814~-1 803 bp 的HINFP 和-1 787~-1 774 bp 的CREB3 作为潜在的转录调控元件开展下一步研究。
2.8 潜在的转录元件缺失突变分析 以pA(-2053/-21)-ZBED6 质粒为模板,以重叠延伸PCR 中第3 轮扩增用的A 和RS 为引物,扩增片段,连入pGL3-Basic 载体,构建阳性对照重组质粒(-2053/-1565)-pGL3,以pGL3-Basic 空载体为阴性对照,同时检测阳性对照、阴性对照和各转录元件缺失报告基因载体的双荧光素酶活性。如图6 所示,缺失CREB3、Adf-1 和HINFP 转录元件后,双荧光素酶活性均显著降低(P<0.05)。
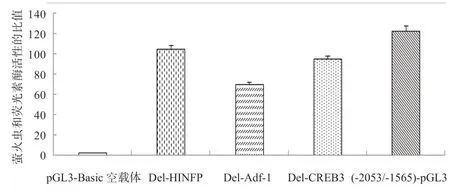
图6 不同元件缺失对ZBED6 基因启动子活性的影响
3 讨 论
真核生物的启动子包括核心启动子区和上游序列区,核心启动子区位于结构基因的5'端上游,能活化RNA 聚合酶,使之与模板DNA 准确地结合并具有转录起始的特异性,在该区内还存在许多短的核苷酸序列,为转录因子结合位点[7]。转录因子是基因表达调控过程中的重要调节因子,它与RNA 聚合酶Ⅱ形成转录起始复合体,共同参与转录起始过程。转录因子主要分为2种,一种是非特异性转录因子,非选择性的调控基因转录;另一种是特性转录因子,它们能够选择性地调控某种或某些基因的转录。同时,不同的转录因子之间还可以通过多种方式相互结合,为这一调控过程提供了更多的可能[8]。
大约在2 亿年前,一个DNA 转座子整合到一种原始哺乳动物的基因组中,数百万年后,它在所有胎盘哺乳动物的共同祖先中进化出一种基本的功能[9],这个转座子现被命名为ZBED6,在多个组织内广泛表达,是非特异性转录因子。Huang 等[10]发现,黄牛的ZBED6基因的启动子核心区位于-866 bp~-556 bp,其-826G>A的突变会造成转录因子PLZF 结合位点的改变,野生型M-826G-pGL3 的启动子活性显著高于突变型。ZBED6最早是在猪的肌肉组织中发现的,为了全面深入了解该转录因子的遗传学特性,本研究采用系列截短的方式,筛选民猪ZBED6 基因的核心启动子区。
最初,根据传统经验构建了一段长约1 000 bp 的ZBED6 基因5'端上游序列的报告载体,但经双荧光素酶检测后发现,此片段无启动子活性。随后,将片段延伸至上游2 000 bp,再次检测发现此片段具有明显的启动子活性,说明转录因子在ZBED6 启动子区上的识别位点距离编码区较远。通过构建一系列缺失片段的报告载体,最终发现该基因上游启动子区从-1 808 bp 至-1 777 bp 的片段具有明显的启动子活性,推测调控ZBED6基因转录的反式作用因子位于-1 808~-1 777 bp。利用在线软件预测及双荧光素酶实验验证发现,定点缺失掉Adf-1、HINFP 和CREB3 转录因子的结合位点后,ZBED6 基因的启动子活性均发生显著降低,尤其是Adf-1 转录因子结合位点的缺失,启动子活性下降最为显著,预测结果与验证结果基本一致。
转录因子HINFP 是一个具有2 种不同功能的转录因子,根据细胞环境不同,可以激活或抑制靶基因的转录,但其通常需与其他物质形成复合体后才能发挥作用。如在细胞周期由G1 期向S 期转变的过程中,HINFP 需与NPAT(Nuclear Protein Ataxia-Telangiectasia)蛋白形成转录复合体后才会作用于组蛋白H4 的启动子[11]。转录因子Adf-1 是Myb 基因家族的一员,Myb 基因家族是一类重要的转录因子家族,广泛分布在动物、植物、真菌和原生生物中,是植物中最大的一类转录因子,参与植物发育和代谢的网络调节等生命过程。Adf-1 可通过调节细胞粘附和mRNA 转运2 个关键过程控制果蝇大脑内树突的发育[12]。转录因子CREB3 是ATF(激活转录因子)/CREB(cAMP 反应元件结合蛋白)家族中重要的一员,是真核生物中广泛存在的一类基础转录因子,该家族共同的结构特征是碱性亮氨酸拉链(bZIP)模体。该家族蛋白涉及到细胞的增殖、分化、凋亡、胞外刺激和应激反应等细胞生命过程[13]。
4 结 论
民猪ZBED6 基因的转录调控机制较为复杂,其启动子区存在HINFP、Adf-1 和CREB 3 等多个调控元件的结合位点。
