川芎嗪联合CIK细胞对裸鼠肝癌HepG2细胞的影响*
2019-07-17卢彦达曾江正桑圣刚
黄 芬,王 波,卢彦达,曾江正,桑圣刚
(1.海南医学院第一附属医院,海南 海口 570102; 2.海南省人民医院,海南 海口 570102)
川芎主要成分为川芎嗪,具有活血行气、祛风止痛功效,临床多用于治疗瘀血阻滞的各种病症,称为“血中气药”[1]。细胞因子诱导的杀伤(CIK)细胞是新型免疫活性细胞,增殖能力强,细胞毒作用强,具有一定的免疫特性,拟用于心血管、呼吸系统、消化系统及泌尿系统疾病的治疗[2-3]。本研究中分析了川芎嗪联合CIK细胞对裸鼠肝癌HepG2细胞的影响。现报道如下。
1 材料与方法
1.1 动物、细胞、仪器与试药
动物:裸鼠 46 只,雄性,(5.5±0.67)周龄,体质量175~225 g,由南华大学医学院动物实验中心提供,实验动物生产许可证号为SCXK(湘)2004-0009。在无特殊病原菌条件下分笼饲养,自由进食、饮水,适宜温度、湿度,人工黑暗和光照交替。
细胞:HepG2细胞(上海纪宁实业有限公司);PB003F-C单个核细胞(美国Allcells公司)。
仪器:HN-25S型CO2恒温培养箱(青岛聚创世纪环保科技有限公司);IN Cell Analyzer 2500HS型高内涵细胞成像分析系统(美国 Molecular Devices公司);xCELLigence RTCA SP型实时无标记细胞功能分析仪(美国 ACEA Biosciences公司);LWD300-38LT型倒置生物显微镜(西安测维光电技术有限公司)。
试药:盐酸川芎嗪氯化钠注射液(湖南康都制药有限公司,国药准字H20041437,规格为每100 mL含盐酸川芎嗪40 mg);细胞迁移分析试剂盒(美国Biovision公司,货号为K906-100);DMEM培养基、胰蛋白酶及胎牛血清(美国Gibco公司);4%多聚甲醛(美国Sigma公司);注射用氨西林钠(湖南科伦制药有限公司,国药准字H43022217,规格为每支1.0g);其余试剂均为分析纯。
1.2 方法
HepG2细胞培养:将HepG2细胞接种于含10%胎牛血清的高糖DMEM培养基中,于37℃、5%CO2条件下培养,壁贴,放置2~3 d。
CIK细胞培养:用完全培养液(100 mL/L胎牛血清,50 mg/L 注射用氨西林钠,10 mmol/L Hepes缓冲液,50 μmol/L 2-疏基乙醇)将外周血单个核细胞(PBMC)密度调至 1.5 ×109/L,在 CO2恒温培养箱中培养24 h,即得CIK细胞。
模型建立及分组、给药:取对数生长期的HepG2细胞进行试验。将HepG2细胞经0.25%胰蛋白酶消化后接种于裸鼠皮下,其消化过程为将无血清的DMEM培养液重悬细胞并接种于事先预备的孔板上,再将培养板置其上作用30 min后注入裸鼠皮下。建模成功后,按随机数字表法分为川芎嗪50 mg/L联合CIK细胞组(A组)、川芎嗪100 mg/L联合CIK细胞组(B组)和川芎嗪200 mg/L联合CIK细胞组(C组),各12只,灌胃给药3次,间隔8 h;经尾静脉一次性输注1.5×107个CIK细胞。另将10只建模成功裸鼠设为模型组(D组)。
1.3 观察指标
细胞侵袭和迁移能力:采用DMEM培养基调整细胞浓度后再次加入细胞悬液,培养24 h,用磷酸盐缓冲液(PBS)清洗,重复2次,加4%多聚甲醛固定15 min,染色,显微镜下观察细胞迁移情况,并计算迁移抑制率。细胞迁移抑制率=(D组迁移或侵袭细胞数-用药组迁移或侵袭细胞数)/D组迁移或侵袭细胞数×100%。
基质金属蛋白酶-2(MMP-2)和基质金属蛋白酶抑制剂-2(TIMP-2)蛋白水平:采用流式细胞仪检测,激发波长为488 nm,采用Expo 32 ADC系统分析免疫荧光数据,结果均取平均值[4]。
细胞骨架蛋白-肌动蛋白微丝:采用IN Cell Analyzer 2500HS高内涵细胞成像分析系统检测,取消毒后的钛板,置一次性培养皿中,接种细胞悬液8 mL,培养后转至一次性培养皿中用PBS清洗,清洗2次后采用封闭液封闭60 min后染色,采用显微镜观察,采用Leica TCS软件测量视野中细胞的铺展面积。
1.4 统计学处理
采用SPSS22.0统计学软件分析。计量资料以表示,行t检验;计数资料以率(%)表示,行 χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞侵袭和迁移能力
与D组比较,B组和C组迁移和侵袭细胞显著减少,抑制率显著升高(P<0.05)。详见表 1。随着时间的增加,A组、B组和C组细胞迁移数均明显低于D组,且C组<B组<A组,迁移率与时间及剂量呈正相关。详见图 1 和表 2。
表1 各组细胞侵袭和迁移能力比较(±s)
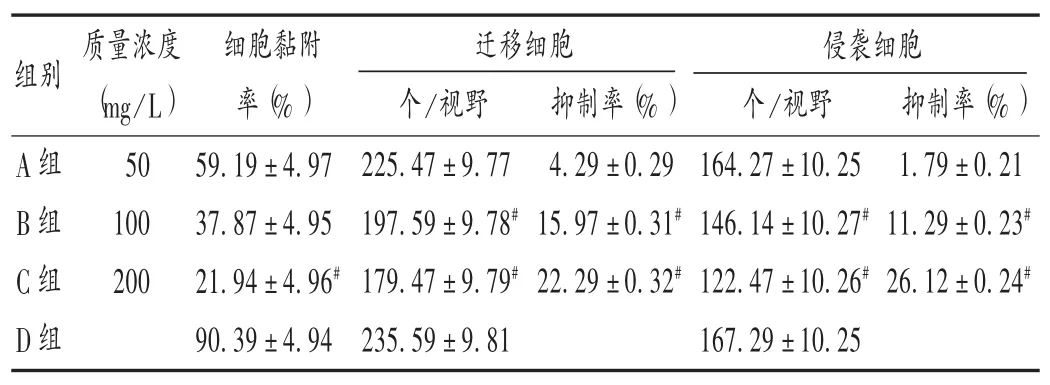
表1 各组细胞侵袭和迁移能力比较(±s)
注:与D组比较,#P<0.05。下表同。
?
表2 各组细胞侵袭情况比较( ± s,个/视野)
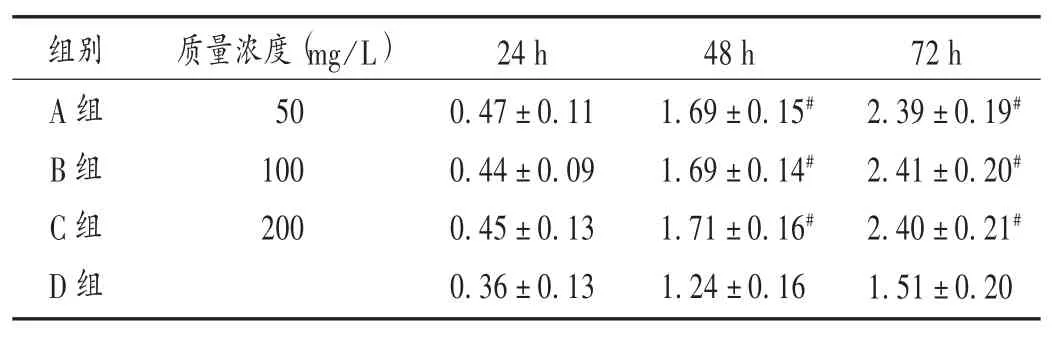
表2 各组细胞侵袭情况比较( ± s,个/视野)
组别A组B组C组D组质量浓度(mg/L)50 100 200 24 h 0.47±0.11 0.44±0.09 0.45±0.13 0.36±0.13 48 h 1.69±0.15#1.69±0.14#1.71±0.16#1.24±0.16 72 h 2.39±0.19#2.41±0.20#2.40±0.21#1.51±0.20
2.2 MMP-2和TIMP-2蛋白表达水平
与D组比较,A组、B组、C组细胞MMP-2蛋白表达显著降低,TIMP-2蛋白表达水平显著升高(P<0.05)。详见表 3。
2.3 细胞骨架蛋白-肌动蛋白微丝
与D组比较,A组、B组、C组细胞骨架蛋白-肌动蛋白微丝面积显著缩小(P<0.05)。详见表 3。
3 讨论
侵袭与转移是恶性肿瘤发展过程中的危险阶段,一旦出现将对预后造成严重影响[5]。细胞黏附性丧失及细胞骨架重建均会导致细胞运动和迁移[6-7]。川芎为无色针状结晶,对心脏、血管(尤其是冠状动脉)及脑部等部位病变有一定改善作用[8]。川芎嗪能抑制乳腺癌、肺癌细胞的体外增殖,作用机制为抑制肿瘤新生血管形成、抑制肿瘤细胞繁殖及逆转肿瘤细胞耐药性等[9]。CIK细胞是影响肿瘤的归巢能力及异常肿瘤微环境的重要因素[10]。

表3 各组细胞MMP-2蛋白和TIMP-2蛋白表达水平及细胞骨架蛋白-肌动蛋白微丝面积比较(±s)
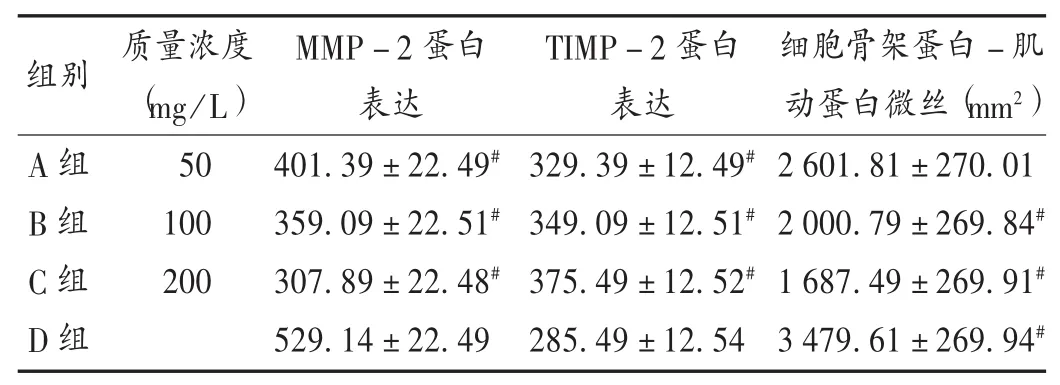
表3 各组细胞MMP-2蛋白和TIMP-2蛋白表达水平及细胞骨架蛋白-肌动蛋白微丝面积比较(±s)
?
本研究结果显示,随川芎嗪质量浓度的增加,HepG2细胞侵袭和迁移能力逐渐降低,且川芎嗪联合CIK细胞作用72 h后抑制细胞侵袭能力明显强于24 h后,说明川芎嗪可抑制HepG2细胞的迁移及侵袭,进而具有抗肿瘤转移作用。A组、B组、C组的MMP-2蛋白表达水平均明显低于D组,但TIMP-2蛋白表达水平均明显高于D组,显示MMP-2表达量降低时,TIMP-2表达量会随之升高。细胞骨架是由蛋白纤维交织而成的立体网架结构,并充满整个细胞质,细胞骨架与细胞膜及核膜存在结构联系,能保持细胞形状,且细胞骨架与细胞运动具有一定联系;微管、微丝和纤维是组成细胞骨架主要结构,微丝在肿瘤细胞中被修饰,与肿瘤细胞生长特点相关,而肌动蛋白是构成微丝的主要成分,在细胞迁移及侵袭中起至关重要的作用[11]。本研究中,A组、B组、C组裸鼠的细胞骨架蛋白-肌动蛋白微丝面积明显小于D组,川芎嗪联合CIK细胞能降低肝癌HepG2细胞骨架面积,可通过调节细胞松弛素达到减少微丝形成的目的,但川芎嗪联合CIK细胞是否可以获得新的间质表型仍有待研究。
综上所述,川芎嗪联合CIK细胞能抑制裸鼠HepG2细胞迁移及侵袭,作用机制可能与下调细胞MMP-2和上调TIMP2蛋白表达,以及抑制骨架微丝重排有关。
