全自动血细胞分析流水线管理系统的应用*
2019-07-16张鑫垚李建英岳保新
张鑫垚 肖 盟 李建英 黄 媛 王 庚 岳保新 李 杰 吴 卫*
全自动血液分析设备是检验科最为基础的设备,设备的自动化为检验科的工作人员提供了便捷化的工作,同时也缩短了患者等候检验报告的时间。XN 9100型全自动血细胞分析流水线管理系统,由4组XN-20全自动模块式血液体液分析仪,一台TS-10标本分拣单元与两台SP-10全自动血液学载片制备装置组成。本研究在使用XN 9100型全自动血细胞分析流水线管理系统的过程中,利用实验室信息系统(laboratory information system,LIS)与科室工作流程相结合,对其进行统筹化、智能化及自动化的管理,不仅为检验科的细胞学检验提供了便捷,同时还可缩短患者等候检验报告的时间。
1 全自动血细胞分析流水线管理系统
1.1 流水线构成
XN 9100型全自动血细胞分析流水线管理系统的流水线由两条ST40轨道单元、TS-10标本分拣单元、XN 9100型全自动模块式血液体液分析仪和搬送单元、SP-10全自动血液学载片制备装置模块单元以及DI-60型全自动细胞形态分析仪构成。
(1)TS-10标本处理单元。TS-10标本的分拣单元可以自动从进样单元接收标本架,将不同项目的标本管分拣出来,储存在归档区或将运送至下一个处理单元中。
(2)XN 9100型全自动血细胞分析流水线检测模块部分。XN 9100型全自动血细胞流水线包含分析仪器XN-20、SP-10全自动血涂片制备仪和传输系统。检测模块部分为4台XN-20设备串联组成,在处理CBC+DIFF模式下(不应用3R复检规则)每台XN-20处理标本速度为200个标本/h,流水线综合处理速度达800个标本/h。
(3)SP-10全自动血液学载片制备装置两台。SP-10是一种全自动载片制备装置,用于血液学分析系统。
(4)轨道系统。由多个连接部构成,经过安装调平,满足设备正常运转。
1.2 软件系统
软件辅助系统包含轨道控制系统、设备IPU、Laboman及传输端口系统等,通过条码识别,进行双向传输功能。
2 全自动血细胞分析流水线管理系统的验证
2.1 标本收集
随机选取门诊及住院患者EDTA抗凝血常规检测标本。
2.2 仪器与试剂
采用的XN 9100型全自动血细胞分析仪、流水线、配套试剂、标准品、质控品均为日本希森美康公司;Baso瑞氏-姬姆萨染色液(珠海贝索生物技术有限公司)。所有试剂均在有效期内使用。
2.3 仪器校准
(1)校准。按照国家相关行业标准执行校准,取一瓶校准品连续测定11次,取2~11次结果,将结果录入表中[1]。偏差计算为公式1:
偏倚%=(均值-定值)÷定值×100% (1)
(2)参数判定。白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)、血红蛋白(haemoglobin,HGB)、红细胞压积(hematocrit,Hct)、血小板(platelet,PLT)各参数均值与定值的差异全部等于或小于国家标准文件[1]的第1列数值时,仪器不需进行调整,记录检测数据即可;若各参数均值与定值的差异大于表中的第2列数值时,需请仪器维修人员检查原因并进行处理;若各参数均值与定值的差异在表中第1列与第2列数值之间时,需对仪器进行调整,将仪器原有系数乘以校准系数,即为校准后的系数(见表1)。将校准后的系数输人仪器更换原有系数。
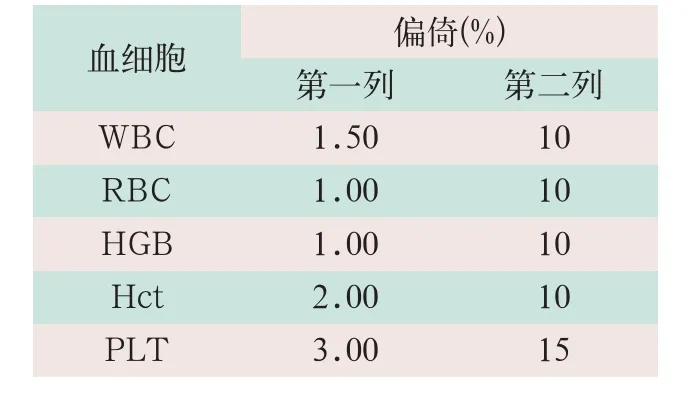
表1 血细胞分析校准的判定标准
2.4 性能评价方法
使用设备配套试剂,通过对设备的精密度、携带污染率、准确度、正确度、线性与内部操作检测系统仪器间的比对、WBC分类计数以及参考范围等进行验证,结果与设备厂商声称的性能及国家制定的相关行业标准要求[2-3]进行比较。
2.4.1 精密度评估
(1)批内精密度。收集WBC、RBC、HGB、平均红细胞体积(mean corpuscular volume,MCV)、PLT、平均红细胞血红蛋白(mean corpuscular hemoglobin,MCH)、平均红细胞血红蛋白浓度(mean corpuscular hemoglobin concentration,MCHC)正常、异常以及参考医学决定水平浓度3个水平新鲜血标本连续测定11次,将后10次结果录入下表,计算均值、标准差和变异系数(CV%)见表2。
(2)日间精密度。使用3个(正常、低、高)水平质控品,每日测定1次,将质控数据录入,记录20个点,计算CV%。
2.4.2 携带污染率
(1)实验方案。取高值血液样本,测定值分别为H1、H2及H3,再取一份低值血液样本,连续测定3次,测定值分别为L1、L2及L3,按公式计算携带污染率。
(2)判定标准。各检测参数的携带污染率≤1%,其计算为公式2:

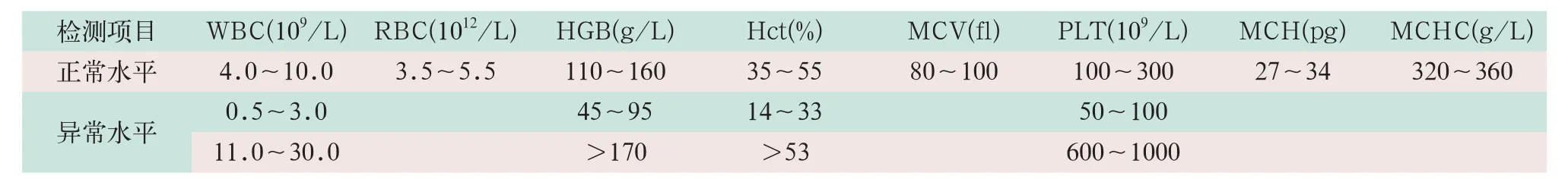
表2 标本收集范围
2.4.3 准确度评估
(1)实验方案。使用5份美国病理家协会(CAP)质评物分别进行单次检测,计算每份样本检测结果与靶值的相对偏差。
(2)判断标准。相对偏差符合WBC≤15%、RBC≤6.0%、HGB≤7.0%、PLT≤25%、Hct≤6.0%、中性粒细胞百分比(Neutrophil%,NEUT%)±3SD、NEUT绝对值(NEUT#)±1.0、淋巴细胞百分比(Lymphocytes%,LY%)±3SD、LY绝对值(LY#)±1.0、单核细胞百分比(Monocyte%,MO%)±3SD、MO绝对值(MO#)±1.0、嗜酸性粒细胞百分比(Eosinophil%,EO%)±3SD、EO绝对值(EO#)±1.0、嗜碱性粒细胞百分比(Basophils%,BASO%)±3SD、BASO绝对值(BASO#)±1.0、MCV±3SD、MCH±3SD、MCHC±3SD要求的比例≥80%[2]。
2.4.4 正确度评价
(1)实验方案。使用10份检测结果在参考区间内的新鲜血样本,每份样本检测2次,计算20次检测结果的均值,以临床实验室内部规范操作检测系统的测定均值为标准,计算偏倚。实验室内部规范操作检测系统使用Sysmex-XE5000型全自动血液分析仪(日本希森美康公司),SN:A3098。
(2)判断标准。允许偏倚:WBC≤5.0%、RBC≤2.0%、Hb≤2.5%、Hct≤2.5%、PLT≤6.0%、MCV≤3.0%、MCH≤3.0%、MCHC≤3.0%、MPV≤5.0%、PCT≤5.0%[2]。
2.4.5 线性评价
(1)实验方案。线性评价:使用CAP LN9制备不同浓度的样品,对每个检测项目、每一浓度水平重复测定3次,计算均值、SD、MAX、MIN、T值、测定值与靶值的差值、总均值以及拟合值,判断最优拟合方程。计算每一检测项目,总误差绝对值计算为公式3:
总误差绝对值=总误差%×总均值 (3)
对每个检测项目将每一浓度的差值与总误差进行比较,对不精密度的可接受性做出判断。验证线性范围,并以相对浓度为X轴,测定均值为Y轴做线性图;以靶值为X轴,测定均值为Y轴做线性图;以相对浓度为X轴,差值为Y轴做绝对偏差与不精密度可接受范围图。使用患者标本制备不同浓度样品:选择高浓度(H)值接近线性范围上限的样本,低浓度(L)值选择接近0或接近检出限的标本,确定需要分析的总体积,按0%、10%、20%、40%、60%、80%以及100%配制成不同水平的样品(或按稀释方案配制),做线性评价。
(2)判断标准。线性评价:1/4 CLIA’88允许总误差作为可接受范围[2]。判断每个浓度的测定值是否可接受,以靶值为X,测定均值为Y,其计算回归方程为公式4:

式中若相关系数r≥0.975,r2≥0.95,a在1±0.05范围内,则结果为可接受。
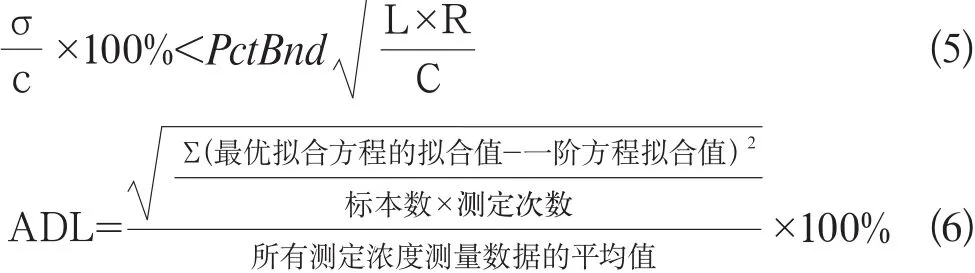
不精密度判断为公式5、公式6:
2.4.6 实验室内部规范操作检测系统仪器间比对
(1)实验方案。选择内部规范操作检测系统仪器作为比较方法。新仪器使用前,参考相关国家标准中的浓度范围和比例(见表3),至少收集20份临床标本,每份2 ml[2]。分别使用内部规范操作检测系统仪器和被比对仪器(试验方法)进行检测。以内部规范操作检测系统的测定结果为标准,计算相对偏差,并以可比较方法为X,以试验方法为Y,计算相关系数(r),斜率(slope),截距(b)。
(2)判断标准。r≥0.975(或r2≥0.95);相对偏差符合≤1/2CLIA'88[2];WBC≤7.5%,当WBC≤2.0×109/L时,相对偏差≤10.0%,RBC≤3.0%,HGB≤3.5%,PLT≤12.5,当PLT≤40×109/L时,相对偏差≤15%,Hct≤3.0%、MCV≤3.5%、MCH≤3.5%、MCHC≤3.5% 要求合格的比例≥80%[2]。
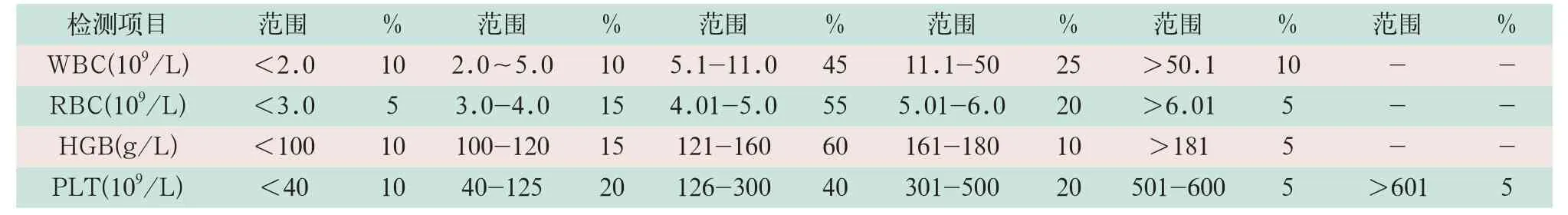
表3 标本收集浓度范围和比例
2.4.7 分析仪WBC分类计数性能评价
参考方法和仪器法比较试验。
(1)实验方案。初次验证选新鲜标本20份,每例患者的血液样本分别用参考方法和仪器法进行测试。每份标本制备2张血涂片,分别标记为A、B。由2名具备科室授权且经过考核的检验人员,按照参考方法步骤对每张血涂片分析200个细胞。其中一位检验人员使用血涂片A,另一位验人员使用血涂片B,每份患者标本共分析400个细胞。仪器法结果记录为C。
(2)判断标准。计算仪器法检测结果的均值与可信范围比较,在95%可信区间的允许范围内,判定合格;若仪器法的数据点落在可信区间外侧,判定不合格,必须检查准确度。分类5%以下细胞查《临床检验基础》第4版中的Rümke表[4];分类200个细胞时,0%的95%置信区间(confidence interval,95%CI)为0~1.8,1%的95%CI为0.1~3.6,2%的95%CI为0.6~5.0,3%的95%CI为1.4~6.4,4%的95%CI为1.7~7.7。要求合格的比例≥80%[2]。计算为公式7:

可信范围:参考值±1.96×SE。
2.4.8 参考区间验证
从查体人群中选择健康个体46名,男性与女性比例为1∶1,年龄20岁~79岁,每10岁年龄段的参考个体数至少4名(将60~79岁分在一个年龄段)。
(1)验证方案。按规范操作程序采集静脉血标本并进行待验证项目的检测,计算均值、最小值、最大值、极差(R)、最大和最小值与其相邻数值之差D。离群值检验:首先将检测结果按照大小排序并计算极差R(R=最大值-最小值),然后分别计算最大和最小值与其相邻数值之差D(D=疑似离群值-其相邻值);若D/R≥1/3,则将最大值或最小值视为离群值予以剔除;将余下数据重复前述步骤进行离群值检验,直至剔除所有离群值。因出现离群值而造成检测数据不足20个时,应另外选择符合要求的健康个体以补足20个,确保检测结果不含离群值。
(2)判断标准。将检测数据与参考区间进行比较,超出参考区间的检测数据个数≤10%,验证结果符合要求。
2.4.9 检出限验证
(1)实验方案。选稀释液作为空白样品连续测定10次,依据制造商声称的浓度配制WBC浓度分别为0.02×109/L和0.01×109/L的低值样本,PLT为2.0×109/L和1.0×109/L的低值样本,使用WB及LW模式分别测定WBC,每一样本连续测定10次;使用WB及PLT-F模式分别测定PLT,每一样本连续测定10次。分别计算每一样本的均值、标准差、变异系数、百分偏差、LoB、LoD及LoQ,其计算为公式8和公式9:

式中LoQ为分析物可被实际检出(LoD)的最低浓度。检测限样本测定结果变异系数等于20%时的分析物浓度。
制造商LoQ:WBC:0.019×109/L;PLT-I:1.566×109/L;PLT-F:0.862×109/L。
3 结果
XN 9100流水线中共包含8台全自动模块式血液体液分析仪,结果分析仅以一台A1型设备为代表,SN:12864。
3.1 实验室环境
实验室温度为24 ℃,相对湿度为40%。
3.2 仪器背景计数
实验方案:使用稀释液作为样本在分析仪上连续进行3次测试,取3次测试结果中最大值,见表4。
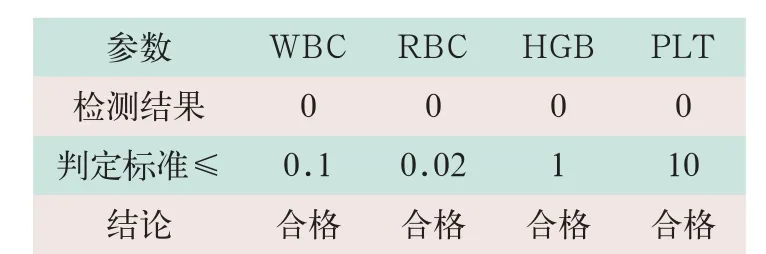
表4 仪器背景计数结果
3.3 仪器校准验证
使用校准品对仪器验证后,对超出偏倚范围的参数调整校准系数,进行校准结果验证,验证结果均合格。
(1)精密度评估。设备各参数批间精密度及日间精密度三个水平CV均满足国家相关行业标准的要求[1]。
(2)携带污染率。各项参数携带污染率分别为,WBC:0.01%,RBC:0.18%,HGB:0.51%,Hct:0.00%,PLT:0.30%,携带污染率均符合要求。
(3)准确度。五份质评物检测结果,各参数偏差均小于判断标准要求,均在可接受范围内。
(4)正确度。设备各参数正确度偏倚结果均低于接受标准。
(5)线性评价。设备各参数线性方程中,a值均在1±0.05范围内,r2均>0.95。
(6)实验室内部规范操作系统仪器间比对结果及分类计数的性能评价。实验室内部仪器间比对结果相对偏差均小于要求,且比例>80%,分类计数结果均在95%可信区间的允许范围内。
3.4 参考区间验证
经验证,超出参考区间范围的仅有一例,远低于要求,验证结果符合要求。
3.5 检出限验证
(1)WBC LOQ:使用WB模式WBC为0.02×109/L定量检测下限验证未通过,使用LW模式WBC为0.02×109/L及0.01×109/L定量检测限LOQ验证均通过;最低浓度为0.01×109/L时,CV为0,小于判断标准(20%),因此认为本次LOQ=0.01×109/L,验证通过。故临床样本的检测,依据复检规则遇低值WBC时使用LW模式检测。
(2)PLT LOQ:使用WB模式PLT为2×109/L及1×109/L定量检测下限验证均未通过,使用PLT-F模式PLT为1×109/L定量检测限LOQ验证通过;最低浓度为1×109/L时,CV为0,小于判断标准(20%),因此认为本次LOQ=1×109/L,验证通过。故临床样本的检测,依据复检规则遇低值PLT时使用PLT-F模式检测。
4 全自动血细胞分析流水线管理系统的应用
4.1 流水线复检规则的应用及自动重复功能
根据XN 9100型全自动血细胞分析流水线管理系统,将已有的复检规则进行重新评估,并运用到日常工作中[5-6]。
4.2 质量控制系统的改进
使用设备配套的Sysmex质控品。每日每台设备均需要进行质控品的检测,检测完毕后使用laboman系统传入科室实验室信息系统(laboratory information system,LIS)。每日生成L-J质控图,如失控,则需要对质量控制结果进行纠正。
4.3 设备X-bar的使用
浮动均值法是由BULL提出的一种室内质量控制方法[7]。此方法通过对20例患者标本的MCV、MCH及MCHC结果均值进行记录分析,用以判断设备的运行情况。如发现数据出现较大的波动或偏移,则应先检查标本来源是否有特殊性。如标本来源无明显改变的情况下,则表示可能仪器或者试剂在某些地方出现问题。需要及时查找原因,避免不合格报告的发出[8](图1)。
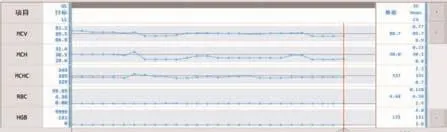
图1 浮动均值系统实际操作数据
4.4 设备灵敏度的调节
WDF通道是检测WBC的分类通道。在每个坐标轴均可调节其通道数,在对设备进行校准时,先进行光路校准,对设备通道的粒子数进行校准。根据校准品给出的赋值输入靶值,使其灵敏度在厂商给出的范围内。在设备的使用过程中,可能会出现部分细胞结果异常的情况。使用浮动均值的方法对设备灵敏度进行监控和调节,通过对X-bar中WDF-X,WDF-Y,WDF-Z的设置,改变每个坐标轴的通道数,从而调整图中粒子的位置来调整细胞分类的结果。
以XN 9100-8号机为例,SN:12864,根据校准后赋值,WDF-X SCC Gain:181,WDF-Y SFL Gain:113,WDF-Z FSC Gain:196。但根据浮动均值图形观察,其标点均在靶值下,进行“分析仪白细胞分类计数的性能评价”时出现大量“[Atypical Lympho?](异型淋巴细胞)”报警。经过人工推片进行镜检,均为假阳性报告,判断为灵敏度错误。进行更改后,重新对其进行赋值,WDF-X SCC Gain:172.4,WDF-Y SFL Gain:115.6,WDF-Z FSC Gain:124。重新进行检测后,靶值恢复正常。
由此可见,厂商提供的校准品并非对每台设备的数值均适用,各使用方均需要根据本实验室的情况对其赋值进行相应的更改,以保证结果的准确性。
4.5 新鲜血比对
设备每日使用过程中,所需试剂经常需要进行更换,更换试剂后无法有效的评估。如使用配套的质控品进行检测,成本较高。使用新鲜血比对的方法[9]可以节约成本,方法便捷,对多台设备间检测结果的准确性和可比性具有实际应用意义[10]。
每日取同血型检测结果在参考范围内的3个标本,配置成新鲜血比对标本。每日将新鲜血标本赋予一个唯一条码号。定时在每台分析仪使用手动模式进行检测,计算每个检测项目的Δ值,Δ值=(②-①)÷②。①为第一次检测结果;②为第二次检测结果。判定结果需符合1/2CLIA'88要求的偏差范围,WBCΔ≤±7.5%,RBCΔ≤±3%,HGBΔ≤±3.5%,HctΔ≤±3%,PLTΔ≤±12.5%,MCVΔ≤±3.5%,MCHΔ≤±3.5%,MCHCΔ≤±3.5%[2]。
5 全自动血细胞分析流水线管理系统的样本管理
5.1 样本处理规则
每日的工作中,XN 9100型全自动血细胞分析流水线主要进行门诊急诊的标本检测。每个样本均使用唯一标识,在LIS里录入后产生唯一编号。LIS同laboman通讯后,设备自动识别标识所对应的项目进行检测。检测后再由laboman传入LIS系统中。如未能在LIS中录入标本信息,则由设备先行对条码进行扫描,默认检测CBC+DIFF。检测完毕后由laboman传入LIS系统,LIS系统自动生成一个样本号,使结果可以完整传输,避免了人为因素导致标本未检测的情况。
5.2 样本后处理设定
标本检测完毕后,laboman系统根据复检规则,将标本信息传送至LIS与仪器中。LIS将此标本标记为待查标本,同时在界面中以黄色高亮提醒。如标本触发3R规则,则在界面中在待查的基础上此标本以蓝色本底标注,当仪器自动重复后,蓝色本底消失,同时在备注中标注“此标本已重复”。此举可避免在多人处理标本时,多次重复同一标本对试剂及时间造成浪费。如标本仅触发推片镜检规则,则可直接通过仪器轨道,进入到TS-10中进行归档,而后由专人进行推片镜检。
5.3 样本归档原则设定
在标本完成检测后,TS-10可对标本进行归档,避免手工编号归档可能带来的人为错误,同时使查询标本更为便捷。每份标本检测完成后,通过流水线轨道,将标本转送至TS-10处理模块中。TS-10处理模块根据标本检测结果信息,会将标本进行归档,同时所有标本均会在系统中产生唯一的TS-10标本位置号。通过产生唯一的标本位置号可以在LIS系统中进行查询,根据使用习惯,科室将其设置为XX区-XX托盘-XX位置。查询标本需要取用时,只需找到相应位置,即可直接获取标本。
TS-10处理模块共有8个区域设置。实验室将1-5区设置为标本归档区,定义为正常标本检测后归档区域。用以存放无需复查的标本。6-7区设置为待检区,定义为需要复检标本区域,包含需要推片及执行3R规则后仍需要复检的标本。8区为错误区。错误区包含:①未正确读取标本条码;②标本无法正确检测结果;③非检测全血细胞分析的标本。
6 结论
XN 9100型全自动血细胞分析流水线管理系统功能强大,可以满足每小时800个标本的工作量,同时流水线包含了自动推染片机,Sysmex的3R复检规则优化检测流程,缩短了TAT时间。TS-10处理模块可以在标本进入流水线前将错误标本挑出,在标本检测完毕后,对标本进行归档,完善了标本后处理的要求,方便对标本的查找。其通过与LIS系统的双向传输功能,避免了人为因素导致可能产生的标本丢失问题。通过整合LIS、laboman等信息化系统,实现了全程自动化和信息化。
随着信息化水平的不断提高,目前整个检验行业自动化发展越来越快,全自动血球分析仪流水线是必然产物[11-12]。而标本量的增加,TS-10的归档区域会更加紧张。在多架标本同时检测完毕后,同时准备归档,进样和归档使用同一条轨道,极易造成标本的阻塞。同时标本由TS-10归档后仍需要人工进行移除,保存于相应地点。目前,一些生化免疫流水线已经完全实现流水线到冰箱储存的无缝连接,且通过信息化系统可以自由的从冰箱中调取标本。而XN-9100型全自动血细胞分析流水线仅使用了归档、双向传输、自动化复检功能等,自动化程度有进一步提升的空间。
实验室在使用设备时也应注意仪器的维护保养工作,每日需要对设备进行关机清洗操作,擦拭设备表面灰尘等。定期预约工程师对设备进行预防性维护,按需更换配件。由于流水线轨道属于精密部分,平衡度很重要,故需要避免对流水线的磕碰和推挤。检验报告结果的准确性是更重要的一环,在提高了硬件水平的同时,需要注重对实验室人员的能力培养,定期进行培训。
