卒中后抑郁影响因素及其与脑源性神经营养因子基因多态性的关系研究
2019-07-15何明马飞月
何明,马飞月
卒中后抑郁(post-stroke depression,PSD)是卒中后常见并发症之一,其发生率为50%~60%[1],可严重影响患者的神经功能恢复及生活质量。PSD发病机制至今尚未完全清楚,可能与社会心理学、神经解剖学、神经递质、神经内分泌、神经再生、神经营养及炎性反应等多种机制有关[2]。近年研究发现,PSD存在遗传易感性[3],抑郁症患者血清脑源性神经营养因子(brainderived neurotrophic factor,BDNF)水平低于健康人群,提示BDNF可能与抑郁症有关[4],神经营养学假说推断BDNF基因多态性可能与抑郁症发生有关[5]。但目前有关BDNF基因多态性与PSD关系的研究报道较少。本研究选取就诊于上海瑞金-卢湾医疗联合体中心的卒中患者作为研究对象,旨在探讨PSD的影响因素及其与BDNF基因多态性的关系,为基层医疗机构早期识别PSD高危人群并开启长程管理工作及深入研究PSD发病机制等奠定基础。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)首次诊断为卒中;(2)PSD病程<1年;(3)认知功能正常。排除标准:(1)卒中前伴有抑郁症者;(2)合并肿瘤、感染、精神疾病者;(3)伴有心、肺、肾等重要脏器功能衰竭者;(4)伴有认知障碍、失语、视觉障碍及无法配合完成量表者。
1.2 一般资料 选取2015年7月—2018年6月上海交通大学医学院附属瑞金医院卢湾分院及其所属区域医疗联合体的3个卫生医疗机构门诊和住院部收治的缺血性卒中患者480例,均符合《各类脑血管病诊断要点》[6]中缺血性卒中的诊断标准,并经颅脑CT或磁共振成像(MRI)检查证实为单侧脑组织损伤。随访12个月(随访截至2018年12月),根据PSD发生情况将所有患者分为PSD组192例和非PSD组288例,抑郁的诊断参照《中国精神障碍分类与诊断标准》[7]中抑郁的诊断标准且汉密尔顿抑郁量表(HAMD)评分≥7分[8]。本研究经上海交通大学医学院附属瑞金医院卢湾分院医学伦理委员会审核批准,所有患者及其家属对本研究知情并签署知情同意书。
1.3 观察指标 收集所有患者一般资料(包括性别、年龄、抑郁症家族史、性格、受教育程度、居住地、家庭经济收入)、卒中相关情况〔包括梗死部位、梗死面积、美国国立卫生研究院卒中量表(National Institute of Health Stoke Scale,NIHSS)评分、TOAST分型、OCSP分型〕、社会支持评定量表(Social Support Rating Scale,SSRS)评分、改良Barthel指数(modified Barthel Index,mBI)评分、改良Rankin量表(modified Rankin Scale,mRS)评分、治疗情况(包括药物治疗和非药物治疗)及医疗费用支付方式(包括职工医保、居民医保、新农合及自费)。
1.4 评估工具
1.4.1 艾森格个性问卷(Eysenck Personality Questionnaire,EPQ) 采用EPQ评定患者性格,主要分为外向型和内向型。
1.4.2 Adama分型法 采用Adama分型法判定梗死面积,根据入院时颅脑CT/磁共振成像(MRI)检查结果分为大梗死(直径>3.0 cm并累及2个脑解剖部位)、小梗死(直径1.5~3.0 cm)、腔隙性梗死(直径<1.5 cm)。
1.4.3 NIHSS 采用NIHSS评估患者神经功能缺损程度,该量表包括意识水平、凝视、视野、面瘫、上肢运动、下肢运动、肢体共济运动、感觉、语言、构音障碍及忽视共11个条目,评分范围0~42分,NIHSS评分<6分为轻度神经功能缺损、6分≤NIHSS评分≤13分为中度神经功能缺损,NIHSS评分≥14分为重度神经功能缺损[9]。
1.4.4 SSRS 采用SSRS评价患者在社会生活中得到的心理支持程度及其支持利用情况,该量表包括10个条目,1、3、4、5为主观支持评分,2、6、7为客观支持评分,8、9、10为支持利用度评分。SSRS评分<20分为社会支持较少,20~30分为具有一般社会支持度,31~40分为具有满意社会支持度。
1.4.5 mBI 采用mBI评估患者日常生活能力,该量表包括进食、洗澡、修饰、穿衣、控制大便、控制小便、如厕、床椅移动、平地行走、上下楼梯共10个条目,评分范围0~100分,mBI评分0~20分为极严重功能障碍,25~45分为严重功能障碍,50~70分为中度功能障碍,75~95分为轻度功能障碍,100分为生活自理[10]。
1.4.6 mRS 采用mRS评估患者残疾程度,其中0~1分为明显残疾、2分为轻度残疾、3分为中度残疾、4分为重度残疾、5分为严重残疾。
1.5 BDNF基因多态性检测方法 采集两组患者禁食水12 h后外周静脉血3 ml,置于2%乙二胺四乙酸(EDTA)抗凝试管中,48 h内完成静脉血全基因组DNA提取工作。采用AU1001核酸提取仪及其配套试剂(北京百泰克生物技术有限公司生产)提取DNA,UV-7500双光束紫外可见分光光度计(上海棱光技术有限公司生产)鉴定DNA纯度和完整性,取吸光度(A260/280 nm)值在 1.5~2.0、浓度 >50 ng/μl的 DNA 样品待检。在GenBank数据库查找BDNF基因,采用Premier 5.0软件设计引物,引物合成由上海天昊生物科技有限公司完成。聚合酶链反应(PCR)反应体系为25 μl,含有60 ng DNA、2.5 μl dNTPs(2 mmol/L),PCR扩增反应条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火 30 s,72 ℃延伸30 s,共35个循环,72 ℃ 延伸5 min。取扩增产物25 μl,4 ℃保存,琼脂糖凝胶电泳,采用FR-250电泳仪(上海复日科技有限公司生产)扫描并拍照。采用iMLDR技术,取上述PCR扩增产物10 μl,采用美国应用生物公司(ABI)开发的SNaPshot技术测定BDNF rs6265、rs56164415、rs7124442、rs10835210 位点基因多态性。
1.6 统计学方法 应用SPSS 25.0统计学软件进行数据处理,应用SHEsis软件对BDNF rs6265、rs56164415、rs7124442、rs10835210位点进行Hardy-Weinberg平衡检验,以P>0.05为符合遗传平衡定律。计数资料分析采用χ2检验,PSD影响因素分析采用多因素Logistic回归分析。检验水准(双侧)α=0.05。
2 结果
2.1 PSD发生率及遗传学分析 本组患者PSD发生率为40.00%(192/480),其中卒中后1~3个月发生PSD 62例(占32.29%),3~6个月发生PSD 95例(占49.48%),>6个 月 发 生 PSD 35例( 占 18.23%)。BDNF rs6265、rs56164415、rs7124442、rs10835210 位点基因型分布频率符合Hardy-Weinberg平衡定律(χ2值分别为2.110、1.352、1.059、1.771,P>0.05),具有群体代表性。
2.2 BDNF不同位点基因型、等位基因分布频率比较两组患者BDNF rs6265位点基因型、等位基因分布频率及rs10835210位点基因型分布频率比较,差异有统计学意义(P<0.05);两组患者BDNF rs56164415、rs7124442位点基因型、等位基因分布频率及rs10835210位点等位基因分布频率比较,差异无统计学意义(P>0.05,见表 1~4)。

表1 两组患者BDNF rs6265位点基因型、等位基因分布频率比较〔n(%)〕Table 1 Comparison of genotypes and allele distribution frequency of BDNF rs6265 between the two groups
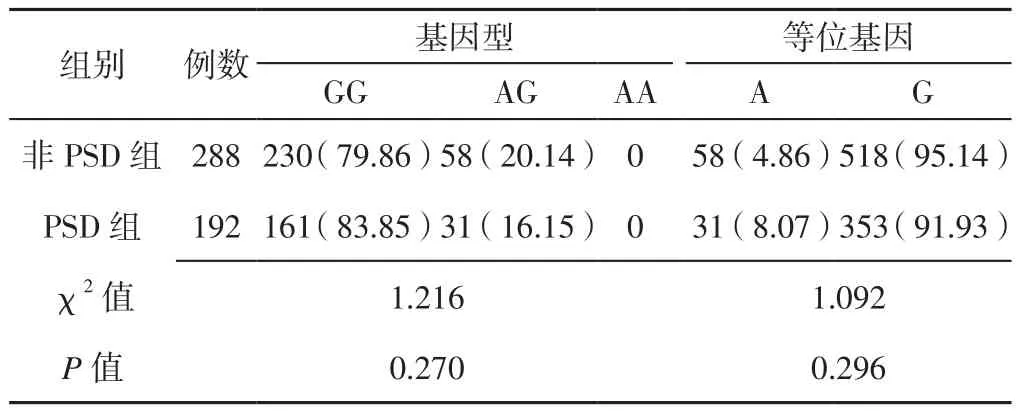
表2 两组患者BDNF rs56164415位点基因型、等位基因分布频率比较〔n(%)〕Table 2 Comparison of genotypes and allele distribution frequency of BDNF rs56164415 between the two groups
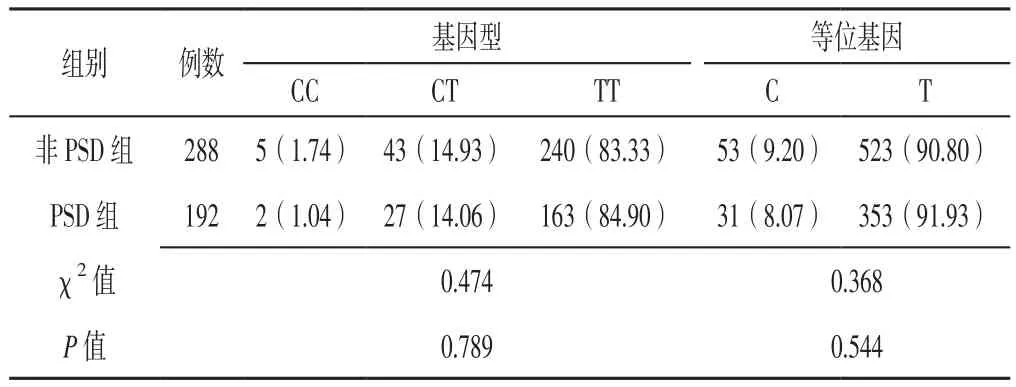
表3 两组患者BDNF rs7124442位点基因型、等位基因分布频率比较〔n(%)〕Table 3 Comparison of genotypes and allele distribution frequency of BDNF rs7124442 between the two groups
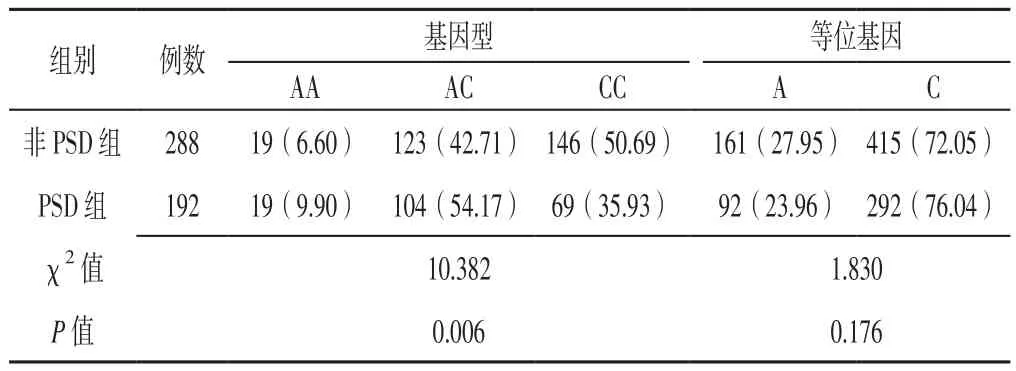
表4 两组患者BDNF rs10835210位点基因型、等位基因分布频率比较〔n(%)〕Table 4 Comparison of genotypes and allele distribution frequency of BDNF rs10835210 between the two groups
2.3 PSD影响因素的单因素分析 两组患者性格、居住地、TOAST分型、OCSP分型及治疗情况比较,差异无统计学意义(P>0.05);两组患者性别、年龄、抑郁症家族史、受教育程度、家庭经济收入、梗死部位、梗死面积、NIHSS评分、SSRS评分、mBI评分、mRS评分及医疗费用支付方式比较,差异有统计学意义(P<0.05,见表5)。
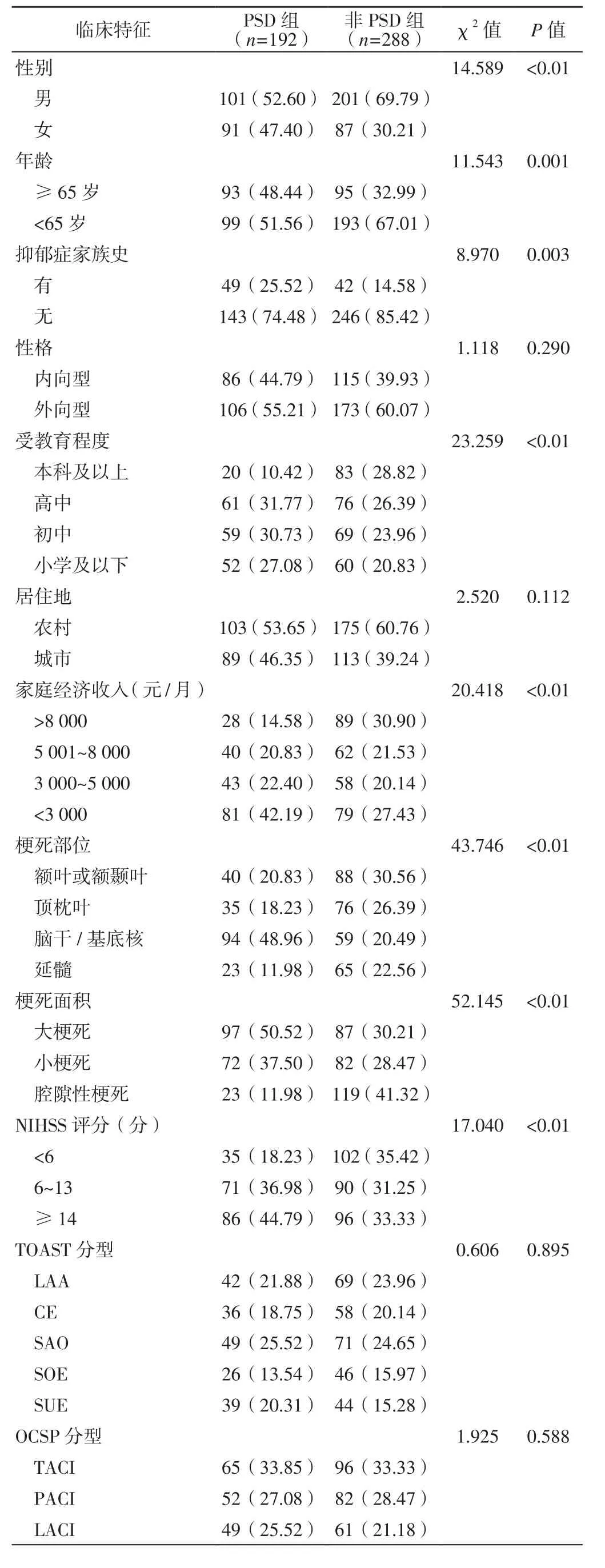
表5 缺血性卒中患者PSD影响因素的单因素分析〔n(%)〕Table 5 Univariate analysis on influencing factors of PSD in patients with ischemic stroke
2.4 PSD影响因素的多因素Logistic回归分析 将PSD作为因变量,将表1~5中有统计学差异的指标及性格作为自变量(变量赋值见表6)进行多因素Logistic回归分析,自变量入选采用逐步法,结果显示,性别、年龄、性格、脑干/基底核梗死、SSRS评分<20分、NIHSS评分≥14分、mBI评分,BDNF rs6265位点CT基因型和CC基因型,BDNF rs10835210位点AC基因型和AA基因型是缺血性卒中患者PSD的独立影响因素(P<0.05,见表7)。
3 讨论
急性缺血性卒中是全球范围内第二大死亡原因,其致残率、致死率均较高[11-12]。近年来随着我国社会老龄化进程加剧,卒中发病率正以每年8.7%的速度不断增长,且经积极治疗后仍有很大一部分患者遗留瘫痪、失用等功能障碍,严重影响患者的学习、工作和生活,甚至给家庭带来沉重的经济和精神负担。PSD是卒中的常见并发症,主要表现为情绪低落或烦躁、兴趣减退、入睡困难、噩梦、早醒、睡眠过度、晨醒、心境恶劣等,可严重影响患者治疗配合程度及治疗效果,部分患者存在自杀想法甚至有自杀行为,直接威胁患者生命安全。因此,明确PSD影响因素有利于医务人员早期识别、筛查PSD并及时干预。

(续表5)

表6 变量赋值Table 6 Variable assignment
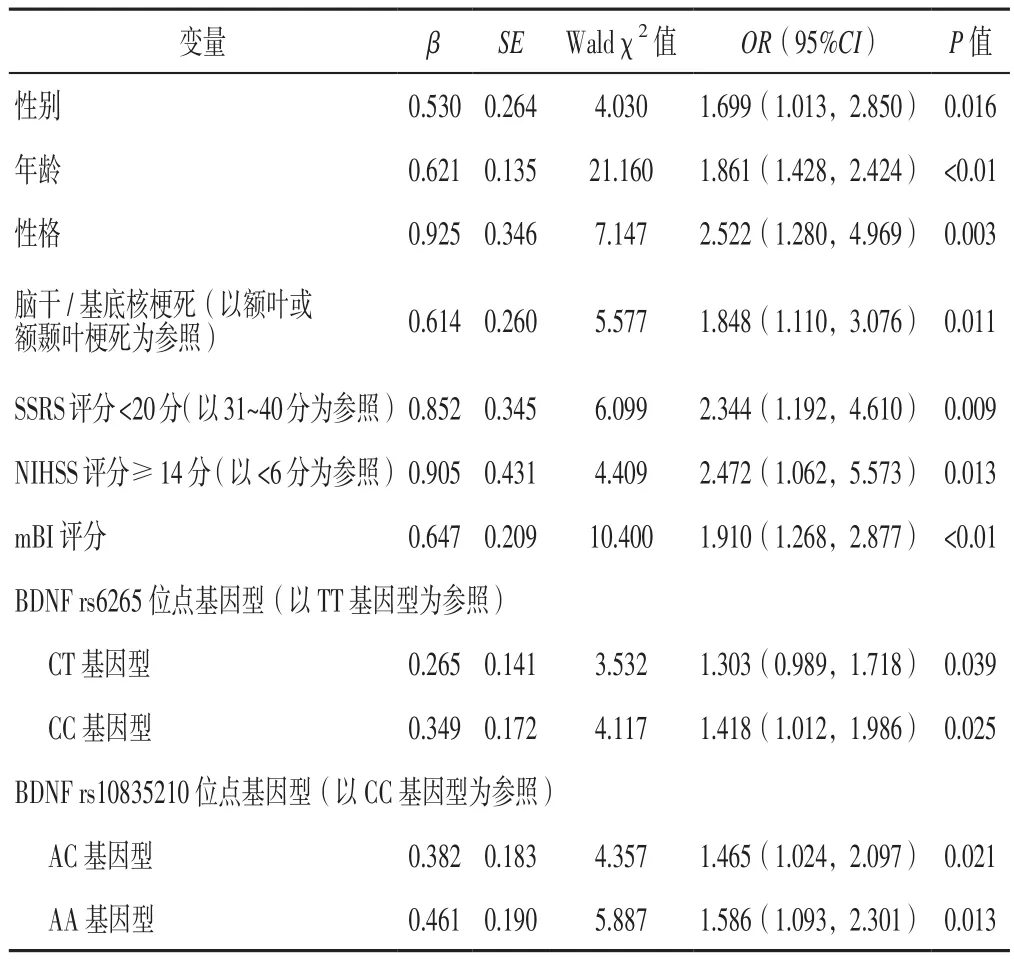
表7 缺血性卒中患者PSD影响因素的多因素Logistic回归分析Table 7 Multivariate Logistic regression analysis on influencing factors of PSD in patients with ischemic stroke
本组患者PSD发病率为40.00%,与NEKOUEI等[13]研究结果一致。结合本研究结果分析PSD影响因素如下:(1)单亚维等[14]研究结果显示,女性脑卒中患者发病12个月内PSD发生率为49.50%,高于男性脑卒中患者的28.60%;本研究结果显示,女性缺血性卒中患者随访12个月PSD发生风险是男性患者的1.699倍,分析其原因主要如下:应激状态下女性易发生神经内分泌紊乱,其次女性偏于内向型性格,有潜在的抑郁发生风险。(2)既往研究表明,PSD发生风险随年龄增长而升高[15-16];本研究结果显示,年龄≥65岁的缺血性卒中患者随访12个月PSD发生风险是年龄<65岁患者的1.861倍,分析其原因可能与高龄患者躯体疾病、心理承受能力日趋减退有关。(3)杜晋峰等[17]研究结果显示,PSD与人格特征有关,其中内向不稳定型性格是PSD的高危因素;本研究结果显示,内向型性格的缺血性卒中患者随访12个月PSD发生风险是外向型性格患者的2.522倍,从心理学角度分析主要为内向型性格不合群、悲观、孤僻、保守,因此突发事件后更易出现焦虑、紧张等不稳定情绪。(4)邹琴等[2]研究结果显示,脑干、基底核区梗死患者PSD发生风险分别是其他部位梗死患者的3.46、3.82倍;本研究结果显示,脑干/基底核梗死的缺血性卒中患者随访12个月PSD发生风险是额叶或额颞叶梗死患者的1.848倍,分析其原因与控制情感的神经环路主要分布在皮质、基底核、丘脑及海马等部位有关,神经环路受损导致5-羟色胺(5-HT)、去甲肾上腺素(NE)神经轴突中断,5-HT及NE等神经递质水平降低,进而诱发PSD[18-19]。(5)严建东等[16]研究表明,家庭关系是PSD的影响因素(OR=12.321);本研究结果显示,SSRS评分<20分的缺血性卒中患者随访12个月PSD发生风险是SSRS评分31~40分患者的2.344倍,分析原因主要为脑卒中患者基本丧失工作能力,且经济收入减少,如果家庭经济支持力度不够则患者将承受巨大的心理压力,进而导致抑郁发生风险增加[20]。(6)卒中患者神经功能缺损程度越重则残疾率越高,日常生活能力越低,心理压力越大。王雯等[21]研究结果显示,神经功能缺损程度是青年卒中患者发生PSD的独立影响因素(OR=1.820),本研究结果与之相一致。
本研究结果显示,PSD组患者有抑郁症家族遗传史者所占比例高于非PSD组,提示有抑郁症遗传倾向的缺血性卒中患者更易罹患抑郁。现代分子遗传学研究表明,卒中与抑郁均与遗传有关,BDNF基因表达可能参与抑郁症的发生[22]。BDNF是一种内源性蛋白,具有神经营养功能,其不仅与神经元增殖、分化等有关[5],还与5-HT能神经环路功能有关[23]。BDNF基因位于11号染色体短臂I区,由11个外显子组成,可编码神经营养因子。
rs6265位于人类11q13外显子区域,第196号核苷酸位点若发生鸟嘌呤-腺嘌呤碱基突变则可导致其密码子对应BDNF前体蛋白第66号氨基酸由缬氨酸变为蛋氨酸,影响BDNF蛋白表达和分泌活性,进而影响神经元生长、发育、存活及突触可塑性[24]。POLYAKOVA等[25]研究表明,BDNF rs6265位点突变后,A等位基因与BDNF分泌减少有关。王瑛等[5]研究结果显示,BDNF rs6265位点基因多态性与老年抑郁症发生无直接关系,但其影响老年抑郁症患者认知功能,其中A型纯合子基因型患者认知障碍发生风险更高。YANG等[26]研究结果表明,BDNF rs6265位点基因多态性与抑郁障碍无关,但与负性生活事件存在交互作用。周英勇等[4]研究结果显示,BDNF rs6265位点基因突变与产后抑郁密切相关,其中携带CC基因型是产后抑郁的危险因素。彭敏等[23]研究发现,冠心病共病抑郁患者BDNF rs6265位点AA基因型、等位基因A频率高于未患抑郁的冠心病患者,提示BDNF rs6265位点基因突变与冠心病共病抑郁密切相关。CZIRA等[27]研究表明,BDNF rs6265位点基因多态性与抑郁症状严重程度有关。本研究结果显示,PSD组患者BDNF rs6265位点CC基因型、等位基因C频率高于非PSD组,进一步行多因素Logistic回归分析结果显示,BDNF rs6265位点CT基因型和CC基因型是PSD的独立影响因素,提示携带BDNF rs6265等位基因C的缺血性卒中患者对PSD易感。
rs10835210在BDNF基因上距离rs6265仅16 kb[28]。既往研究表明,rs10835210与rs6265之间存在强连锁不平衡[29]。邓彭等[30]通过二元Logistic回归分析结果显示,BDNF rs10835210位点基因多态性与抑郁有关,其中杂合子(AC基因型)携带者较野生型纯合子(CC基因型)携带者抑郁症反复发作风险降低(OR=0.772比OR=1.045)。本研究结果显示,PSD组患者BDNF rs10835210位点AC基因型频率高于非PSD组,进一步行多因素Logistic回归分析结果显示,rs10835210位点AC基因型和AA基因型是PSD的独立影响因素,提示携带BDNF rs10835210位点等位基因A的缺血性卒中患者对PSD易感,rs10835210可能是与抑郁症关联的微效应位点。本研究结果还显示,BDNF rs56164415、rs7124442位点基因多态性与PSD发病无关,与德国一项大型前瞻性、多中心随访研究结果相一致[31]。
综上所述,缺血性卒中患者PSD发生率较高,女性、高龄、内向型性格、脑干/基底核梗死、社会支持薄弱、神经功能缺损严重、日常生活能力低下者PSD发生风险较高,而携带BDNF rs6265位点等位基因C、rs10835210位点等位基因A的缺血性卒中患者PSD易感性较高。但本研究仍存在以下局限:(1)PSD的发生机制复杂且存在多种病理生理相互作用,易受多种因素影响,因此本研究结果仍有待进一步研究证实;(2)本研究对象均为缺血性卒中患者,因客观原因而未纳入出血性卒中患者,因此不同卒中类型所致PSD的影响因素仍需进一步研究。
