血清25-羟维生素D3水平对糖耐量受损和/或空腹血糖受损肥胖儿童3年临床转归影响的多中心随访研究
2019-07-15张远达刘毓董青伟柏璐刘瑞花张少辉张瑜马蕾
张远达,刘毓,董青伟,柏璐,刘瑞花,张少辉,张瑜,马蕾
据调查,2010年我国18岁以上人群糖尿病患者总数约为1.14亿,糖尿病前期患者总数约为4.93亿,且呈年轻化趋势,我国糖尿病现状不容乐观[1]。糖耐量受损(IGT)和空腹血糖受损(IFG)是糖尿病前期状态,二者均是正常糖耐量向糖尿病转化的过渡阶段,且该阶段可逆[2]。因此,探究IGT和IFG进展为糖尿病过程中的影响因素对减少糖尿病发病具有重要现实意义。25-羟维生素D3〔25-(OH)D3〕可参与多种疾病的生理病理过程。SCIACQUA等[3]研究结果显示,25-(OH)D3水平与糖耐量受损程度呈负相关,其可能参与2型糖尿病(T2DM)的发生发展。本研究联合多个中心对123例IGT和/或IFG肥胖儿童随访3年,旨在探讨血清25-(OH)D3水平对IGT和/或IFG肥胖儿童临床转归的影响,现报道如下。
1 资料与方法
1.1 诊断标准、纳入与排除标准
1.1.1 诊断标准 儿童肥胖诊断参照0~18岁儿童肥胖体质指数(BMI)界值[4]。IGT、IFG、糖尿病的诊断参照美国糖尿病联盟(ADA)制定的标准,其中IGT指口服葡萄糖耐量(OGTT)试验2 h血糖(2 h PG)为7.8~11.0 mmol/L,IFG 指空腹血糖为 5.6~6.9 mmol/L,糖尿病指2次空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L(伴多饮、多尿、多食、消瘦症状)或OGTT试验2 h PG≥11.1 mmol/L。
1.1.2 纳入标准 (1)年龄8~14岁;(2)既往体健,近6个月内未补充维生素D及采用激素治疗者[5]。
1.1.3 排除标准 (1)既往有自身免疫系统疾病病史者;(2)合并内分泌遗传代谢疾病、肝病、肾脏病、严重感染及创伤者。
1.2 一般资料 选取2011年10月—2014年10月在保定市儿童医院、河北省儿童医院、贵阳市儿童医院及济宁医学院附属医院就诊的IGT和/或IFG肥胖儿童123例,其中单纯IGT儿童38例(A组)、单纯IFG儿童54例(B组)、IGT并IFG儿童31例(C组);另选取同期单纯肥胖儿童48例作为对照组。A组儿童中男22例,女16例;平均年龄(10.4±1.5)岁。B组儿童中男34例,女20例;平均年龄(10.6±2.0)岁;C组儿童中男20例,女11例;平均年龄(10.5±1.7)岁;对照组儿童中男31例,女17例;平均年龄(10.6±1.7)岁。4组儿童性别(χ2=0.373)、年龄(F=0.055)比较,差异无统计学意义(P>0.05),具有可比性。本研究经保定市儿童医院医学伦理委员会审核批准,所有患儿家属对本研究知情并签署知情同意书。
1.3 观察指标 所有儿童于清晨空腹8~12 h后采集静脉血5 ml,1 880×g离心10 min,留取血清,采用氧化酶法检测血脂指标,包括总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),所用试剂购自Mindray公司;采用酶联免疫吸附试验检测血清25-(OH)D3水平,所用试剂购自北京博晖创新光电技术股份有限公司。采用己糖激酶法检测所有儿童空腹血糖,然后行OGTT试验,具体如下:儿童口服无水葡萄糖1.75 g/kg,总量≤75 g,并检测2 h PG。
1.4 随访 由专人负责对所有儿童进行电话随访,1次/年,并嘱儿童来院复诊。随访3年,记录儿童临床转归。
1.5 统计学方法 采用SPSS 17.0统计学软件进行数据处理,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用q检验;计数资料分析采用χ2检验;血清25-(OH)D3水平与IGT和/或IFG肥胖儿童空腹血糖、2 h PG的相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 随访结果 随访期间29例儿童因不能来院复诊失访,失访率为23.6%,其中A组9例、B组10例、C组10例。
2.2 基线血脂指标及血清25-(OH)D3水平 4组儿童基线TC、TG、HDL-C及LDL-C水平比较,差异无统计学意义(P>0.05)。4组儿童基线血清25-(OH)D3水平比较,差异有统计学意义(P<0.05);其中A组、B组、C组儿童基线血清25-(OH)D3水平低于对照组,A组、B组儿童基线血清25-(OH)D3水平高于C组,差异有统计学意义(P<0.05,见表1)。
2.3 相关性分析 Pearson相关分析结果显示,血清25-(OH)D3水平与IGT和/或IFG肥胖儿童空腹血糖、2 h PG呈负相关(r值分别为-0.26、-0.33,P<0.05,见图1~2)。
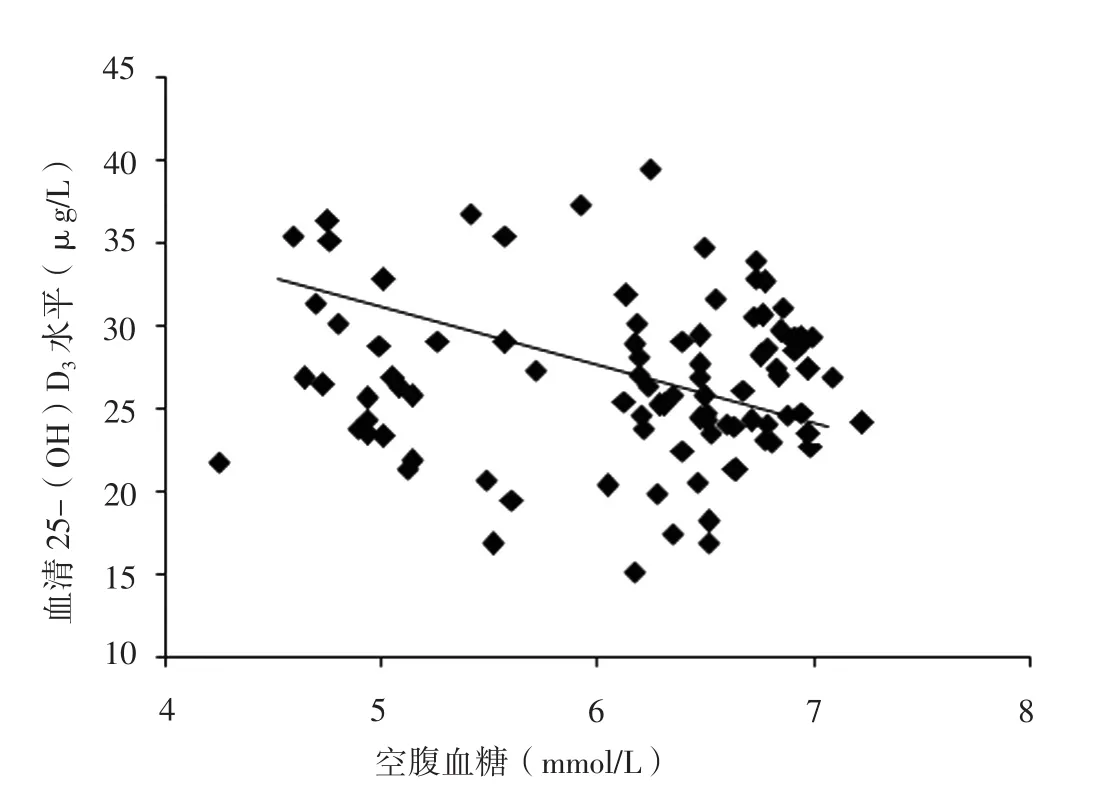
图1 血清25-(OH)D3水平与IGT和/或IFG肥胖儿童空腹血糖关系的散点图Figure 1 Scatter plot for correlation between serum 25-(OH)D3 level and FBG in obese children with IGT and /or IFG
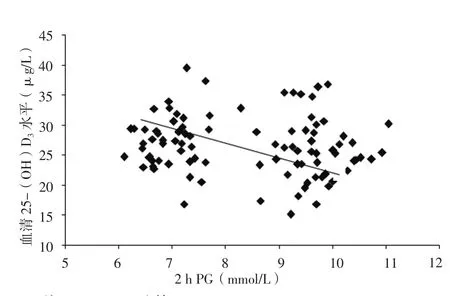
图2 血清25-(OH)D3水平与IGT和/或IFG肥胖儿童2 h PG关系的散点图Figure 2 Scatter plot for correlation between serum 25-(OH)D3 level and 2 h PG in obese children with IGT and/or IFG
2.4 3 年临床转归 随访3年,A组、B组、C组儿童临床转归比较,差异有统计学意义(u=8.84,P<0.05);C组儿童临床转归劣于A组和B组,差异有统计学意义(P<0.05,见表2)。
表1 4组儿童基线血脂指标及血清25-(OH)D3水平比较(±s)Table 1 Comparison of baseline blood lipid parameters and serum 25-(OH)D3 level in the four groups
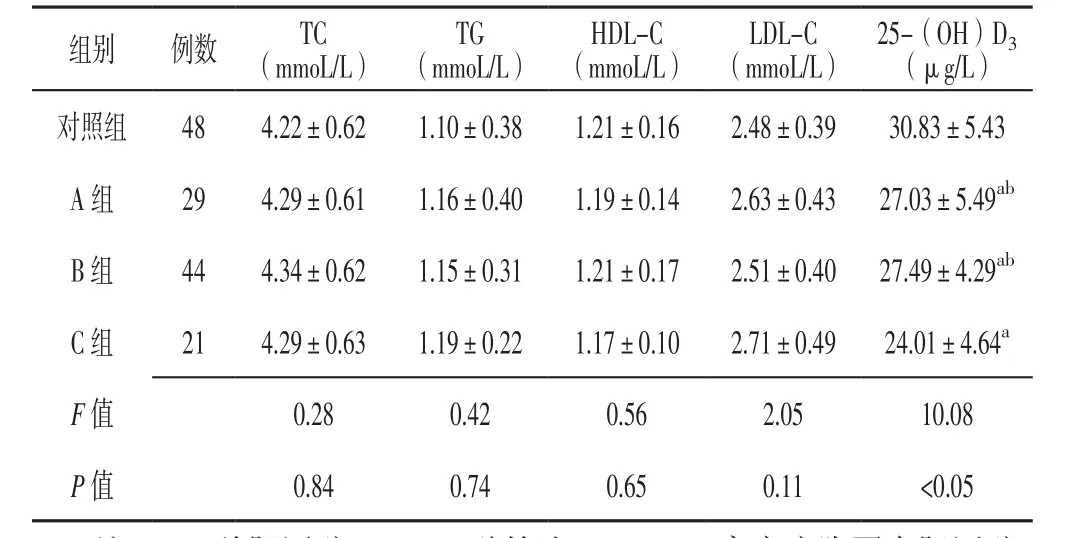
表1 4组儿童基线血脂指标及血清25-(OH)D3水平比较(±s)Table 1 Comparison of baseline blood lipid parameters and serum 25-(OH)D3 level in the four groups
注:TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇,25-(OH)D3=25-羟维生素D3;与对照组比较,aP<0.05;与C组比较,bP<0.05
组别 例数 TC(mmoL/L)TG(mmoL/L)HDL-C(mmoL/L)LDL-C(mmoL/L)25-(OH)D3(μg/L)对照组 48 4.22±0.62 1.10±0.38 1.21±0.16 2.48±0.39 30.83±5.43 A 组 29 4.29±0.61 1.16±0.40 1.19±0.14 2.63±0.43 27.03±5.49ab B组 44 4.34±0.62 1.15±0.31 1.21±0.17 2.51±0.40 27.49±4.29ab C组 21 4.29±0.63 1.19±0.22 1.17±0.10 2.71±0.49 24.01±4.64a F值 0.28 0.42 0.56 2.05 10.08 P值 0.84 0.74 0.65 0.11 <0.05
2.5 不同临床转归儿童基线及随访3年血清25-(OH)D3水平比较 不同临床转归儿童基线及随访3年血清25-(OH)D3水平比较,差异有统计学意义(P<0.05);IFG/IGT和糖尿病儿童基线及随访3年血清25-(OH)D3水平低于正常糖耐量儿童,糖尿病儿童基线及随访3年血清25-(OH)D3水平低于IGT和/或IFG儿童,差异有统计学意义(P<0.05,见表3)。

表2 A组、B组、C组儿童随访3年临床转归情况〔n(%)〕Table 2 Clinical outcome in groups A,B and C after 3-year follow-up
表3 不同临床转归儿童基线及随访3年血清25-(OH)D3水平比较(±s)Table 3 Comparison of baseline and 3-year follow-up serum 25-(OH)D3 level in children with different clinical outcome
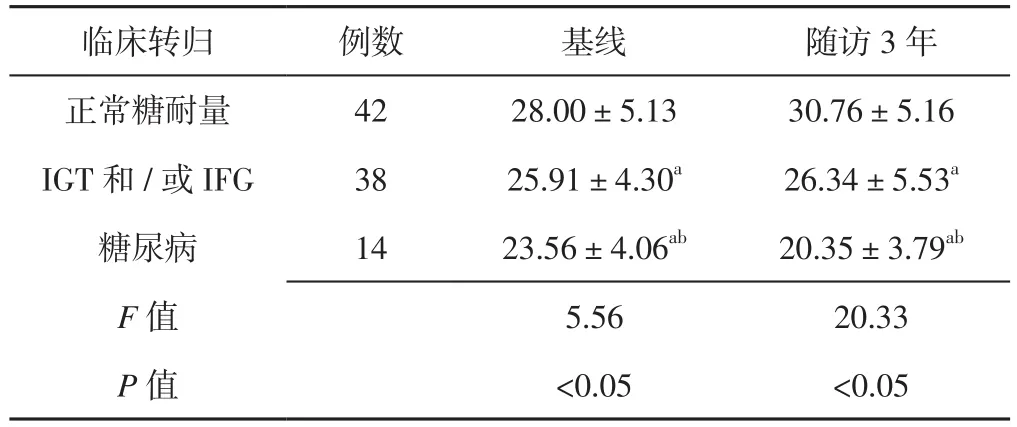
表3 不同临床转归儿童基线及随访3年血清25-(OH)D3水平比较(±s)Table 3 Comparison of baseline and 3-year follow-up serum 25-(OH)D3 level in children with different clinical outcome
注:与正常糖耐量儿童比较,aP<0.05;与IGT和/或IFG儿童比较,bP<0.05
临床转归 例数 基线 随访3年正常糖耐量 42 28.00±5.13 30.76±5.16 IGT和/或IFG 38 25.91±4.30a 26.34±5.53a糖尿病 14 23.56±4.06ab 20.35±3.79ab F值 5.56 20.33 P值 <0.05 <0.05
3 讨论
肥胖已成为严重危害我国儿童身心健康的新问题。既往研究表明,肥胖与糖耐量异常及T2DM发病率增加有关[6-8]。本研究结果显示,C组儿童临床转归劣于A组和B组,其中糖尿病者所占比例高于A组和B组,与孙月琳等[9]研究结果相符,提示IGT并IFG肥胖儿童更易转归为T2DM,应引起临床重视并密切监测其血糖变化。
近年来国内研究均表明,25-(OH)D3水平与糖耐量异常及T2DM发生有关[10-12]。25-(OH)D3是维生素D的代谢产物,也是维生素D在机体的循环形式。既往研究表明,维生素D可通过多种途径调节血糖:(1)维生素D可抑制细胞核因子κB活性及炎性反应,增加胰岛素敏感通路并抑制胰岛素抵抗通路,加速糖代谢[13];(2)维生素D可使p38丝裂原活化蛋白激酶去磷酸化,Akt磷酸化,进而恢复对葡萄糖的摄取[14];(3)维生素D可通过上调葡萄糖转运蛋白4(GLUT4)易位而维持葡萄糖代谢作用[15]。本研究结果显示,A组、B组、C组儿童基线血清25-(OH)D3水平低于对照组,A组、B组儿童基线血清25-(OH)D3水平高于C组,提示单纯IGT和/或IFG肥胖儿童血清25-(OH)D3水平较单纯肥胖儿童较低,其中IGT并IFG肥胖儿童血清25-(OH)D3水平更低;本研究结果还显示,随访3年,IGT和/或IFG和糖尿病儿童基线及随访3年血清25-(OH)D3水平低于正常糖耐量儿童,糖尿病儿童基线及随访3年血清25-(OH)D3水平低于IGT和/或IFG儿童,提示血清25-(OH)D3水平较低的IGT和/或IFG肥胖儿童进展为糖尿病的风险较高,与王涛等[12]研究结果相一致。笔者推测提高IGT和/或IFG肥胖儿童血清25-(OH)D3水平可能改善其临床转归。
目前研究表明,糖尿病患者长期存在慢性炎性反应[16],而25-(OH)D3具有调控炎性反应等作用[17]。本研究结果显示,血清25-(OH)D3水平与IGT和/或IFG肥胖儿童空腹血糖、2 h PG呈负相关,究其原因主要为血糖升高引起慢性炎性反应,进而影响25-(OH)D3水平,而25-(OH)D3水平降低又会导致机体调节血糖及调控炎性反应的能力变差,形成恶性循环。
综上所述,血清25-(OH)D3水平与IGT和/或IFG肥胖儿童空腹血糖、2 h PG呈负相关,且血清25-(OH)D3水平较低的IGT和/或IFG肥胖儿童进展为糖尿病的风险较高。但本研究样本量较小,且未观察补充维生素D对IGT和/或IFG肥胖儿童3年临床转归的影响,仍有待进一步研究。
作者贡献:张远达、刘毓进行文章的构思与设计,结果分析与解释,负责撰写论文,负责文章的质量控制及审校,对文章整体负责,监督管理;刘毓、董青伟进行研究的实施与可行性分析;张远达、刘毓、柏璐、刘瑞花、张少辉、张瑜、马蕾进行数据收集、整理、分析。
