柱花草和芒果胶孢炭疽菌的交互致病性研
2019-07-10陆英贺春萍黄兴习金根吴伟怀郑金龙梁艳琼易克贤
陆英 贺春萍 黄兴 习金根 吴伟怀 郑金龙 梁艳琼 易克贤
摘要 [目的]明确芒果和柱花草胶孢炭疽菌是否存在交互致病性。[方法]选用芒果和柱花草胶孢炭疽菌菌株各20株,通过人工接种方法对这些菌株在芒果和柱花草上的交互致病力进行研究。[结果]不同寄主来源的胶孢炭疽菌对不同寄主存在交互致病性,但致病力存在较大差别,对原寄主的致病性表现最强,而对原寄主以外寄主则表现出不同程度的致病力分化现象。[结论]该研究为预防芒果果园生草中交互感染提供理论依据。
关键词 胶孢炭疽菌;交互致病性;芒果;柱花草
中图分类号 S432.4+4文献标识码 A
文章编号 0517-6611(2019)11-0147-03
doi:10.3969/j.issn.0517-6611.2019.11.042
开放科学(资源服务)标识码(OSID):
Abstract [Objective]To clarify the pathogenicity differences of Colletotrichum gloeosporioides strains isolated from mango and stylo.[Method]Twenty C. gloeosporioides strains were isolated from mango and stylo respectively and their cross pathogenicity were determined by artificial inoculation.[Result]The pathogenicity of C. gloeosporioides on the different hosts was variable, and the pathogenicity of isolates always showed the highest virulence on its own host, while showed different degree of pathogenicity differentiation to the nonoriginal host.
Key words Colletotrichum gloeosporioides;Cross pathogenicity;Mango;Stylo
作者简介 陆英(1976—),女,广西河池人,副研究员,博士,从事热带植物病理学研究。
*通信作者,研究员,博士生导师,从事作物育种研究。
收稿日期 2019-01-04
炭疽菌(Colletotrichum spp.)是一类重要的植物病原真菌,寄主范围十分广泛,可侵染大多数热带作物,引起的炭疽病是热带亚热带作物最重要的病害之一[1-5]。炭疽菌的病菌包括胶孢炭疽菌(C.gloeosporioides)、芭蕉炭疽菌(C.musae)、尖孢炭疽菌(C.acutatum)和辣椒炭疽菌(C.capsici))等,其中胶孢炭疽菌(C.gloeosporioides)引起的炭疽病最普遍,为害最严重[6]。尽管炭疽菌的寄主范围十分广泛,但在不同寄主上表现的致病力是否存在差异,尚未见相关报道。
柱花草(Stylosanthes spp.)为优质热带豆科牧草,广泛种植于美洲、非洲、东南亚等热带、亚热带地区[7-8]。20世纪60年代初,我国首次从马来西亚引进柱花草,用于橡胶种植园的覆盖作物[9]。目前国内柱花草已被广泛用于果园的田间种植[10-13]。果园种植柱花草可以保持水土、改良土壤理化性质、增加土壤有机质、减少化肥施用、调节果园小气候环境、增加生物多样性和种群数量等[14-19]。但也使得植物病原物在不同物种间交互感染成为可能,了解不同寄主的病原菌株能否侵染同一寄主植物,或不同寄主来源的菌株对同一寄主的致病力是否存在差异,对防范作物之间的交互感染具有十分重要的意义。目前国内外鲜见胶孢炭疽菌交互致病性的研究。笔者将来源于芒果和柱花草的胶孢炭疽菌菌株,进行人工接种试验,测定其交互致病性,评价其在不同寄主之间的交互侵染能力,进而明确胶孢炭疽菌在不同寄主之间是否存在致病性分化现象,旨在预防果园生草过程中交互感染和胶孢炭疽菌引起病害综合治理提供理论依据。
1 材料与方法
1.1 材料
24株柱花草和芒果炭疽病菌株均由中国热带农业科学院环境与植物保护研究所植物病害研究室提供,采集典型症状标本,经单孢分离,经病原鉴定后保存备用。
1.2 培养基
PDA培养基:马铃薯 200 g,葡萄糖 15~20 g,琼脂 15~20 g,补充ddH2O至1 000 mL。其对应液体培养基则不加琼脂。
1.3 胶孢炭疽菌菌株对柱花草致病性的测定
采用菌饼反接离体针刺叶片法。挑取待测菌株在PDA培养基上划线活化,在28 ℃恒温培养箱培养6 d后,配制成浓度为1×106个/mL的孢子悬浮液。选取柱花草叶龄7 d左右、生长旺盛的柱花草三出复叶。针刺离体叶片,将30 L上述配制好的炭疽菌孢子悬浮液加在叶片上,以喷无菌水为对照。将接种后叶片放置在保湿处理过的培养盘中,保鲜膜封口,28 ℃恒温条件下培养5 d后,觀察柱花草叶片发病情况,进行病害分级,试验重复3次。
病斑分级标准:0 级,无可见病斑;1级,1%~3%叶片或茎段有病斑;2级,4%~6%叶片或茎段有病斑;3级,7%~12%叶片或茎段有病斑;4 级,13%~25%叶片或茎段有病斑;5级,26%~50%叶片或茎段有病斑;6级,51%~75%叶片或茎段有病斑;7级,76%~87%叶片或茎段有病斑;8级,88%~94%叶片或茎段有病斑;9级,95%~100%叶片或茎段有病斑。病情指数=∑(各级发病数×发病级数)/(调查数×9)×100。
1.4 胶孢炭疽菌菌菌株对芒果致病性的测定
芒果品种为贵妃芒,取其古铜色转淡绿色期幼嫩叶片,采自中国热带农业科学院儋州国家科技示范芒果基地。
采用离体叶片伤口接种法,用无菌水将待接种叶片洗净晾干,用1.0%次氯酸钠溶液消毒10 min,清水冲洗3次。用10针刺伤叶片正面,叶柄基部用灭菌的湿润脱脂棉包裹,再用锡箔纸进行固定。接种菌株在PDA培养基上,25 ℃下培养5 d,然后在菌落边缘取直径5 mm菌饼,将菌饼接种在叶片上,菌饼菌丝面紧贴叶片针刺伤口,设置空白PDA培养基饼块作为对照组。接种后的叶片置于白盘中(盘底铺有无菌水的灭菌纱布,盘口用保鲜膜覆盖并用灭菌解剖针打适量小孔,使相对湿度稳定在100%),在25 ℃下培养5 d后,采用十字交叉法测量接种的病斑直径,计算病情指数,评价不同菌株致病性。试验重复3次,每一接种处理重复5次。
芒果炭疽严重程度根据病斑直径分级,分级标准:0级,接种点坏死病斑直径为0;1级,0<接种点坏死斑直径≤0.5 cm;3级,0.5 cm<接种点坏死斑直径≤1.0 cm;5级,10 cm<接种点坏死斑直径≤2.0 cm;7级,2.0 cm<接种点坏死斑直径≤4.0 cm;9级,接种点坏死病斑直径>4.0 cm,病情指数=∑(各级发病数×发病级数)/(调查数×9)×100。
致病性强弱参照谢艺贤等[20]、方中达[21]方法,致病性强弱以病斑直径划分:强致病性,病斑直径>1.5 cm;强致病性,1.3 cm≤病斑直徑≤1.5 cm;中等致病性,1.00 cm≤病斑直径<1.3 cm;弱致病性,0 cm<病斑直径<1.0 cm;无致病性,病斑直径为0。
2 结果与分析
2.1 胶孢炭疽菌菌株对柱花草致病性
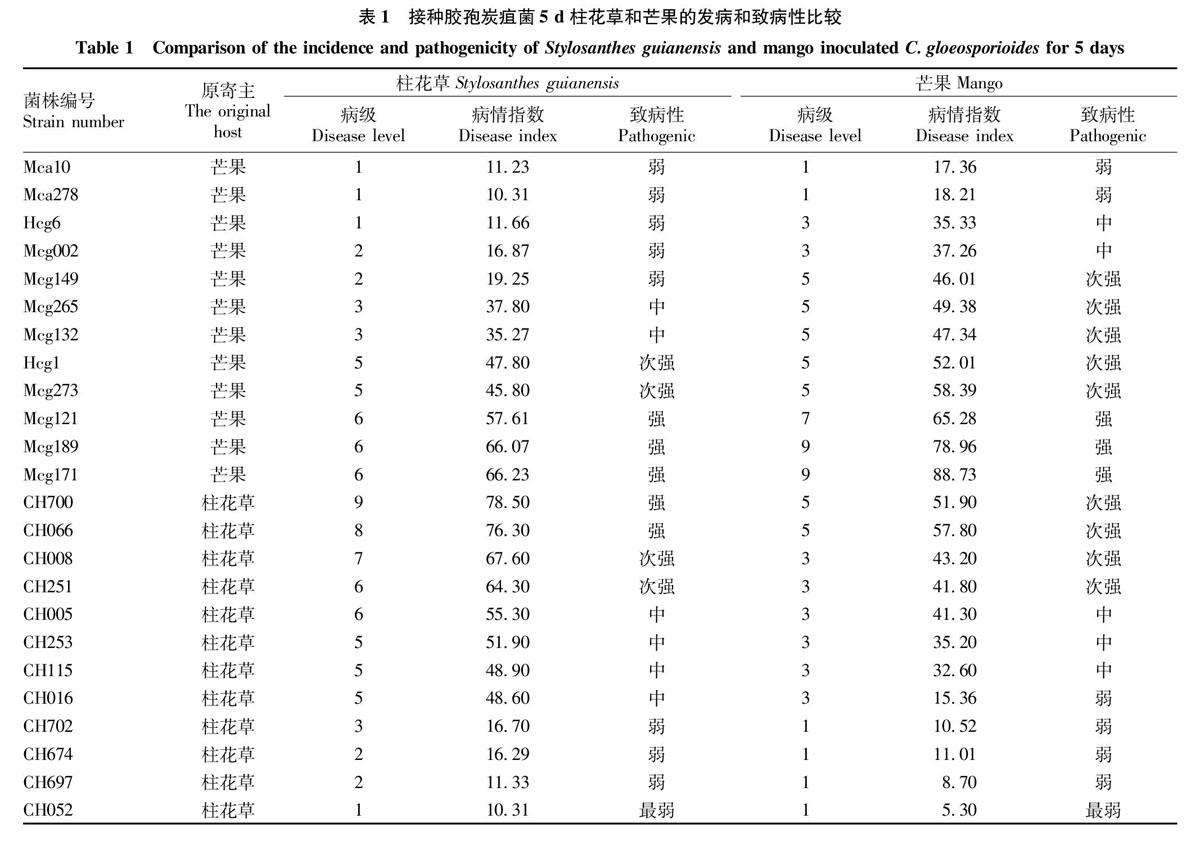
将供试胶孢炭疽菌菌株接种柱花草,接种5 d后观察叶片发病情况,根据试验方法“1.3”统计病情指数及病级,结果见表1。由表1可知,供试菌株均可能使柱花草叶片发病,表现出典型的炭疽病症状,但病斑大小存在差异。12个柱花草炭疽病菌株病情指数为10.31~78.50,最低病级为1级,最高病级为9级,平均病级大于5。包含2个强致病力(CH700、CH066)、2个次强致病力(CH008、CH251)、4个中等致病力(CH005、CH253、CH115、CH016)、4个弱致病力(CH702、CH674、CH697、CH052),中、次强、强致病性菌株占整个供试菌株的66.7%。12个芒果炭疽病菌株对柱花草的平均病级低于3.5,最低病级为1级,最高病级为6级。病情指数为11.23~66.23。其中3个强致病力(Mcg171、Mcg189、Mcg121),2个次强致病力(Mcg273、Hcg1),2个中等致病力(Mcg265、Mcg132),5个弱致病力(Mcg149、Hcg6、Mcg002、Mca278、Mca10),中、次强、强致病性菌株占整个供试菌株的58.3%。
2.2 胶孢炭疽菌菌株对芒果致病性
将供试胶孢炭疽菌菌株接种芒果叶片,接种5 d后观察叶片发病情况,根据试验方法“1.4”统计病情指数及病级,结果见表1。由表1可知,供试菌株均能使芒果叶片致病,表现典型的炭疽病病斑,但病斑大小存在差异,病斑直径为0.31~3.15 cm。芒果胶孢炭疽
菌发病级数多为5以上,最高病级为9级,平均病级接近5,病情指数为17.36~88.73。强致病性菌株有3个菌株(Mcg171、Mcg189、Mcg121),次强致病性菌株有5个菌株(Mcg273、Hcg1、Mcg132、Mcg265、Mcg149),中致病性菌株2株(Mcg002、Hcg6),中、强致病性菌株占整个供试菌株的833%。而12个柱花草炭疽病菌株对芒果叶片的最高病级只有5级,平均病级为2.67,病情指数为5.3~57.8。次强致病性菌株有4个菌株(CH700、CH066、CH008、CH251),中致病性菌株3株(CH005、CH253、CH115),中、次强致病性菌株占整个供试菌株的58.33%。
2.3 胶孢炭疽菌对柱花草和芒果的致病力分化
根据“13”和“1.4”的病情调查及分级标准,供试胶孢炭疽菌菌株均能单独侵染柱花草和芒果,表现出典型的炭疽病症状,但病害级别(致病力强弱)表现出一定差异。柱花草炭疽菌菌株对柱花草的平均病级大于5,而对芒果的平均病级低于35。芒果炭疽菌菌株对芒果的平均病级为4.89,而对柱花草的平均病级为2.67。由此可见,各供试菌株对原寄主的致病力总体强于对其他寄主的致病力。
3 结论与讨论
在果园生态农业系统中,果园生草是现代农业生态化管理的重要措施之一。芒果园生草以人工种草为主,自然生草为辅,主要草种为柱花草。芒果园种子柱花草可以改善土壤理化性质,增加土壤有机质,减少化肥施用,起到控制杂草、驱虫、减少农药施用等作用。但不同植物病原菌对不同寄主植物的交互致病性给果园生草业带来一些不利影响。因此,植物病原菌交互致病性的研究对构建有效的植物病害防治体系具有重要的指导意义。该研究中,用来自于柱花草和芒果2个寄主的胶孢炭疽菌进行致病性交互接种试验。结果表明,来自于柱花草和芒果的菌株均可在人工接种条件下侵染柱花草和芒果,且致病力存在严重分化现象。这说明在芒果园-柱花草生态环境中,胶孢炭疽菌有相互侵染的可能。供试菌株对各自寄主均表现出最强的致病性,而对原寄主以外寄主则表现出不同程度的致病力,说明从不同寄主上分离到的胶孢炭疽菌具有一定的寄主转化性,但也存在致病力分化的现象。这可能是因为长期进化过程中菌株与寄主植物之间相互作用的结果。该研究结果为今后芒果炭疽病综合防治措施中果园生草的选择提供一定的理论基础。
参考文献
[1] CANNON P F,DAMM U,JOHNSTON P R,et al.Colletotrichumcurrent status and future direction[J].Stud Mycol,2012,73(1):181-213.
[2] DEAN R,VAN KAN J A,PRETORIUS Z A,et al.The top 10 fungal pathogen in molecular plant pathology[J].Mol Plant Pathol,2012,13(4):414-430.
[3] LEGARD D E.Colletotrichum diseases of strawberry in Florida[M]//PRUSKY D,FREEMAN S,DICKMAN M.Colletotrichum:Host specificity,pathogy,and hostpathogen interaction.St.Paul:APS Press,2000:292-299.
[4] PRIHASTUTI H,CAI L,CHEN H,et al.Characterization of Colletotrichum species associated with coffee berries in northern Thailand[J].Fungal Divers,2009,39:89-109.
[5] THAN P P,JEEWON R,HYDE K D,et al.Characterization and pathogenicity of Colletotrichum species associated with anthracnose on chilli(Capsicum spp.)in Thailand[J].Plant Pathol,2008,57(3):562-572.
[6] 胡美嬌,李敏,高兆银,等.热带亚热带水果采后病害及防治[M].北京:中国农业出版社,2010.
[7] COSTA N.Reviso do Gênero Stylosanthes[D].Lisboa:Universidade Técnicade Lisboa,2006.
[8] WILLIAMS R J,REID R,SCHULTZEKRAFT R,et al.Natural distribution of Stylosanthes[M]//STACE H M,EDYE L A.The biology and agronomyof Stylosanthes.Sydney:Academic Press,1984:73-101.
[9] 蒋昌顺.我国对柱花草不同种的研究与利用[J].热带作物研究,1995(3):64-70.
[10] 杨春霞,赵志平,杨丽萍.不同覆盖绿肥在云南开割胶园的生态适应性研究[J].热带作物学报,2011,32(11):2180-2186.
[11] 庄道源,黎学培,黎金瓦.胶园套种山毛豆和柱花草技术推广[J].热带农业科学,2011,31(10):1-6.
[12] 俞艳春,文定良,罗心平.绿肥覆盖对改善台湾青枣园微环境的效果初报[J].热带农业科技,2005,28(3):18-20.
[13] 刘友银.毛竹林套种绿肥品种的筛选[J].亚热带农业研究,2013,9(3):145-150.
[14] BECKER M,JOHNSON D E.Legumes as dry season fallow in upland ricebased systems of West Africa[J].Bio Fertil Soils,1998,27(4):358-367.
[15] OIKEH S O,CHUDE V O,CARSKY R J,et al.Legume rotationin the moist tropical savanna:Managing soil N dynamics and cereal yield in farmersfields[J].Exp Agric,1998,34(1):73-83.
[16] MUHR L,TARAWALI S A,PETERS M,et al.Soil mineral N dynamicsand maize grain yieldsfollowing Centrosema macrocarpum and Stylosanthesguianensis:Effects of different rotations and varying levels of N fertilizer[J].Field Crops Res,2002,78(2/3):197-209.
[17] ARAU'JO I C S,COSTA M C G.Biomass and nutrient accumulation pattern of leguminous tree seedlings grown on mine tailings amended with organic waste[J].Ecol Eng,2013,60:254-260.
[18] MAITI S K,SAXENA N C.Biological reclamation of coalmine spoils withouttopsoil:An amendment study with domestic raw sewage and grasslegumes mixture[J].Int J Surf Min Reclam Environ,1998,12(2):87-90.
[19] MAITI S K,MAITI D.Ecological restoration of waste dumps by topsoil blanketing,coirmatting and seeding with grasslegume mixture[J].Ecological engineering,2015,77:74-84.
[20] 谢艺贤,符悦冠.热带作物种质资源抗病虫性鉴定技术规程[M].北京:中国农业出版社,2009.
[21] 方中达.植物研究方法[M].3版.北京:中国农业出版社,1998.
