高效液相色谱法测定食品中丙酸及其盐类
2019-07-10卢兰香孙珊珊尹丽丽祝建华刘艳明
卢兰香,孙珊珊,薛 霞,别 梅,尹丽丽,王 骏,祝建华,刘艳明
(山东省食品药品检验研究院,山东济南 250101)
丙酸及其盐类是世界卫生组织(WHO)和联合国粮农组织(FAO)批准使用的安全可靠的食品防霉剂,可有效抑制食品中霉菌、芽孢杆菌及革兰氏阴性菌等生长繁殖,也可以抑制黄曲霉毒素的产生[1]。丙酸及其盐类的安全性和防腐效果优于苯甲酸,价格低于山梨酸,是理想的食品防腐剂之一[2]。食品中存在的丙酸盐主要为丙酸钠或丙酸钙,GB2760-2014《食品安全国家标准 食品添加剂使用标准》对不同食品中丙酸及其钠盐、钙盐的最大使用量做出了规定[3]。由于人体长期过量摄入含丙酸及其盐类的食品会导致呕吐、腹痛和肺水肿等[4],所以针对食品中的丙酸及其盐类的安全监管,建立快速、简单、准确的分析方法十分必要。
目前,测定丙酸及其盐类的方法有气相色谱法[5-6]、气相色谱法串联质谱法[7-8]、高效液相色谱法[9-10]、离子色谱法[11-12]。相比气相色谱法和离子色谱法,液相色谱法更简单,易操作,方法准确度更好,仪器普及率高。已报道的食品中丙酸的前处理方法主要包括直接浸提法定[10,13]、水蒸汽蒸馏法[5,13]、有机溶剂萃取法[6,8-9],但沉淀剂法尚未见报道。GB 5009.120-2016《食品中丙酸钠、丙酸钙的测定》[13]水蒸气蒸馏法步骤繁琐、耗时,不利于大批量样品的分析检测;直接浸提法回收率高但样品干扰较大,而沉淀剂法[14-16]具有前处理简单、快速、试剂成本低等优点,常被用于食品检测的前处理;所以实验拟将沉淀剂用于食品中丙酸及其盐类的检测。
本文采用高效液相色谱法,系统考察了沉淀剂种类、沉淀剂用量、不同提取条件、不同提取方法对不同食品中丙酸提取和分离的影响,并考察了缓冲盐种类、浓度和pH以及色谱柱种类对分离的影响,以期建立食品中丙酸及其盐类的检测方法。
1 材料与方法
1.1 材料与仪器
丙酸标准品 德国Dr. Ehrenstorfer公司;磷酸氢二胺(分析纯) 国药集团化学试剂有限公司;磷酸(优级纯) 国药集团化学试剂有限公司;乙酸锌(分析纯) 国药集团化学试剂有限公司;亚铁氰化钾(分析纯) 天津市科密欧化学试剂有限公司;pH0.5~5.0精密试纸 中国上海三爱思试剂有限公司;实验用的面包、糕点、鲜面条、腐竹、豆腐、豆浆、小麦、杨梅罐头 均购自于当地超市。
Waters 2695高效液相色谱仪(配备Waters 2998二极管阵列检测器) 美国Waters公司;AB204-S型电子天平 瑞士Mettler Toledo公司;SB-800DTD型超声波清洗器 中国宁波新芝生物科技股份有限公司;Sigma 3-18K型冷冻离心机 德国Sigma公司;Milli-Q超纯水制备器 美国Millipore公司;MS3涡旋混合器 德国IKA公司;GM-300型粉碎机 德国莱驰公司。
1.2 实验方法
1.2.1 标准储备溶液的配制 丙酸标准储备溶液(1.0 mg/mL)的配制:准确称取丙酸标准品25 mg于25 mL容量瓶中,用水溶解并定容至刻度线,充分摇匀备用。此溶液于4 ℃条件下保存。
1.2.2 样品前处理 称取2.5 g样品(面包、糕点、鲜面条、腐竹、豆腐、豆浆、小麦、杨梅罐头)于25 mL比色管中,加入10 mL水,漩涡混合2 min,用1 mol/L磷酸溶液调pH为2.5~3.0,超声提取20 min。冷却至室温后加亚铁氰化钾溶液(92 g/L)1 mL和乙酸锌溶液(183 g/L)1 mL,混匀,用水定容至25.00 mL,8000 r/min离心5 min。经0.22 μm水相微孔滤膜过滤后,待液相色谱测定。
1.2.3 样品前处理条件的优化
1.2.3.1 沉淀剂种类的选择 参考文献[14-16]对食品中常用的三种沉淀剂氢氧化钠-硫酸锌、亚铁氰化钾-乙酸锌、5%三氯乙酸水溶液进行了考察,并考察了亚铁氰化钾-乙酸锌和氢氧化钠-硫酸锌两种沉淀剂对面包、腐竹、鲜面条、小麦、杨梅罐头等不同样品的回收率和精密度的影响,其中丙酸添加浓度为0.25 g/kg。
1.2.3.2 沉淀剂用量的选择 实验以面包阳性样品为例,考察了加入亚铁氰化钾溶液-乙酸锌溶液(体积比1∶1)总体积为1、2、3、4 和5 mL对沉淀效果和提取的影响。
1.2.4 提取条件的选择
1.2.4.1 酸化对丙酸提取效率的影响 为了验证不同提取条件对丙酸及其盐类提取的影响,实验分别考察了加水后用1 mol/L磷酸溶液调pH为2.5~3.0酸化和不酸化,对面包、腐竹、鲜面条、小麦、杨梅罐头等阴性样品回收率的影响,丙酸添加浓度为1.0 g/kg;对面包和糕点阳性样品中丙酸及其盐类提取的影响。
1.2.4.2 酸化对丙酸分离的影响 由于样品提取液的酸度有可能影响目标物的分离,所以实验采用面包、糕点、豆浆、豆腐、腐竹、鲜面条、小麦、杨梅罐头样品,考察了在用高效液相色谱分析检测时,1 mol/L磷酸溶液调pH为2.5~3.0酸化和不酸化对丙酸分离的影响。
1.2.4.3 提取方式的比较 为了验证本方法的可行性,实验考察了不同提取方式对样品中丙酸回收率和样品净化效果的影响。选取面包和糕点阴性样品采用本方法和直接浸提法[13];选取腐竹和鲜面条阴性样品,采用本方法和水蒸气蒸馏法[13],分别考察了不同提取方式对丙酸回收率的影响,其中丙酸添加浓度为0.5 g/kg。
1.2.5 高效液相色谱条件 色谱柱:Atlantis T3 C18色谱柱(4.6 mm×250 mm,5 μm);流动相:(NH4)2HPO4(10 mmol/L,pH3.0);流速1.0 mL/min;进样体积50 μL;柱温35 ℃;检测波长214 nm。
1.2.6 色谱条件的优化
1.2.6.1 色谱柱的选择 实验比较了Symmetry C18色谱柱(4.6 mm×250 mm,5 μm)、Xbridge C18色谱(4.6 mm×250 mm,5 μm)和Atlantis T3 C18色谱柱(4.6 mm×250 mm,5 μm)三种色谱柱对分离效果的影响。
1.2.6.2 流动相种类的选择 实验采用面包阳性样品,考察了在pH3.0条件下磷酸水溶液、K2HPO4、(NH4)2HPO4对丙酸分离效果的影响。
1.2.6.3 流动相浓度的选择 实验采用面包阳性样品,按照1.2.2对样品进行前处理,将流动相分别配成浓度为5、10、20 mmol/L的(NH4)2HPO4溶液(pH3.0),比较了丙酸的分离情况。
1.2.6.4 流动相pH的选择 实验采用面包阳性样品,按照1.2.2对样品进行前处理,考察了pH2.0、2.5、3.0、3.5、4.0对丙酸及其杂质分离效果的影响。
1.2.6.5 检测波长的选择 取配制好的丙酸标准溶液(559.5 μg/mL),用光电二极管阵列紫外可见光检测器于190~400 nm的波长范围内进行紫外光全波长扫描。
1.2.7 方法学考察
1.2.7.1 线性范围、检出限、定量限 将1.2.1标准储备溶液用水逐级稀释成5.0、10.0、20.0、30.0、40.0、50.0、100.0、200.0、300.0、400.0、500.0 μg/mL的标准工作溶液,按浓度从低到高的顺序,按1.2.5高效液相色谱条件进行测定,以丙酸峰面积(Y)对其质量浓度(X)作标准曲线。采用空白基质加标的方法,以信噪比S/N=10得到目标物的定量限(LOQ),以信噪比S/N=3得到目标物的检出限(LOD)。
1.2.7.2 回收率和精密度实验 实验采取分别向空白样品中添加2个浓度水平的标准溶液,面包、糕点、腐竹、豆腐、豆浆、鲜面条、小麦、杨梅罐头中添加0.10和1.5 g/kg,鲜面条中添加0.10和0.25 g/kg,每个浓度水平平行测定6次,计算方法的回收率及精密度。
1.3 数据处理
通过与仪器配套的Empower 3色谱数据处理系统完成数据采集与处理,以及Origin 8.0进行绘图。
2 结果与分析
2.1 前处理条件的优化
2.1.1 沉淀剂的选择
2.1.1.1 沉淀剂种类的选择 结果显示(表1):加入5%三氯乙酸水溶液后,面包、腐竹、鲜面条、小麦、杨梅罐头等样品处理液浑浊,离心后滤液仍然很浑浊,无法通过微孔滤膜进样测定。亚铁氰化钾-乙酸锌沉淀剂与氢氧化钠-硫酸锌相比,能更好地去除样品中的蛋白质和脂肪,离心后样品滤液更澄清,更易通过微孔滤膜;且亚铁氰化钾-乙酸锌和氢氧化钠-硫酸锌沉淀剂对于样品的回收率(表1)分别为85.1%~109.4%(RSD≤3.78%)和82.3%~112.5%(RSD≤3.89%),二者差异很小。实验选择亚铁氰化钾-乙酸锌作为沉淀剂。
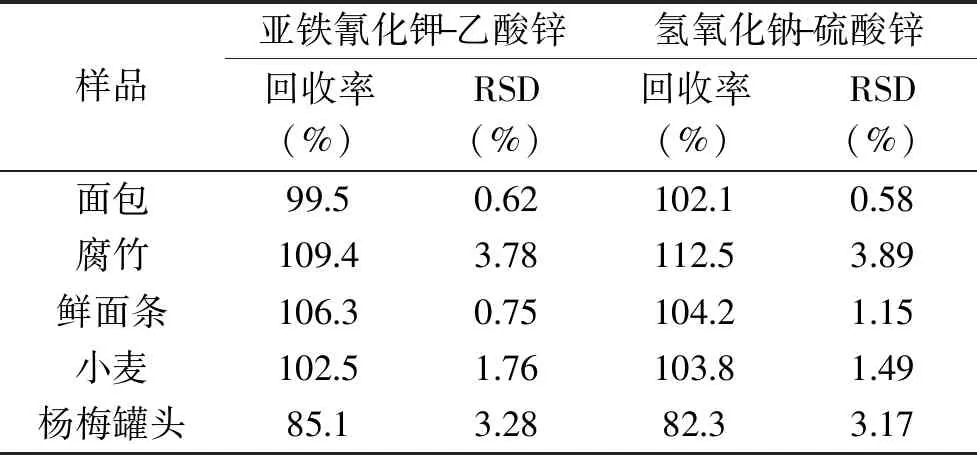
表1 不同沉淀剂的回收率和精密度(n=6)
2.1.1.2 沉淀剂用量的选择 研究表明(图1):随着沉淀剂体积的增加,检测结果变化很小。但是加入1 mL时,处理液产生轻度沉淀,样品滤液浑浊,无法通过微孔滤膜;加入2、3、4和5 mL时,处理液均产生明显沉淀,上层液清晰,滤液均可顺利通过滤膜。所以实验选用亚铁氰化钾溶液-乙酸锌溶液总体积为2 mL。

图1 沉淀剂总体积对丙酸及其盐类提取的影响
2.1.2 提取条件的选择
2.1.2.1 酸化对丙酸提取效率的影响 实验表明(图2),对于面包、腐竹、鲜面条、小麦、杨梅罐头等阴性样品回收率均不存在明显差异,可能是由于加入的丙酸为游离状态,酸化和不酸化均不影响丙酸的提取,所以二者回收率基本无差异。
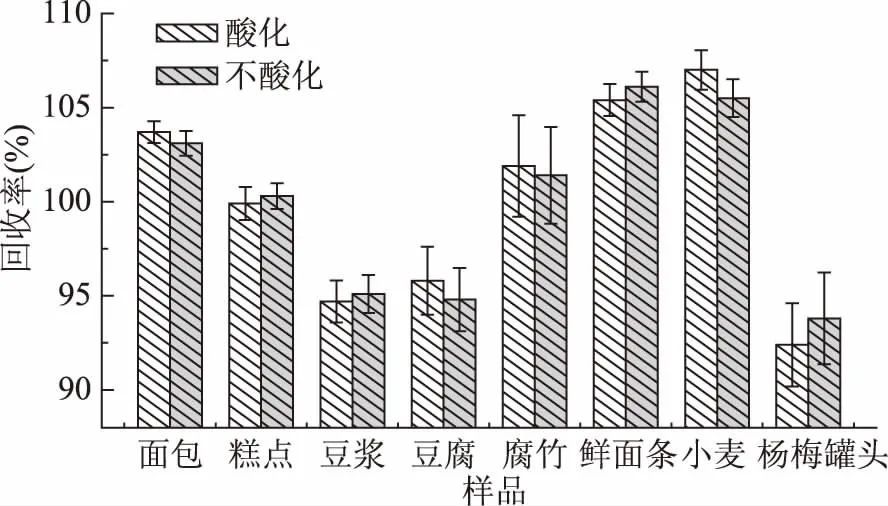
图2 酸化和不酸化对阴性样品丙酸及其盐类回收率的影响
为了进一步验证酸化对于丙酸及其盐类提取的影响,实验采用面包和糕点阳性样品作为考察对象,结果见图3。
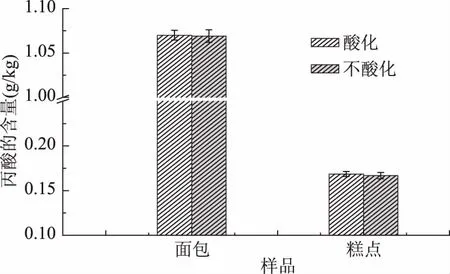
图3 酸化和不酸化对阳性样品丙酸及其盐类提取的影响
由图3可见,酸化和不酸化对于糕点和面包阳性样品的提取效率没有明显差异。
原因可能是食品中存在的丙酸盐主要为丙酸钠或丙酸钙,二者均溶于水;酸化时以丙酸分子形式存在,不酸化时以丙酸根离子形式存在,用高效液相色谱分析检测时,在(NH4)2HPO4溶液(pH3.0)的最优流动相条件下转化为丙酸分子的形式,所以酸化和不酸化都不影响丙酸及其盐类的提取。
2.1.2.2 酸化对丙酸分离的影响 实验发现:不酸化时,对于面包、糕点、豆浆、豆腐、腐竹、鲜面条、小麦、杨梅罐头多数样品,丙酸保留时间比较稳定;但面包和糕点个别样品会出现0.2~0.3 min的漂移。原因可能是当样品提取液酸度与流动相酸度相近时,样品中丙酸保留时间与丙酸标准溶液保留时间一致;当样品提取液酸度与流动相相差较大时,会造成样品溶液与流动相不匹配,导致保留时间出现轻微漂移。
综上,实验提取时选择用1 mol/L磷酸溶液调pH为2.5~3.0酸化。
2.1.3 提取方式的比较 由表2可见,本方法与直接浸提法相比,回收率差异很小;但明显高于水蒸气蒸馏法。原因可能是本方法和直接浸提法前处理都比较简单,丙酸在提取过程中损失比较少,所以二者回收率无明显差异。而水蒸气蒸馏法,一方面由于装置复杂,连接处较多,密封性难以保证;另一方面由于装置的局限性致使部分含目标物的蒸汽未到达接收装置之前即被外界冷却而回流,难以蒸馏出来,导致回收率偏低。

表2 不同方法的回收率和精密度(n=6)
由于提取方式也会影响样品的净化效果,而本方法和直接浸提法对丙酸提取的影响差异很小,所以实验进一步考察了二者对样品的净化效果的影响,结果见图4。由图4可见,直接浸提法色谱图中杂峰明显多于本方法。而且直接浸提法样品处理液粘稠、溶液浑浊,滤液难以通过微孔滤膜。所以直接提取法净化效果不理想。
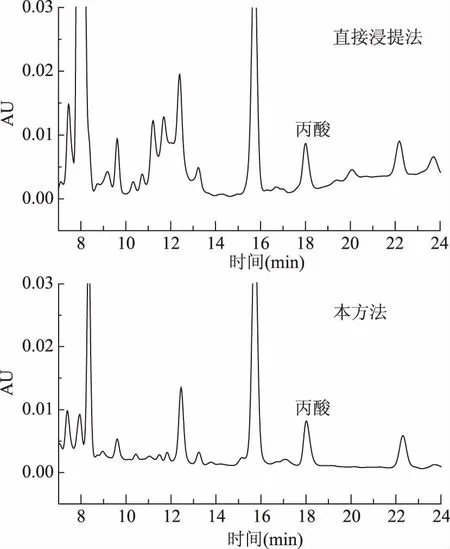
图4 不同提取方法对丙酸及其盐类净化效果的影响
以上实验结果表明,本方法对于丙酸的提取效果优于水蒸气蒸馏法,净化效果优于直接提取法。
2.2 色谱条件的优化
2.2.1 色谱柱的选择 结果表明(图5):Atlantis T3 C18色谱柱对丙酸有较好的保留(tR=17.895 min),在选定的条件下可完全分离目标物与杂质,实现准确定性和定量;但Symmetry C18和Xbridge C18,对丙酸的保留时间分别为10.218 min、11.493 min,保留较弱,均不能实现目标物与杂质的有效分离。原因可能是丙酸为强极性化合物,在Symmetry C18和Xbridge C18色谱柱上不易被保留,但是Atlantis T3 C18色谱柱采用3个Si-C键将一个C18链键合到硅胶表面,具有很好的低pH稳定性,100%水相流动相兼容,而且由于空间位阻的作用,导致C18表面键合密度低,从而增加了对极性化合物的保留,特别适合极性化合物的分析。所以,实验最终选择Atlantis T3 C18色谱柱。

图5 不同色谱柱对丙酸及其盐类分离的影响
2.2.2 流动相条件的选择
2.2.2.1 流动相种类的选择 因为丙酸的检测波长较低,有些缓冲盐溶液在波长210 nm附近有较强的吸收[17],干扰测定。而磷酸盐缓冲溶液在紫外区几乎无吸收,所以可作为丙酸测定的流动相。研究表明,用磷酸水溶液时(图6A),样品溶液紫外光谱图在262 nm处也有较大吸收峰,与丙酸标准溶液光谱图不相符,说明丙酸与杂质不能有效分离。用(NH4)2HPO4和K2HPO4溶液作流动相时,均不会存在图6A的现象,但是(NH4)2HPO4峰形优于K2HPO4(图6B),所以实验选择(NH4)2HPO4。

图6 不同缓冲盐对丙酸及其盐类分离的影响
2.2.2.2 流动相浓度的选择 由图7可见:浓度为5 mmol/L时,丙酸色谱峰的对称因子为0.80,峰前伸;10 mmol/L和20 mmol/L时,色谱峰的对称因子分别为1.01、1.04,峰形较好。但高浓度的盐会对色谱仪的输液泵和色谱柱的寿命产生影响,所以本实验选择(NH4)2HPO4的最佳浓度为10 mmol/L。
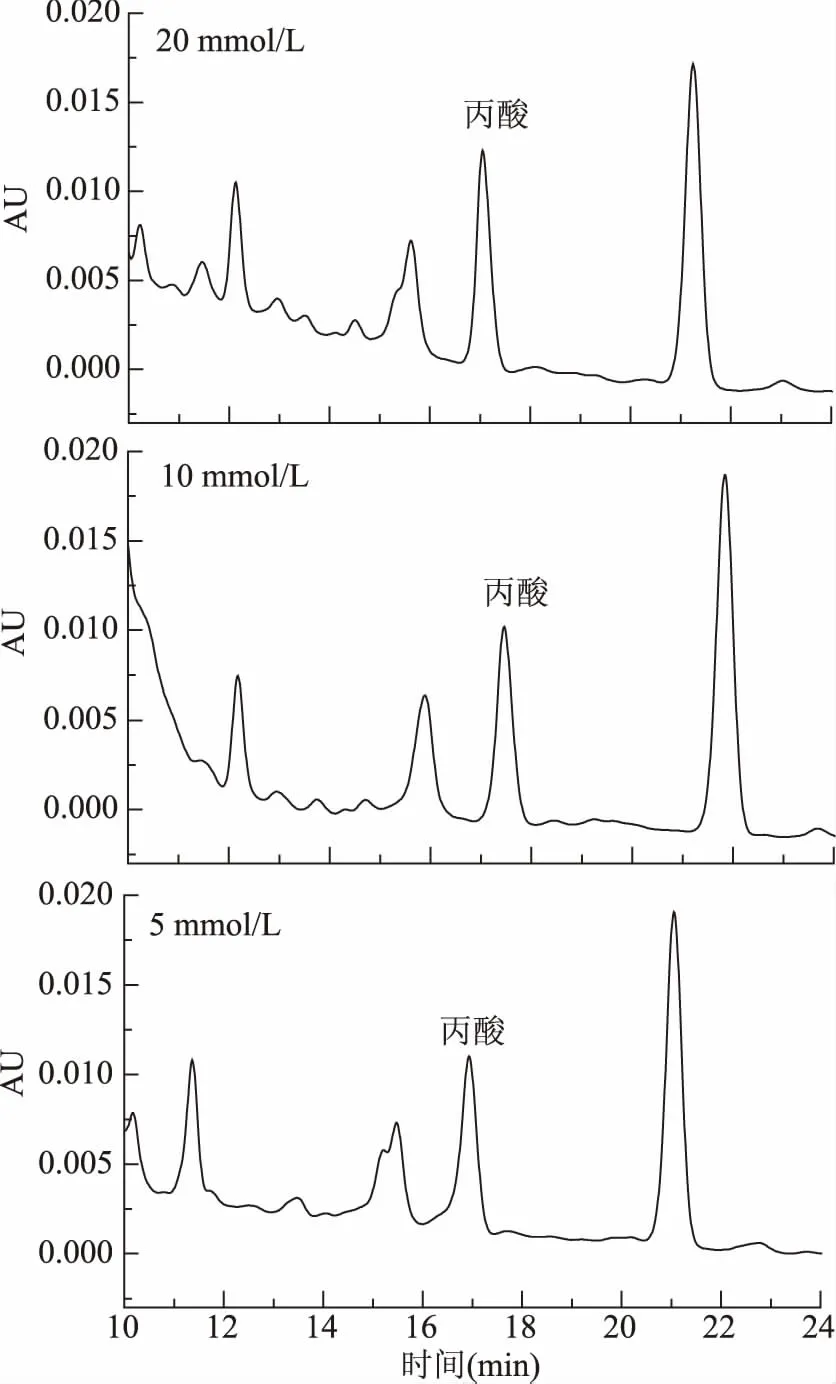
图7 缓冲盐浓度对丙酸及其盐类分离的影响
2.2.2.3 流动相pH的选择 由于丙酸为有机酸极性较大,在水溶液中易解离而不被非极性键合相保留,因此一般使用酸性流动相来抑制有机酸的解离[18-19],使有机酸尽可能以分子形式存在,以改善待测物的保留和分离。结果表明(图8):当pH为3.5时,峰形很宽;而pH4.0时,丙酸与杂质分不开;而pH2.0~3.0时保留时间变化很小,分离效果都比较好,从保护色谱柱的角度考虑,本实验选择流动相pH为3.0。
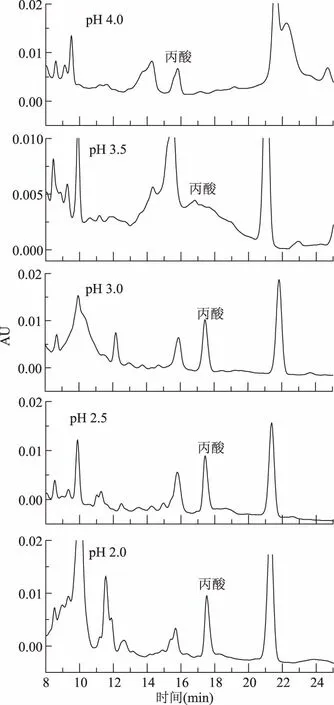
图8 缓冲盐酸度对丙酸及其盐类分离的影响
综上所述,实验选择10 mmol/L、pH3.0的(NH4)2HPO4溶液为流动相。
2.2.3 检测波长的选择 从图9丙酸的全波长扫描图可以看出,丙酸的最大吸收波长为214 nm,故选择214 nm作为检测波长。
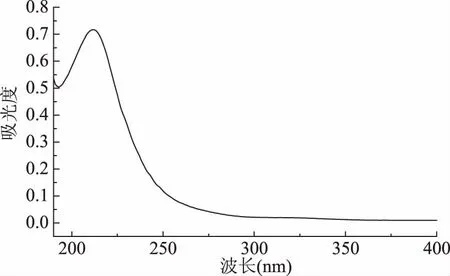
图9 丙酸的全波长扫描图
2.3 方法学评价
实验采用空白样品,按1.2.2样品前处理过程和1.2.5高效液相色谱条件,对方法学进行评价。
2.3.1 线性范围、检出限和定量限 丙酸在5.0~500.0 μg/mL之间线性关系良好,线性回归方程为:Y=1400X-544,R2大于0.999,LOD为0.02 g/kg,LOQ为0.05 g/kg。图10 为丙酸标准溶液(223.8 μg/mL)、面包空白样及加标水平为0.5 g/kg的液相色谱图。
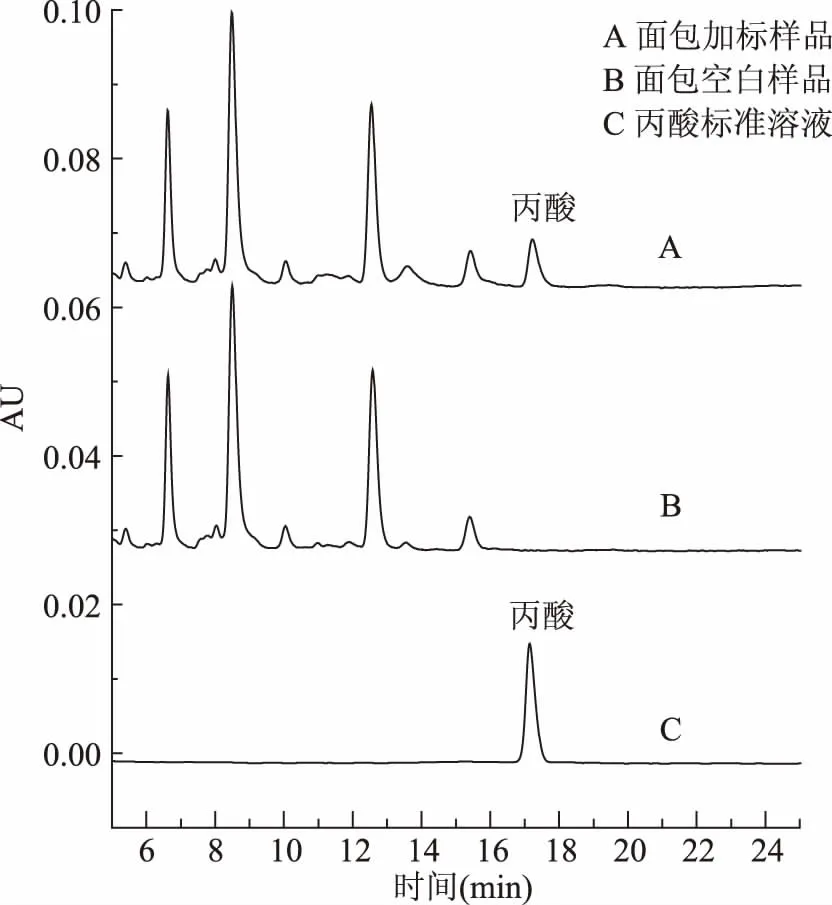
图10 实际样与加标样及丙酸标准溶液的液相色谱图
2.3.2 回收率和精密度 由表3可见,样品加标回收率为85.1%~109.4%,相对标准偏差为0.51%~3.78%。说明方法的数据稳定,精密度良好。
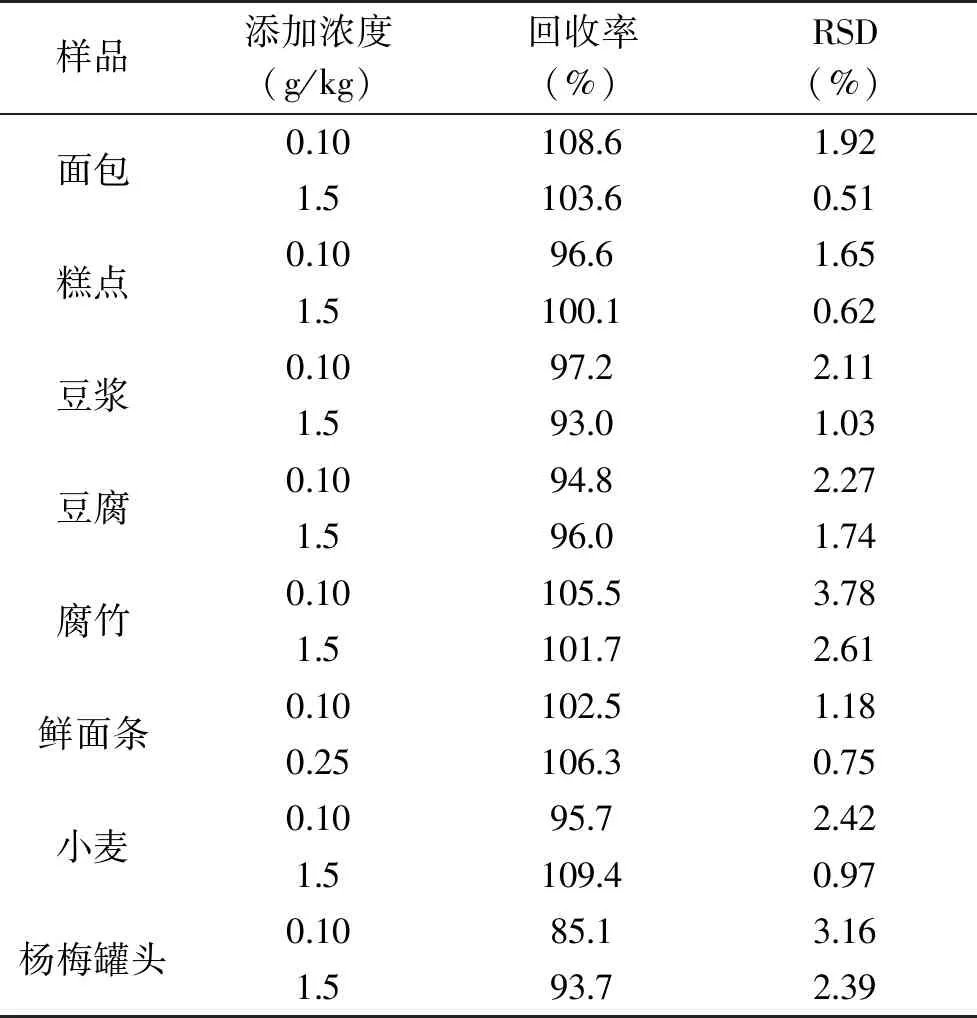
表3 方法的回收率和精密度(n=6)
2.4 实际样品的测定
应用本方法对市售的面包(10份)、糕点(10份)、豆制品(6份)、生湿面制品(4份)、原粮(3份)、其他(杨梅罐头加工工艺)(2份)进行分析。检测结果显示:6份面包检出,含量为0.104~1.170 g/kg,3份糕点检出,含量为0.229~0.248 g/kg,其余样品均未检出;所以所检样品中丙酸含量均低于GB 2760-2014中规定的限量要求(面包、糕点、豆类制品最大使用量均为2.5 g/kg,生湿面制品为0.25 g/kg,原粮1.8 g/kg,其他(杨梅罐头加工工艺)为50 g/kg)。
3 结论
系统考察了不同沉淀剂、不同沉淀剂用量、不同提取条件、不同提取方法对丙酸提取和分离的影响,并优化了色谱条件,建立了高效液相色谱法测定食品中丙酸及其盐类的分析方法。本方法用水提取食品中的丙酸及其盐类,采用亚铁氰化钾-乙酸锌沉淀剂沉淀蛋白和杂质,使试样前处理简单、快捷、试剂成本低;Atlantis T3 C18 色谱柱对丙酸具有较好的保留,在选定的磷酸氢二氨(10 mmol/L,pH3.0)溶液为流动相条件下,可实现目标物与杂质的完全分离、准确定性和定量。丙酸在5.0~500.0 μg/mL之间线性关系良好,平均回收率为85.1%~109.4%,方法定量限为0.05 g/kg。该方法简单易行,结果稳定、可靠、准确;适用于批量食品样品中丙酸的测定,为企业和检验机构提供了技术支持,提高了检验工作的工作效率。
