Geobacillus thermodenitrificans α-半乳糖苷酶原核表达及其酶学性质
2019-07-10石征宇鲁晶娣韦盘秋伍时华程谦伟
石征宇,鲁晶娣,韦盘秋,伍时华,程谦伟,黎 娅,易 弋,*
(1.广西科技大学生物与化学工程学院,广西柳州 545006; 2.广西糖资源绿色加工重点实验室(广西科技大学),广西柳州 545006; 3.广西高校糖资源加工重点实验室(广西科技大学),广西柳州 545006)
α-半乳糖苷酶(α-galactosidase)又称蜜二糖酶,属于外切糖苷酶类,能够专一催化糖链末端含α-1.6半乳糖苷键的多糖、糖蛋白、糖脂等物质[1],既能催化毛蕊花糖、棉籽糖、水苏糖和蜜二糖等低聚糖,又能催化一些含α-半乳糖苷键的杂多糖。α-半乳糖苷酶在自然界中分布广泛,主要存在于人、动植物及微生物体内,其中以植物来源研究较多,如水稻[2]、黄瓜[3]、咖啡豆[4]等;微生物来源主要有嗜热脂肪芽孢杆菌[5]、长双歧杆菌[6]、臭曲霉[7]等;此外,在各种哺乳动物体内,其组织匀浆中也含有α-半乳糖苷酶,尤其在人和鼠的甲状腺和肾脏等部位,α-半乳糖苷酶活性最高[8]。α-半乳糖苷酶具有多种用途,主要应用于饲料加工、食品、医学等领域。某些α-半乳糖苷酶在底物浓度较高时,具有转半乳糖基作用,利用这一特点可将其用于低聚糖的合成及环糊精衍生物的制备[9]。
豆科植物富含蛋白质,是很好的蛋白质饲料来源,但豆科植物中存在α-半乳糖苷等抗营养因子,且这类物质用普通方法很难将其降解,当其在动物体内大量积累时,会影响机体的代谢能力,降低对营养物质的吸收[10],严重时会引起胀气、厌食、腹泻等不良症状[11]。利用α-半乳糖苷酶的水解特点,在饲料加工过程中添加α-半乳糖苷酶,能够有效地降低α-半乳糖苷类抗营养因子的存在,从而促进动物的生长[12]。
在饲料加工过程中,常涉及到高温环节,这会对酶造成不可逆的失活,因此提高α-半乳糖苷酶的热稳定性是该酶在饲料工业大规模应用中必须解决的问题。目前,嗜热微生物依旧是热稳定性酶最直接和最可靠的来源[13]。Geobacillusthermodenitrificans是一种嗜热的革兰氏染色阳性细菌,好氧或兼性厌氧,属于Geobacillus属[16]。目前,国内外学者对该菌的研究甚少。本实验利用基因工程技术,人工设计Geobacillusthermodenitrificans(NG80-2)的α-半乳糖苷酶编码基因,并在大肠杆菌中进行重组表达,然后对该酶的酶学性质进行了系统的研究,旨在获得具有良好热稳定性的α-半乳糖苷酶,并为该酶的工业化应用提供相关理论依据。
1 材料与方法
1.1 材料与仪器
大肠杆菌BL21(DE3)、载体pGEX-4T-3 为本实验室保存;T4 DNA Ligase、DNA marker DL 5000 TAKARA公司;限制性内切酶EcoR I和BamH I Thermo Fisher;甘氨酸(Glycine)、氨苄青霉素、异丙基-β-D-硫代吡喃半乳糖苷 北京索莱宝科技有限公司;对硝基苯酚(4-nitrophenol) 天津市大茂化学试剂厂;对硝基苯基-α-D-吡喃半乳糖苷(PNPG) 上海源叶科技有限公司;对硝基苯酚(pNP) 天津市大茂化学试剂厂;Yeast Extract OXOID公司;GST琼脂糖凝胶FF 北京韦氏博慧色谱科技有限公司;McIlvaine缓冲液:Na2HPO414.626 g、C4H2O7·H2O 10.19 g,定容至1 L;PBS缓冲液:NaCl 8.006 g,KCl 0.201 g,KH2PO40.24 g,Na2HPO4·12H2O 3.581 g,ddH2O定容至1 L,调节pH至7.4;洗脱 buffer 1:Tris 0.61 g,NaCl 0.9 g,ddH2O定容至100 mL,调节pH至8.3;洗脱buffer 2:Tris 0.61 g,还原性谷胱甘肽0.614 g,ddH2O定容至100 mL,调节pH至8.3。
SQP电子天平 赛多利斯科学仪器;UV-8000S紫外可见分光光度计 上海元析仪器有限公司;H2100R医用离心机 湖南湘仪实验室仪器开发有限公司;Tpersonal PCR仪 Biometra;S220多参数测试仪 梅特勒-托利多仪器(上海)有限公司;BL0N-1000Y超声波信号发生器 上海比郎仪器制造有限公司。
1.2 实验方法
1.2.1 重组菌的构建Geobacillusthermodenitrificansα-半乳糖苷酶编码基因的获取:根据GenBank数据库所提供的氨基酸序列(登录号:WP_011887668),人工设计酶的编码基因,并利用网络服务器进行密码子优化(http://www.jcat.de/Start.jsp),同时,在基因两端分别加入EcoR I和BamH I酶切位点,送由杭州弘赛生物科技有限公司进行合成。对载体进行双酶切,分别回收目的基因片段和表达载体片段,并利用T4连接酶于16 ℃连接12 h,将重组质粒转化到感受态细胞E.coliBL21(DE3)中,后均匀涂布在LB固体培养基(含100 μg/mL Amp)上,37 ℃培养14 h后,挑取阳性菌落进行双酶切和PCR验证,并送广州英俊有限公司进行测序。
1.2.2 重组蛋白的诱导表达 重组菌接种于LB液体培养基(含100 μg/mL Amp)中,37 ℃培养12 h后,以1%的接种量转接到100 mL LB液体培养基(含100 μg/mL Amp),于37 ℃培养,待OD600值达到0.4~0.6时,加入异丙基硫代半乳糖苷(IPTG)使其工作浓度为0.1 mmol/L,并在28 ℃下诱导表达5 h。将诱导完成的菌液在10000 r/min下离心10 min,去上清,用pH7.4的PBS缓冲液洗涤菌体3次,再按1∶10的体积比将菌体重悬于PBS缓冲液中,利用超声细胞破碎仪在冰水浴下进行细胞破碎(200 W,工作8 s间歇8 s,共80次),破碎后的细胞液12000 r/min离心15 min,取上清液即为粗酶液,备用。
1.2.3 目的蛋白的纯化 利用GST琼脂糖凝胶柱对目的蛋白进行纯化,纯化步骤如下:用洗脱 buffer 1平衡5个柱体积,将10 mL粗酶液用洗脱 buffer 1缓冲液稀释到20 mL,0.45 μL滤膜过滤,上样,再用洗脱 buffer 1洗10个柱体积,用洗脱 buffer 2进行洗脱,收集洗脱液(即纯酶),利用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测纯化结果。
1.2.4 酶活力的测定 在pNPG法[13]的基础上略有改动。将pNPG溶于McIlvaine缓冲液[14]中,使其终浓度为10 mmol/L。将5 μL纯酶加入695 μL McIlvaine缓冲液中,37 ℃温水浴5 min,加入50 μL 10 mol/L的pNPG,于相应的条件下反应10 min,反应完成后,加入3.25 mL 0.5 mol/L的Na2CO3溶液终止反应,于紫外可见分光光度计595 nm波长下测其OD值。按照pNG的标准曲线回归方程y=213.27187x+0.17168(R2=0.9998),计算α-半乳糖苷酶酶活。酶活定义:1 min内水解1 μmol pNPG转化为pNG所需的酶量,单位μmol/min。
1.2.5 酶学性质的测定
1.2.5.1 最适温度及温度稳定性 分别在25~75 ℃下进行酶促反应,按照1.2.4的实验方法测定酶活,确定α-半乳糖苷酶的最适温度;然后在45、50、55、60、65、70、75 ℃温度下,对该酶处理不同时间(20、40、60、80、100、120、150 min),并在最适温度下进行酶促反应,按照1.2.4的实验方法测定酶活。以测定的最高酶活为100%,其他酶活占最高酶活的百分数即为相对酶活。
1.2.5.2 最适pH及pH稳定性 配制pH3.0~8.0的磷酸氢二钠-柠檬酸缓冲液和pH9.0~10.0的Tirs-HCl缓冲液,将pNPG溶于不同的pH缓冲液中,在最适温度下,按照1.2.4的实验方法测定酶活,以确定重组酶的最适pH;将酶液在不同pH的缓冲液中,70 ℃处理1、2 h,然后pH6.0及70 ℃下进行酶促反应,以未处理的酶液作为对照,其他酶活占最高酶活的百分数即为相对酶活。
1.2.5.3 不同金属离子对酶活性的影响 选取化合物或金属离子Fe3+、Cu2+、K+、Ca2+、Mn2+、Mg2+、Zn2+、Na+、Co2+、EDTA、Ag+、Ni+、Al3+、Hg+,以McIlvaine缓冲液配制工作浓度为0.5 mol/L的离子溶液,按1.2.4中的方法配制酶反应体系,在最适温度和最适pH下进行反应。以不添加金属离子的酶活作为100%,其他酶活占最高酶活的百分数即为相对酶活。
1.2.5.4 动力学常数的测定 利用McIlvaine缓冲液配制不同浓度的pNPG溶液(1、2、4、6、8、10 mmol/L),在最适条件下按1.2.4中的方法进行反应,以测定在不同底物浓度[S]下的反应速率V。采用双倒数作图法确定Km和Vmax。
1.3 数据处理
每组实验重复三次,结果取平均值±标准差,利用Excel进行数据处理和绘图。
2 结果与分析
2.1 α-半乳糖苷酶的纯化结果
蛋白诱导表达及纯化的电泳结果见图1。泳道1是前期构建的工程菌且未添加IPTG的电泳图,从图1中可知,在未添加IPTG时,重组工程菌并不产生重组蛋白,而加入适量的IPTG后,α-半乳糖苷酶可在大肠杆菌宿主菌中成功表达,且重组蛋白分子量大小在100~110 kDa之间,与理论值一致(GST标签约是26 kDa,目的蛋白约是84 kDa)。泳道5在目标位置出现单一条带,说明目标蛋白纯化效果较好。
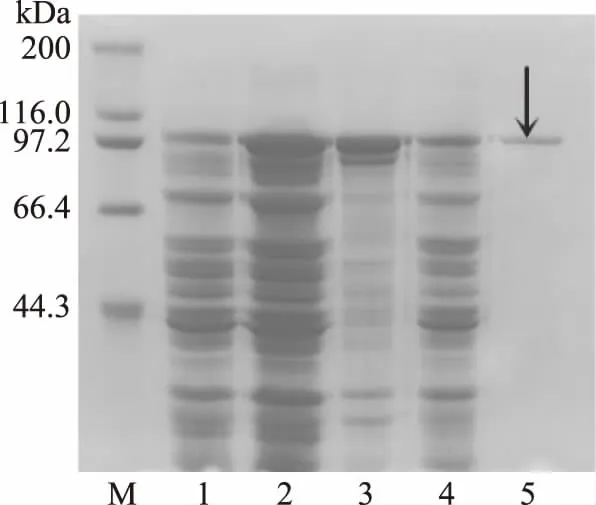
图1 重组蛋白纯化结果Fig.1 Results of purified recombinant protein 注:M:蛋白marker;1:对照;2:诱导全蛋白质; 3:诱导上清;4:诱导沉淀;5:纯化结果。
2.2 酶学性质的测定结果
2.2.1 最适反应温度 图2为温度对α-半乳糖苷酶酶活的影响。由图2可知,在相同的反应体系下,温度为30~70 ℃时,α-半乳糖苷酶的酶活力随温度的升高而升高;在反应温度为70 ℃时,α-半乳糖苷酶酶活力达到最大,可见70 ℃为α-半乳糖苷酶的最适反应温度;而后随着温度继续升高,α-半乳糖苷酶酶活力迅速下降,说明在高温情况下该酶迅速失活,不宜在高于70 ℃的条件下进行催化反应。

图2 温度对α-半乳糖苷酶酶活的影响Fig.2 Effect of temperature on the activity of α-galactosidase
2.2.2 温度稳定性 按照上面1.2.4的反应体系,在不同的温度下对纯酶进行处理,最适温度下测定剩余酶活。图3为α-半乳糖苷酶的温度稳定性测定结果。从图3可以看出,α-半乳糖苷酶在45~65 ℃处理150 min后,剩余酶活还保留在55%以上,说明该酶的较适应催化温度为45~65 ℃。而在70 ℃下处理80 min后,剩余酶活仍有60%以上,75 ℃处理60 min剩余酶活只有18%左右,因此该酶不宜在75 ℃及以上的高温下长时间发挥作用。
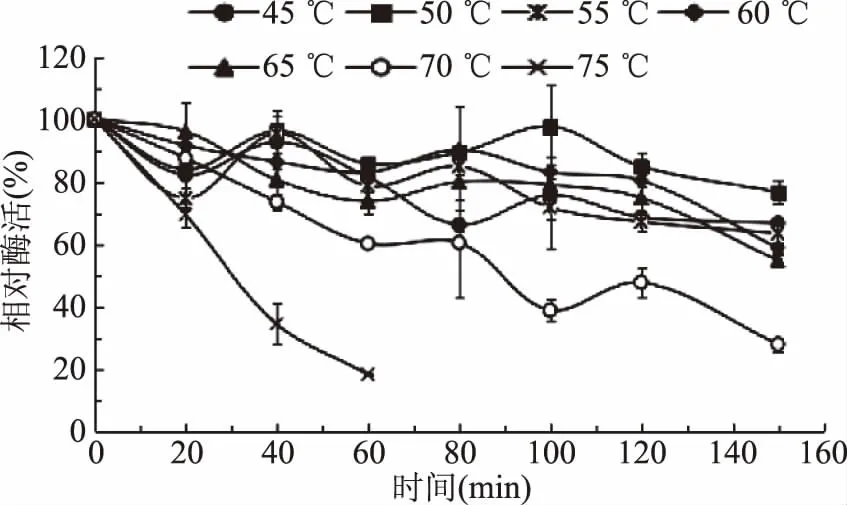
图3 α-半乳糖苷酶的温度稳定性Fig.3 Temperature stability of α-galactosidase
2.2.3 最适pH 图4为pH对α-半乳糖苷酶酶活的影响。由图4可知,α-半乳糖苷酶的酶活力随环境pH的改变出现较大的变化。当pH为2~4时,α-半乳糖苷酶的酶活力几乎为零;而后随着pH的升高,酶活逐渐上升,在pH6.0时酶活力达到最大;当酶反应环境的pH继续升高时,α-半乳糖苷酶的酶活力逐渐下降。因此,重组α-半乳糖苷酶的最适pH为6.0。
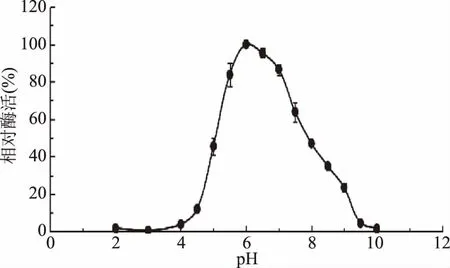
图4 pH对α-半乳糖苷酶酶活的影响Fig.4 Effect of pH on the activity of α-galactosidase
2.2.4 pH稳定性 图5为α-半乳糖苷酶的pH稳定性测定结果。由图5可知,在不同pH条件下对α-半乳糖苷酶处理1、2 h,其酶活保留率仍在70%以上,在pH5.0~6.5缓冲液中处理2 h,剩余酶活仍能达到原酶活的90%以上,在pH3.0~4.0的范围内处理2 h,仍具有80%以上的活力,并且处理1、2 h,α-半乳糖苷酶的剩余酶活无明显变化。由图5还可看出,α-半乳糖苷酶的pH稳定性的变化趋势与最适pH的变化趋势极为相似,酶活性均出现先升高后降低的趋势,并且该酶在低pH条件下稳定性较好,说明该酶适合偏酸性的环境。

图5 α-半乳糖苷酶的pH稳定性Fig.5 pH stability of α-galactosidase
2.2.5 金属离子及化合物对α-半乳糖苷酶的影响 金属离子对α-半乳糖苷酶酶活的影响结果见图6。从图6可知,Cu2+、Ag+、Hg+能够完全抑制α-半乳糖苷酶的活性,而Fe3+、Ca2+、Mn2+、Zn2+对α-半乳糖苷酶的活性具有不同程度的激活作用,其中以Zn2+对α-半乳糖苷酶的激活效果最好,EDTA、K+、Na+、Al3+、Ni+等离子对α-半乳糖苷酶酶活性影响不大。

图6 金属离子及化学试剂对α-半乳糖苷酶酶活的影响Fig.6 Effects of metal ions and chemical reagents on the activity of α-galactosidase
2.2.6α-半乳糖苷酶动力学常数的测定结果 按照米氏方程,采用Lineweaver-Burk双倒数作图法测定α-半乳糖苷酶的Km和Vmax,结果如图7所示。在最佳反应条件下,α-半乳糖苷酶的Km为10.04 mmol/L,Vmax为18.25 μmol/min。
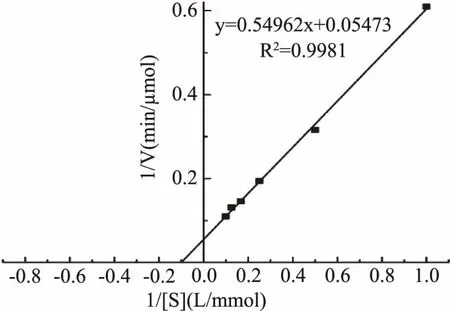
图7 α-半乳糖苷酶的Lineweaver-Burk曲线Fig.7 Lineweaver-Burk curve of α-galactosidase
3 讨论
Geobacillusthermodenitrificans属于Geobacillus属[15],Geobacillus属的菌株多分布在火山、油田、干草堆等高温环境,具有嗜热、降解烃等应用价值,由于所处环境特殊,这类细菌可能具有某些特种酶或特殊功能的基因。本研究利用大肠杆菌原核表达系统对来源于Geobacillusthermodenitrificans的α-半乳糖苷酶编码基因进行了重组表达,利用GST琼脂糖凝胶柱对目的蛋白进行纯化,经SDS-PAGE检测显示,重组α-半乳糖苷酶分子量为100~110 kDa。酶学性质结果显示,重组α-半乳糖苷酶的最适反应温度为70 ℃,与其它研究所报道的α-半乳糖苷酶的最适温度相比较高,李苏红等[2]研究重组水稻α-半乳糖苷酶的最适反应温度为45 ℃;陈俊亮等[6]研究长双歧杆菌α-半乳糖苷酶,结果显示该酶的最适反应温度为42 ℃。本研究得到重组α-半乳糖苷酶的最适pH为6.0,这与大多数的研究结果相近[14],并且重组酶在pH3.0~4.0的范围内处理2 h,仍具有80%以上的活力,说明该酶可在偏酸性条件下长时间发挥催化作用。
不同金属离子对酶分子活性呈现出不同的特性,有的可以使酶的活性降低甚至丧失,有的却可以使酶活力提高或者增加酶的稳定性。在本研究中,Hg+能够强烈抑制α-半乳糖苷酶的活性,这与陈俊亮等人报道的Hg+是α-半乳糖苷酶的抑制剂相符[6]。Hg+之所以能够抑制α-半乳糖苷酶的活性,可能是因为在该酶的催化位点附近含有半胱氨酸残基,Hg+通过与半胱氨酸残基残基侧链上的巯基发生作用,从而抑制α-半乳糖苷酶的活性[16]。有研究报道指出,Ag+对α-半乳糖苷酶表现出了强烈的抑制作用[17],这与本研究结果一致,Ag+对α-半乳糖苷酶的抑制作用,可能是因为在该酶的活性中心位置,存在组氨酸或含有羧基的氨基酸[18]。Mn2+、Zn2+、Fe3+等离子对酶活有激活作用,以Zn2+离子最为显著,其原因可能是,通过电荷间的相互作用增加了盐桥的数量,盐桥间相互交联产生了稳定的三级结构[19]。K+和Na+离子对α-半乳糖苷酶活性无明显影响,可能是因为K+、Na+等离子是胞内外常见离子,其生物学作用主要是维持细胞内外的渗透压以及中和阴离子的电荷。EDTA作为一种常见的金属离子络合剂,通过与酶活中心的金属离子形成稳定的络合物,进而影响酶的催化效率,但在本研究中发现EDTA对酶活性的影响很小,这与李苏红[2]、密士军[16]等人的研究结果相一致,这可能是因为该酶的活性中心并不存在金属离子辅基,进而不能与EDTA形成络合物。
通过Lineweaver-Burk双倒数作图法得到,α-半乳糖苷酶的Km为10.04 mmol/L,Vmax为18.25 μmol/min,这与沈汪洋等[4]测定的咖啡豆α-半乳糖苷酶的Km=0.556 mmol/L、Vmax=1.19 μmol/min有较大的差别[4],通过对比Km值发现,咖啡豆α-半乳糖苷酶对底物的亲和能力强于本研究α-半乳糖苷酶,但最大反应速率低于本研究。
4 结论
对重组工程菌进行IPTG诱导,并对破包后的粗酶液进行GST琼脂糖凝胶柱纯化,经SDS-PAGE后测得重组蛋白的分子量为100~110 kDa。酶学性质结果表明,重组α-半乳糖苷酶的最适反应温度为70 ℃,最适pH为6.0,并且重组酶在pH3.0~4.0的范围内处理2 h,仍具有80%以上的活力,说明该酶可在偏酸性条件下长时间发挥催化作用,Cu2+、Ag+、Hg+能够完全抑制α-半乳糖苷酶的活性,而Fe3+、Ca2+、Mn2+、Zn2+对α-半乳糖苷酶的活性具有不同程度的激活作用,其中以Zn2+对α-半乳糖苷酶的激活效果最好,在最佳反应条件下测得α-半乳糖苷酶的Km为10.04 mmol/L,Vmax为18.25 μmol/min。目前,耐热α-半乳糖苷酶的工业化生产尚未实现,因此发掘性质优良的α-半乳糖苷酶迫在眉睫。与其它已报道的α-半乳糖苷酶相比,本研究的重组α-半乳糖苷酶具有较好的热稳定性和pH稳定性等优点,较其他来源的α-半乳糖苷酶有更好的应用前景。
