浓香型白酒对急性酒精中毒小鼠宿醉头痛指标的影响
2019-07-09胡力文赵婉妤裴晓方卢中明杜礼泉
胡力文,杨 飞,赵婉妤,许 欣*,裴晓方,卢中明,杜礼泉,郑 敏
(1.四川大学 华西公共卫生学院/四川大学华西第四医院,四川 成都 610041;2.四川省绵阳市丰谷酒业有限责任公司,四川 绵阳 621006)
中国酒文化源远流长,酒在当今社会的各种交际活动、社交场合更是不可或缺。但近年来研究显示,国内外急性酒精中毒发病率均呈上升趋势,考虑其庞大群体,并且容易成为多种急症的诱发因素,故应予以重视[1]。急性酒精中毒是指在短时间内摄入大量酒精或含酒精饮料后出现的中枢神经系统功能紊乱状态,严重程度与饮酒速度、饮酒量、血液酒精浓度及个体耐受性等有关,通常伴有头痛、头晕和胃部不适等延续效应[1-2]。
宿醉头痛或是酒精诱导的迟发性头痛通常在饮酒结束后的4~24 h内发生,出现与偏头痛发病类似的症状(如畏光、单侧头痛等[3])。关于头痛的机制众说纷纭,目前占据主导地位的是三叉神经血管说,学者们认为当三叉神经末梢受刺激时,会引起颅内脑外血管扩张,使环绕血管周围的三叉神经感觉C纤维释放具有强烈血管刺激作用的肽类物质,并刺激脑内肥大细胞脱颗粒释放具有血管活性、促炎、感觉敏感介质,从而引起头痛[4-6]。
随着生活方式的改变,人们对生活质量的要求越来越高。白酒作为饮品,不仅要求饮时口感舒适,而且更注重饮后的体征感受;既能满足对人精神激活的程度,又不至于影响生活、工作和健康。目前,已有研究表明不同品质白酒对机体的影响存在差异[7-8],但鲜见针对饮酒上头的相关研究报道,故本研究将采用急性酒精中毒小鼠模型,结合行为学表现,探讨比较不同浓香型白酒对宿醉头痛相关效应指标的影响,为酿酒工艺的进一步改良奠定实验基础。
1 材料与方法
1.1 材料与试剂
同品牌不同勾调工艺的48°浓香型白酒(编号分别为①号、②号),主要理化成分见表1,由四川省绵阳市丰谷酒业有限公司提供。

表1 48°浓香型白酒主要理化成分Table 1 Main physical and chemical components in strong-flavor Baijiu with 48%alcohol content
Balb/c小鼠(雄性,日龄(42~48 d),SPF级):北京维通利华实验动物有限技术公司(生产许可证号:SCXK(京)2016-0011)。独立通气笼盒(individually ventilated cages,IVC)室饲养,环境温度20~22℃,相对湿度60%~70%,由四川大学华西公共卫生学院实验动物中心提供(使用许可证号:SYXK(川)2018-011)。
肝素试剂:南京建成生物工程研究所;乙醇(体积分数99.7%,分析纯):成都海兴化工试剂厂;前列腺素E2(prostaglandin E2,PGE2)酶联免疫测定试剂盒、组胺(histamine,HIS)酶联免疫测定试剂盒:武汉伊莱瑞特生物科技股份有限公司;小鼠内皮素(endothelin,ET)酶联免疫检测试剂盒、小鼠P物质(substance P,SP)酶联免疫检测试剂盒、小鼠甲硫氨酸脑啡肽(methionine enkephalin,MEK)酶联免疫检测试剂盒:上海酶联科技生物有限公司;1%乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、抑肽酶、降钙素基因相关肽(calcitonin gene related peptide,CGRP)放射免疫测定试剂盒:美国凤凰生物公司。
1.2 仪器与设备
7890B气相色谱仪、7697A顶空进样器:美国Agilent公司;ECTM-WAX毛细管色谱柱(30 m×0.53 mm×1.2μm):美国Alltech公司;HeraeusTMFrescoTM21微量离心机、Multiskan Go全波长酶标仪:美国Thermo Scientific公司;749540-0000手持式匀浆器:美国Kimble公司;γ放射免疫计数器:安徽中科中佳科学仪器有限公司;手动连续分液器:美国Gilson公司;TS-1脱色摇床、XW-80A涡旋混合器:海门市其林贝尔仪器制造有限公司;隔水式电热恒温培养箱:上海跃进医疗器械厂;V型槽:自制。
1.3 方法
1.3.1 动物分组与处理
160只Balb/c小鼠适应性饲养后,按体质量进行分层随机分组,分为样①组、样②组、酒精对照组和空白对照组,剂量设置见表2。

表2 实验动物分组与处理情况Table 2 Grouping and processing of experimental animals
1.3.2 翻正反射实验
禁食不禁水12 h,不同组别小鼠称体质量后,分别按相应剂量进行灌胃。参考CRABBE JC等方法[9],将小鼠背部置于V型槽中呈仰位,30 s内未能翻转身体,即翻正反射消失,记录醉酒时间(min);60 s内能连续2次翻转身体,即翻正反射恢复,记为醒酒时间(min);并计算醉酒率(%)。
1.3.3 标本采集与处理
当小鼠翻正反射恢复时,立即抓取固定使其眼球突出充血,用弯头眼科镊迅速钳取眼球,使血液流入抗凝离心管中,颠倒混匀后4℃、3 000 r/min离心15 min,取上清,-20℃冰箱保存备测。不同的抗凝剂适用于不同的指标测定,加入100μL肝素钠溶液的抗凝管用于乙醇、PGE2、HIS含量测定;加入100μL 1%EDTA、100μL抑肽酶的抗凝管用于ET、SP、MEK、CGRP含量测定。
1.3.4 指标检测
血浆乙醇浓度测定:标本平衡至室温后,取200μL待测标本加入顶空玻璃中,再加入2 mL超纯水,盖紧瓶盖后放于顶空进样装置中进行汽化平衡,自动进样1 mL,气相色谱法检测。色谱条件:ECTM-WAX毛细管色谱柱(30 m×0.53 mm×1.2μm);分流进样,分流比10∶1;载气:N2(纯度99.999%),流速25 cm/s;氢火焰离子化检测器:250℃;进样口温度:200℃;程序升温:40℃保留5 min,以20℃/min升至200℃,保留7 min;顶空气化条件:平衡时间30 min,加热温度70℃,传输线温度90℃,进样针温度70℃。
血浆PGE2、HIS、ET、SP、MEK浓度测定:标本及酶联免疫吸附法检测试剂盒平衡至室温后,取10μL待测标本加入反应板内,再加入40μL样品稀释液,轻摇晃动后加入100μL辣根过氧化物酶标记的检测抗体,37℃温育60 min,洗涤后加入显色剂,37℃避光显色15 min,最后加入终止液,以空白对照孔调零,测定各孔450 nm波长下的吸光度值,标准曲线法定量。
血浆CGRP浓度测定:标本及放射免疫法检测试剂盒平衡至室温后,取100μL待测标本加入含有特异性兔抗血清的反应体系内,涡旋振荡混匀,4℃孵育24 h后加入100μL125I-示踪溶液,涡旋振荡混匀后4℃孵育24 h,最后加入100μL羊抗兔IgG血清,室温孵育90 min,再加入500μL反应缓冲液,混匀后4 ℃,3 000 r/min离心20 min,放射性γ-计数仪进行沉淀放射衰变率检测,标准曲线法定量。
1.3.5 数据的统计及处理
采用SPSS 21.0软件进行统计分析和处理,正态分布数据采用均值±标准差(X±S)表示。方差齐时进行单因素方差分析(analysis of variance,ANOVA),LSD检验进行组间两两比较;方差不齐时使用Kruskal-Wallis检验。
2 结果与分析
2.1 行为学指标
急性酒精中毒是指一次性过量饮酒所致的急性中毒,常伴有头痛、头晕和胃部不适等延续效应[2]。研究表明,当乙醇暴露剂量超过3.5 g/kg,绝大多数小鼠均会出现翻正反射消失的现象[10],故根据前期预实验,本研究采用11 mL/kg体质量(约4.2 g/kg)的单次灌胃剂量进行急性酒精中毒模型建立。不同组别翻正反射实验行为学指标检测结果见表3。

表3 翻正反射实验行为学指标检测结果(x±s,n=40)Table 3 Determination results of behavioral indicators by righting reflex test
由表3可知,样①组醒酒时间极显著低于酒精对照组(P<0.01);其余组间差异无统计学意义(P>0.05)。各组间醉酒时间无统计学差异(P>0.05)。本研究显示样①组、样②组醉酒时间长于酒精对照组,而醒酒时间则短于酒精对照组,提示酒样组具有“醉得慢,醒得快”的趋势,与张梦妍等[11]对浓香型白酒醉酒度评价研究结果一致。
2.2 乙醇代谢指标
饮酒后,乙醇主要在胃肠道被吸收,约90%~98%的乙醇通过肝脏进行代谢,代谢速率与摄入量、酶活性等相关[12-13]。不同组别血浆乙醇含量检测结果见表4。
由表4可知,样①组、样②组和酒精对照组乙醇含量无统计学差异(P>0.05),由于灌胃剂量相同,故可推测酒样①、酒样②和酒精对照在机体内的代谢速度相近。除此之外,过量摄入乙醇后,当超过肝脏代谢负荷时,部分乙醇则会直接穿过血脑屏障进入脑部,进而直接或间接引起脑部损伤[14],且暴露剂量与损伤程度呈正相关关系。由表4可以看出样①组、样②组和酒精对照组乙醇含量相当,提示酒精暴露组可能产生程度相近的脑损伤。

表4 血浆中乙醇含量检测结果(x±s,n=10)Table 4 Determination results of ethanol content in plasma
2.3 炎性介质指标
前列腺素参与哺乳动物的炎症反应,是一类重要的炎症因子[16],PGE2刺激神经末梢是造成炎症组织疼痛的主要原因[16]。不同组别血浆炎性介质含量检测结果见表5。
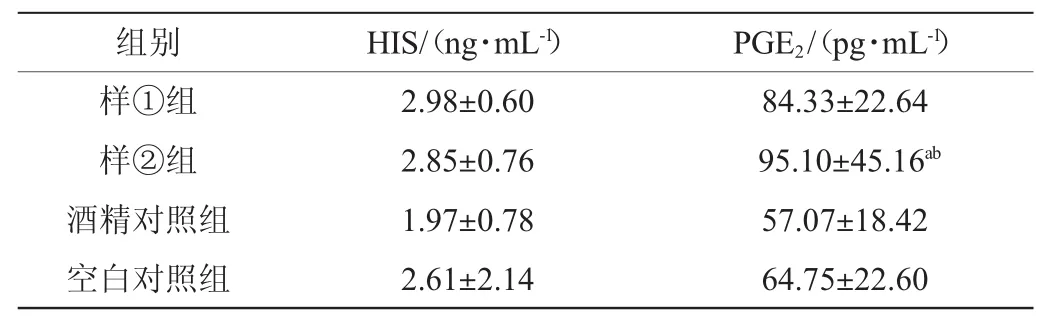
表5 血浆中炎性介质含量检测结果(x±s,n=10)Table 5 Determination results of inflammatory medium content in plasma
由表5可知,样①、样②组PGE2含量高于酒精对照组、空白对照组,且样②组PGE2含量显著高于酒精对照组和空白对照组(P<0.05),提示酒样具有一定程度的致炎作用,具体可能与酒样中杂醇油等微量成分有关。各组间血浆HIS含量无统计学差异(P>0.05)。
2.4 神经递质指标
CGRP是血管周围神经释放的最主要的血管活性肽类物质,是迄今已知最强的血管舒张肽,在偏头痛的发病机制中起着关键性作用[17]。不同组别血浆CGRP、ET含量检测结果见表6。

表6 血浆中降钙素基因相关肽、内皮素含量检测结果(x±s,n=10)Table 6 Determination results of calcitonin gene related peptide and endothelin content in plasma
本研究发现不同组别间CGRP含量无统计学差异(P>0.05),提示宿醉头痛与偏头痛机制可能存在一定的差异。ET是强烈的血管收缩剂,可引起各种血管剧烈收缩,促进血管内皮收缩因子的释放,导致组织缺血、缺氧[18]。当ET过量释放,作用于脑血管,可使局部血管发生强烈收缩、痉挛[19]。本研究结果显示,空白对照组、酒精对照组ET含量高于样①组、样②组,说明酒样可通过降低ET含量使局部血管收缩减弱,进而减少疼痛感。
研究表明SP由中枢端末梢神经释放,参与痛觉传递,可促进抑制性神经递质(MEK等)释放引起镇痛作用[20]。不同组别血浆MEK、SP含量检测结果见表7。
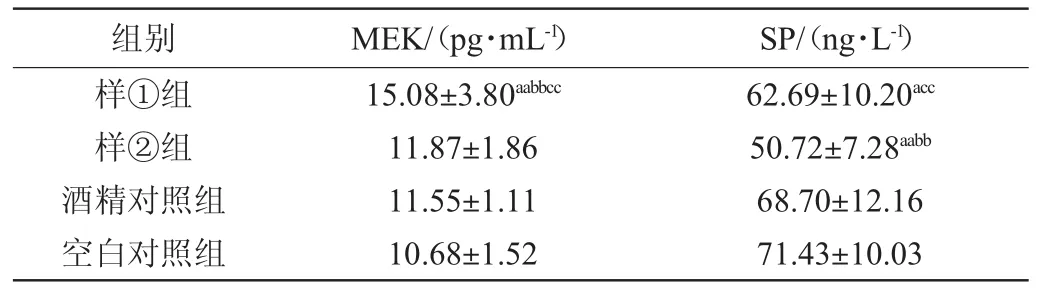
表7 血浆中甲硫氨酸脑啡肽、P物质含量检测结果(x±s,n=10)Table 7 Determination results of MEK and P substance content in plasma
由表7可知,样①组血浆MEK含量极显著高于样②组、酒精对照组、空白对照组(P<0.01);其余组间差异无统计学意义(P>0.05)。样②组血浆SP含量极显著低于样①组、酒精对照组、空白对照组(P<0.01);其余组间差异无统计学意义(P>0.05)。
本研究发现样①组SP、MEK含量均高于样②组,提示样①组疼痛感较样②组更严重。田学梅等[20]提出过量醛类物质、酸酯比例失调等是饮酒后上头的主要因素,结合两种酒样的理化分析结果推断,可能与酒样①中含有更高的总酸、乙醛、乙缩醛等微量成分有关。
3 结论
综上所述,不同浓香型白酒对小鼠宿醉头痛相关效应指标的影响存在差异,其中酒样①较酒样②能诱导产生更高的SP、MEK含量水平,结合白酒理化成分分析,提示可能与酒样中较高的总酸、乙醛、乙缩醛等微量成分有关。
