三七总皂苷对杠柳毒苷代谢产物杠柳次苷药代动力学的影响*
2019-07-09姚广哲欧阳慧子常艳旭
李 丽,贾 琪,姚广哲,欧阳慧子,常艳旭,何 俊
(1.天津中医药大学,天津市现代中药重点实验室,天津 301617;2.天津中医药大学第一附属医院,天津 300193)
香加皮为临床常用中药材,主要用于治疗心力衰竭和风湿性关节炎,其化学成分主要为强心苷类、C21甾类、萜类,以及脂肪酸类。但是不合理使用后可能引起的恶心、呕吐、腹泻、心动过缓等诸多不良反应严重限制了其临床应用。杠柳毒苷与杠柳次苷均为香加皮药材中的甲型强心苷类成分[1]。杠柳毒苷作为香加皮主要有毒/有效成分,口服后可在体内发生代谢转化,主要存在形式为杠柳次苷[2]。杠柳次苷具有强心、抗肿瘤等作用[3-6],但同时也具有比杠柳毒苷更强的细胞毒性[7]。三七总皂苷是中药三七的主要药效物质,在维持血液循环、改善心脑血管、抗炎方面均显示出一定的药理作用[8]。研究表明,三七总皂苷与香加皮提取物或杠柳毒苷配伍后,均可降低杠柳毒苷产生的毒副作用[9]。本课题组在前期研究的基础上[10],考察了三七总皂苷对杠柳毒苷代谢产物杠柳次苷在大鼠体内药动学的影响,初步揭示了香加皮、三七配伍减毒的作用机制,为临床上香加皮、三七的配伍使用提供了理论依据。
1 材料
1.1 药品与试剂 杠柳毒苷(批号:DST170907-041)、杠柳次苷(批号:DST170918-043)、三七总皂苷(批号:DST170815,人参皂苷 Rb1、Rd、Re、Rg1 和三七皂苷R1总量≥73.91%)购于成都德思特生物技术有限公司,补骨脂素(批号:180301-018)购于中国食品药品检定研究院,以上对照品(除杠柳毒苷外)质量分数均≥98%。
乙酸乙酯为分析纯(天津康科德科技有限公司),甲醇、乙腈为色谱纯(美国Fisher公司),色谱级甲酸(美国ROE公司),实验用水为自制超纯水。
1.2 仪器 Agilent6430三重四级杆串联质谱仪(美国Agilent公司);Agilent1200高效液相色谱仪(美国 Agilent公司);5424R型高速离心机(德国eppendorf公司);Milli-Q超纯水制备仪(Millipore公司);XPE205型十万分之一天平(瑞士METTLER TOLEDO公司)。
1.3 动物 清洁级雄性SD大鼠(220±30)g,动物许可证号:SCXK(京)2014-0004。
2 方法与结果
2.1 对照品溶液的配制
2.1.1 杠柳次苷标准溶液的配制 精密称取杠柳次苷对照品9.99 mg,甲醇溶解于10 mL容量瓶中,稀释至刻度,配制成浓度为0.999 mg/mL的储备液,密封后置于4℃冰箱储存备用,待用时用甲醇依次稀释,配制成杠柳次苷浓度为10~5 000 ng/mL的工作溶液。
2.1.2 内标溶液的配制 精密称取补骨脂素10.01 mg,甲醇溶解于10 mL容量瓶中,稀释至刻度,制备成浓度为1.001 mg/mL的储备液,密封后置于4℃冰箱冷藏,待用时用甲醇稀释成1μg/mL的内标(IS)溶液备用。
2.2 血浆样品中杠柳次苷LC-MS/MS分析方法的建立
2.2.1 色谱条件 Waters CORTECSTM C18色谱柱(2.1 mm×50 mm,2.7μm);流动相:B 为乙腈,A 为0.1%甲酸水;流速0.3 mL/min,梯度洗脱(0~7 min,19%~50%B;7~9 min,50%~50%B);柱温为 30 ℃;进样量5μL。
2.2.2 质谱条件 采用电喷雾离子源(ESI),正离子检测,检测模式为多反应离子监测(MRM);干燥气温度:300℃;干燥气流速:11 L/min;雾化器压力:15 psi。杠柳次苷和补骨脂素的定量离子对分别为535.3→113.1和187.0→131.1;碎裂电压分别为135 V和115 V;碰撞能量分别为20 V和25 V。
2.3 给药方案及血浆样品处理方法
2.3.1 给药方案 将18只SD大鼠随机分成3组,分别为:杠柳毒苷单独给药组、杠柳毒苷和低剂量三七总皂苷配伍组以及杠柳毒苷和高剂量三七总皂苷配伍组,每组6只。按杠柳毒苷10 mg/(kg·d)、三七总皂苷0.74 g/(kg·d)和2.22 g/(kg·d)(分别相当于香加皮与三七的配伍比例为1∶1和1∶3)的剂量灌胃给药,分别给予杠柳毒苷和杠柳毒苷—三七总皂苷配伍溶液,连续给药7 d。在给药7 d后0、0.033、0.083、0.167、0.25、0.5、1、2、4、6、8、10、12、24、36、48 h自大鼠眼眶静脉丛采血0.25 mL,置于肝素化管中,以7 000 r/min,4℃离心,取上清得血浆,置于-70℃冰箱冻存。
2.3.2 血浆样品处理方法 精密吸取血浆样品100μL,定量加入内标补骨脂素(1μg/mL)20μL、甲醇20μL,涡旋1 min后,加入乙酸乙酯2 mL,涡旋5 min,离心 10 min(14 000 r/min)后,定量吸取上清液2 mL置于EP管中,氮气吹干,残渣加入50%甲醇 100 μL,涡旋 3 min,离心 10 min(14 000 r/min),取上清液在“2.2”条件下进行测定。
2.4 方法学考察
2.4.1 专属性 取大鼠空白血浆100μL(不加对照品溶液和内标)、空白血浆100μL加入杠柳次苷对照品及内标溶液、含药血浆,按“2.3.2”项下处理,在2.2条件下测定,杠柳次苷和补骨脂素的保留时间分别是6.66 min和4.31 min,与血浆中内源性成分均能得到良好的分离,其他成分均无干扰,结果见图1。
2.4.2 标准曲线及线性范围 取“2.1”项下制得的不同浓度的对照品储备液,加入到大鼠空白血浆中,按“2.3.2”项下的血浆样品处理方法进行处理,配制成含杠柳次苷浓度分别为 2、4、10、20、50、200、800、1 000 ng/mL 的血浆样品,在“2.2”条件下进行测定。以杠柳次苷的浓度(X)为横坐标,杠柳次苷与补骨脂素的峰面积比值(Yˆ)为纵坐标进行加权最小二乘法回归,获得杠柳次苷的线性回归方程及相关系数(Yˆ=0.179 249X+0.000 798 268 5,r=0.998 9)(权重系数为1/X),线性范围为2~1 000 ng/mL,最低定量限为 0.5 ng/mL(S/N≥10)。
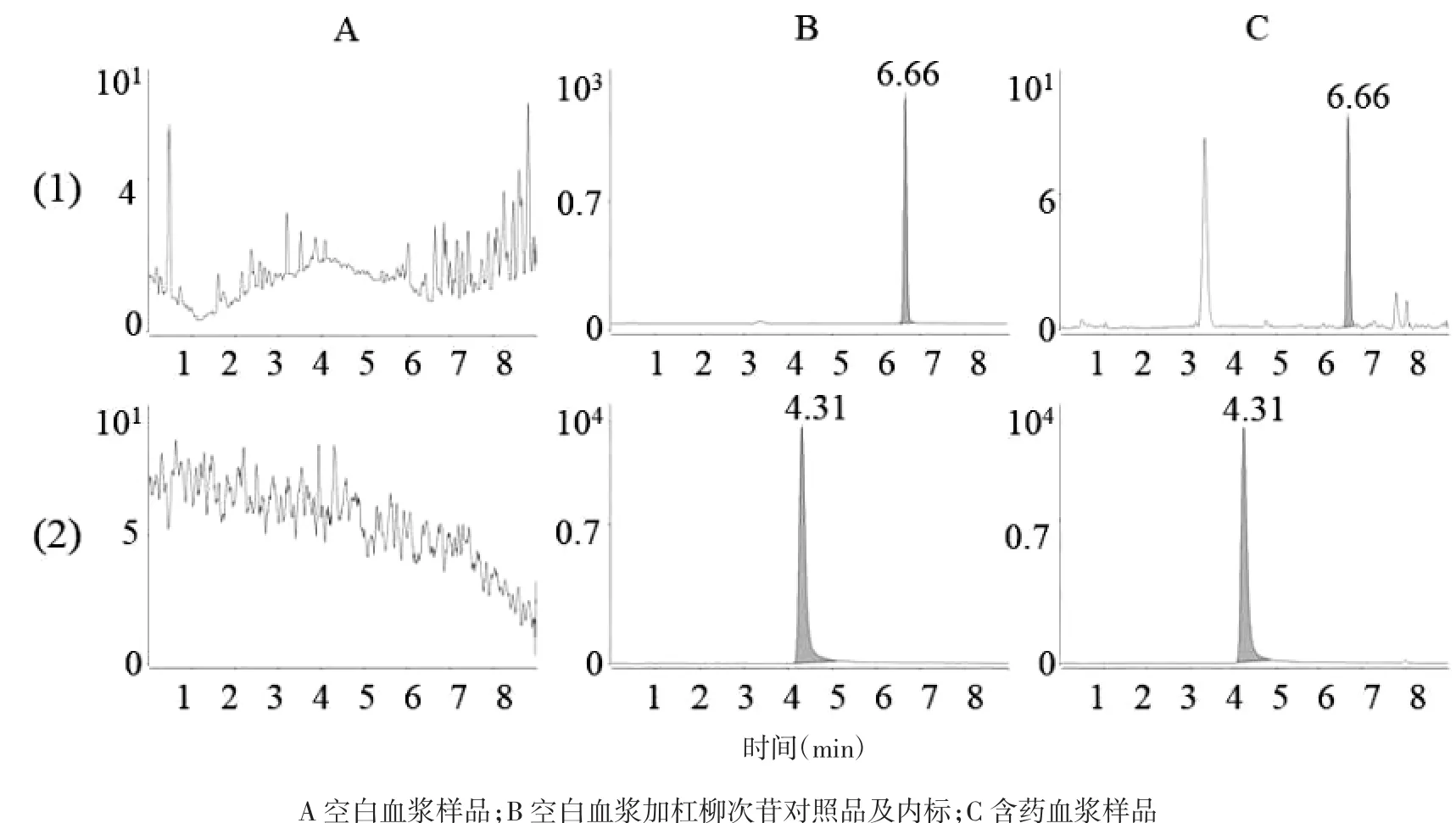
图1 大鼠血浆中杠柳次苷(1)和内标(2)的MRM图Fig.1 Extraction MRM chromatograms of periplocymarin(1)and IS(2)in plasma
2.4.3 精密度与准确度 依据杠柳次苷的线性范围,取“2.1”项下制得的不同浓度的对照品储备液,加入到大鼠空白血浆中,按照“2.3.2”项下方法进行处理,配制成含杠柳次苷终浓度为4、50和800 ng/mL的低、中、高3种浓度的质控样品,3种溶液各6份,在“2.2”条件下连续测定3 d,并与标准曲线同时进行,记录杠柳次苷在不同质控水平下的浓度,求得方法的日内精密度、日间精密度和准确度,结果见表1。

表1 杠柳次苷在大鼠血浆中的精密度及准确度Tab.1 Intra-day and inter-day precisions and accuracies of periplocymarin in rat plasma
2.4.4 回收率及基质效应 按照“2.3.2”项下方法配制杠柳次苷终浓度为4、50和800 ng/mL的质控样品各6份,在“2.2”条件下进行分析测定,得到样品峰面积(A1)后,将甲醇质控样品按照“2.3.2”项下的方法进行处理后,在残渣中加入100μL相应低、中、高3个浓度的杠柳次苷对照品溶液,在“2.2”条件下进行分析测定,得到峰面积(A2),则提取回收率计算公式为R=A1/A2×100%;在“2.2”条件下测定相应3个浓度的杠柳次苷对照品溶液,得到峰面积(A0)后,依据基质效应计算公式M=A2/A0可得杠柳次苷对照品溶液的基质效应;内标补骨脂素的提取回收率及基质效应计算方法同上。结果表明各成分的回收率及基质效应符合生物样品分析要求,见表2。
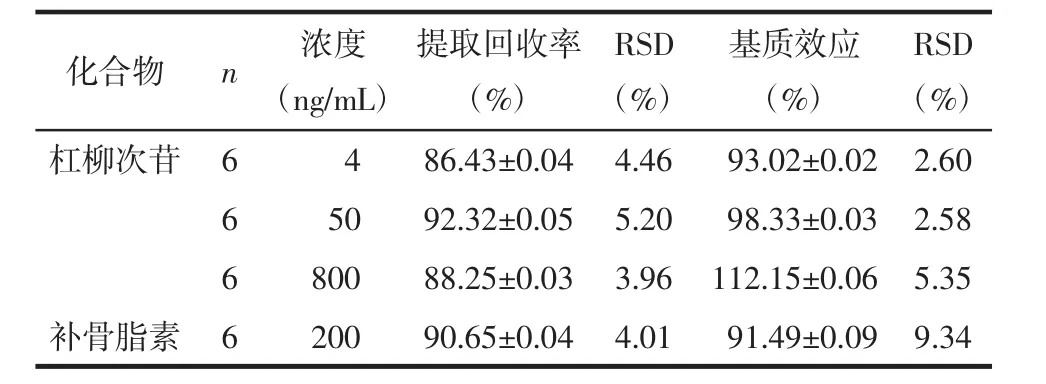
表2 杠柳次苷和内标补骨脂素在大鼠血浆中的提取回收率和基质效应Tab.2 Recoveries and matrix effects of periplocymarin and IS in rat plasma
2.4.5 稳定性考察 取100μL空白血浆,按“2.3.2”项下方法配制杠柳次苷终浓度为4、50和800 ng/mL 3种浓度的质控样品,考察其在室温下放置6 h再处理、-20℃反复冻融3次、血浆样品处理后放置自动进样器12 h和-70℃冰箱中冷冻14 d的稳定性,血浆处理后按“2.2”项下条件进行分析,得到杠柳次苷RSD范围为1.14%~11.12%。表明其稳定性符合生物样品分析要求,见表3。
2.5 药动学结果 对A、B、C 3组血浆样品中杠柳次苷的血药浓度进行LC-MS/MS分析测定,得到杠柳次苷的平均血药浓度-时间曲线,见图2。将测得的各时间点的杠柳次苷血药浓度以DAS 1.0软件进行处理,杠柳次苷在大鼠体内的各项药动学参数见表4。所得实验数据经SPSS 23.0统计软件进行单因素方差分析,得到A、B、C 3组间的药动学参数差异。
3 结果与讨论
对比分析3个给药组中杠柳毒苷代谢产物杠柳次苷的药动学参数可以看出:杠柳毒苷和三七总皂苷配伍后,配伍组中杠柳次苷的药代动力学行为发生了明显变化,具体表现为:配伍后杠柳次苷的Cmax较配伍前显著降低(P<0.05),而 Tmax则显著升高(P<0.05);经高剂量三七总皂苷配伍后杠柳次苷的AUC0-t和 AUC0-∞较配伍前显著降低(P<0.01)。

表3 杠柳次苷在不同条件下的稳定性Tab.3 Stability of periplocymarin in rat plasma
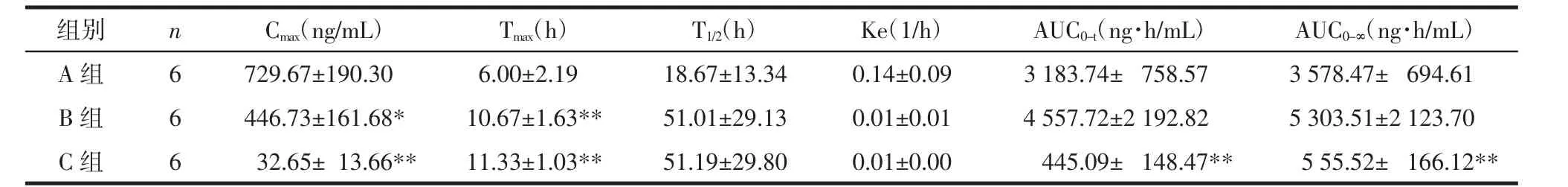
表4 不同组大鼠灌胃给药后杠柳次苷的主要药动学参数Tab.4 Pharmacokinetic parameters of periplocymarin in different groups
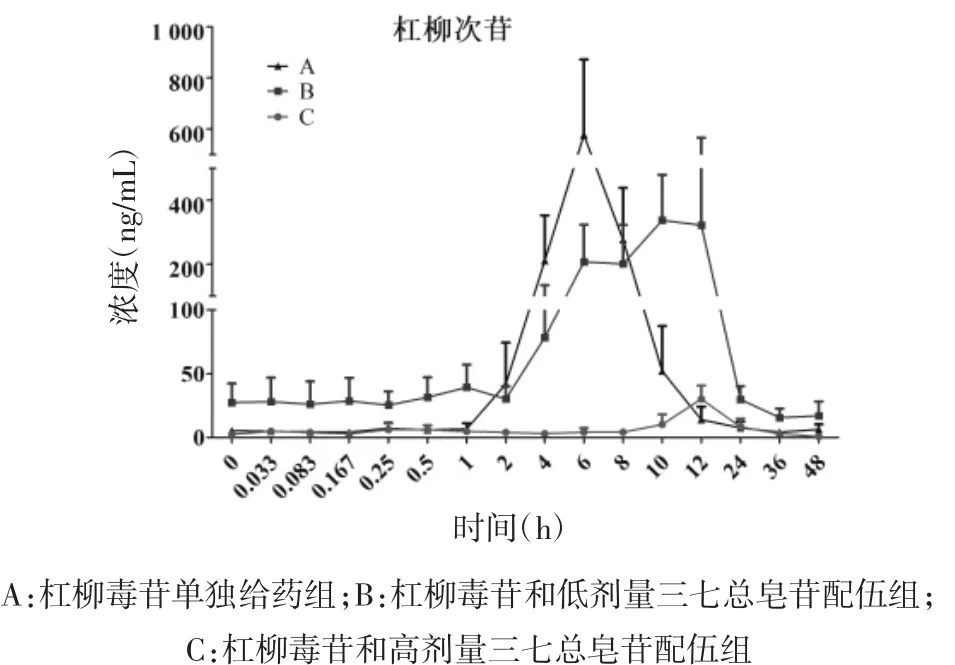
图2 大鼠灌胃给药后血浆中杠柳次苷的药-时曲线(x±s,n=6)Fig.2 Mean plasma concentration-time curve of periplocymarin in rats after oral administration(x±s,n=6)
本课题组前期研究表明,随着三七总皂苷配伍比例的增大,杠柳毒苷的药动学参数Cmax、AUC0-t和AUC0-∞值呈现递减趋势[10]。据此分析,三七总皂苷可能通过影响杠柳毒苷在大鼠体内的代谢,从而使其代谢产物杠柳次苷的药代动力学行为发生改变。
