鸡BCO2基因功能性单核苷酸多态性的生物 信息分析
2019-07-08郝文文杨倩倩张贝张健张传生耿立英李祥龙
郝文文 杨倩倩 张贝 张健 张传生 耿立英 李祥龙

摘 要:旨在筛选鸡BCO2基因中具有潜在生物学功能的同义单核苷酸多态性(non-synonymous single nucleotide polymorphisms,nsSNPs)。从SNP数据库中检索出8个BCO2 基因nsSNPs,利用SIFT、PolyPhen-2、PANTHER和PROVEAN方法分析引起的氨基酸替換是否可能影响BCO2 的功能预测。进一步对鸡BCO2基因编码的氨基酸序列进行翻译后修饰位点预测以及进化位点保守性预测;使用SWISS-MODEL构建了BCO2野生型以及突变型蛋白质的空间结构。结果表明:3个nsSNPs(rs739117331、rs735703078和rs736211538)可能严重影响BCO2蛋白功能。
关键词:鸡;BCO2基因;非同义SNP;SNP功能预测;蛋白质高级结构构建中图分类号:S831 文献标识码:B 文章编号:1673-1085(2019)04-0017-05
非同义单核苷酸多态性(nsSNPs)是指处于编码区可引起氨基酸序列变化的单核苷酸突变,因其可能会对蛋白质功能造成影响,多被认为是导致畜禽表型变异的重要原因[1,2]。利用生物信息学方法对未知表型的nsSNP进行功能性预测,是一种筛选候选功能位点的理想策略,目前已有诸多成功的研究报道[3-6]。BCO2基因(Beta-carotene 9′,10′-monooxygenase,BCO2)编码的β-胡萝卜素加氧酶2在动物体内类胡萝卜素的代谢过程中起着至关重要的作用[7]。鸡皮肤表现出黄色主要是由于表皮层类胡萝卜素沉积的结果,类胡萝卜素被降解,鸡皮肤呈现白色。研究发现,鸡BCO2基因的一个G/A突变位点(chr24:6268434bp)与黄皮肤性状存在着连锁关系,且该基因在黄色皮肤组织中的表达量显著低于白色皮肤组织[8]。还发现,在绵羊、家兔等动物的黄脂肪性状也与BCO2基因编码区的突变有关[9-11],这提示BCO2基因突变可以造成它介导类胡萝卜素降解的功能发生改变。本研究对利用生物信息技术对鸡BCO2基因编码区nsSNPs进行分析,筛选其中候选功能性错义突变位点,为后续的表型关联分析和鸡皮肤颜色的分子遗传育种提供理论依据。
1 材料与方法
1.1 BCO2基因nsSNPs的搜集 以BCO2基因的序列号(ENSGALG00000007868)从Ensembl genome browser(http://asia.ensembl.org)中进行检索,确定各SNPs在基因中的位置(外显子区、内含子区、启动子区域等),筛选出位于编码区的nsSNPs。
1.2 NsSNPs对BCO2基因功能的影响 应用4种预测方法SIFT(http://blocks.fhcrc.org/sift/SIFT.html)[12]、PolyPhen-2(http://genetics.bwh.harvard.edu/pph2)[13]、PANTHER(http://pantherdb.org/tools/csnpScoreForm.jsp)[14]和PROVEN(http://provean.jcvi.org/seq_submit.php)[15]软件分析各nsSNP对进行BCO2蛋白功能的影响。
1.3 进化保守位点分析 利用在线服务器ConSurf(http://consurftest.tau.ac.il)[16]分析BCO2蛋白氨基酸位点的进化保守水平。越保守位点发生变异越可能造成功能或结构上的影响。
1.4 翻译后修饰位点预测 分别利用BDM-PUB(http://bdmpub.biocuckoo.org/)和NetPhos 2.0(http://gps.biocuckoo.org/)[17]在线软件预测BCO2蛋白质氨基酸泛素化修饰位点和预测磷酸化修饰位点。
1.5 蛋白质稳定性分析 利用I-Mutant 2.0(http://gpcr.biocomp.unibo.it/cgi/predictors/I-Mutant2.0/I-Mutant2.0.cgi)[18]在线软件评估nsSNP引起的蛋白质稳定性的改变。在评估结果中,DDG为自由能变化值,DDG<0表示此nsSNP降低了蛋白质的稳定性,DDG>0表示此nsSNP增加了蛋白质的稳定性,-0.05≤DDG≤0.05表示蛋白质的稳定性变化为中性。RI(Reliability Index)为可靠性指数,范围在0~10。
2 结果与分析
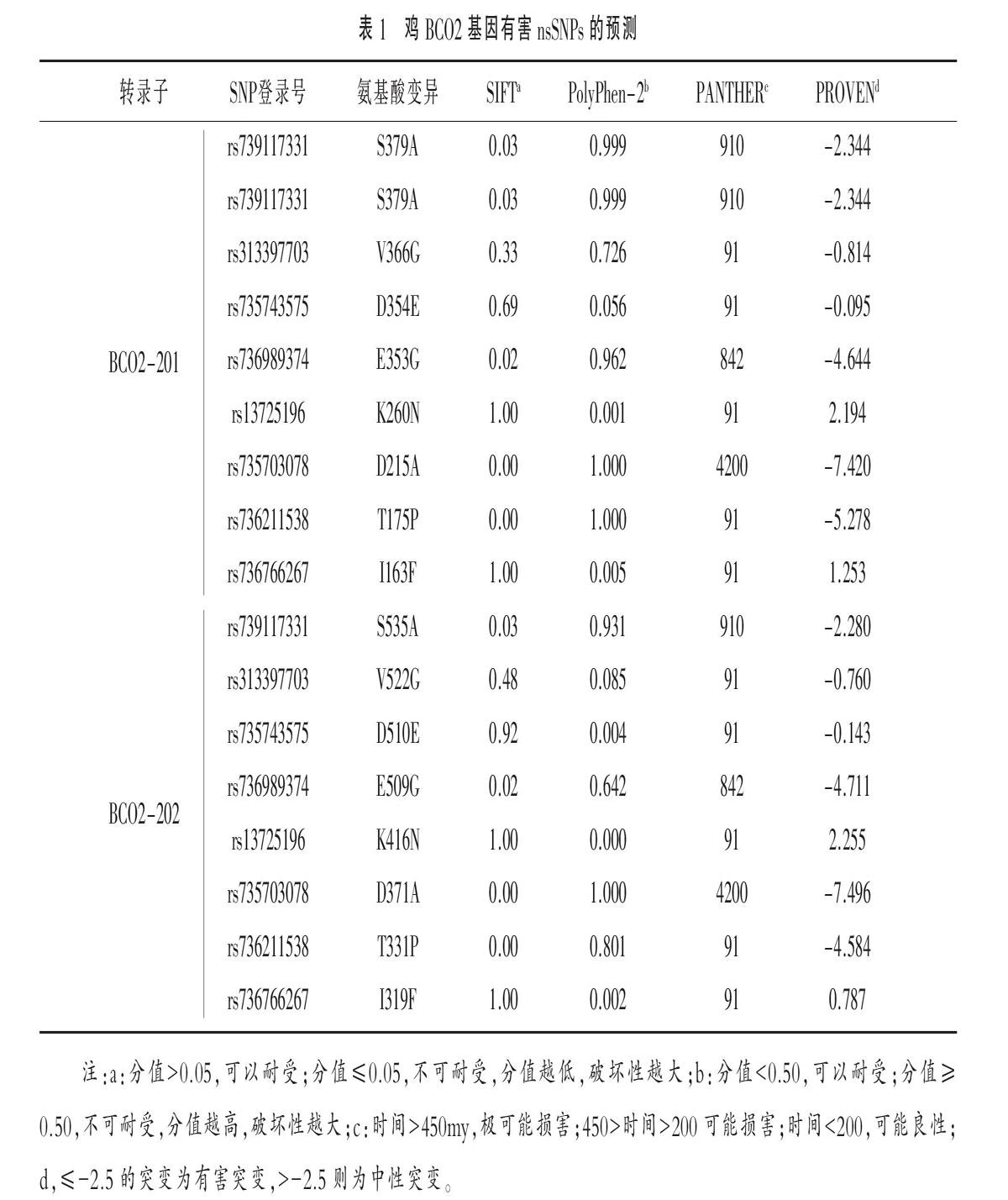
2.1 鸡BCO2基因nsSNPs的筛选结果 从SNP数据库中共检索到BCO2基因两个转录子:
BCO2-201(ENSGALT00000043097);
BCO2-202(ENSGALT00000012775)。
8个nsSNPs,具体结果见表1。
2.2 鸡BCO2基因有害nsSNPs预测结果 采用SIFT、PolyPhen-2、PANTHER和PROVEN四种方法在BCO2-201分别预测到4个、5个、3个和3个有害突变,在BCO2-202分别预测到4个、4个、3个和3个有害突变。其中rs736211538、rs735703078在两个转录子、BCO2-201的rs739117331和BCO2-201的rs736989374均至少三种方法预测为有害位点。
2.3 进化保守位点分析 利用在线服务器ConSurf预测BCO2基因的进化保守位点,分数在7~9之间的位点为进化保守性位点。如表2所示,在BCO2编码的多肽链氨基酸序列中,与多态位点一致的保守性位点共有3个,分别为rs739117331、rs735703078和rs736211538,这3个位点的多态性更容易对蛋白质结构或功能造成影响。
2.4 翻译后修饰位点预测 本研究利用BDM-PUB在线软件预测泛素化修饰位点,利用NetPhos 2.0预测磷酸化修饰位点(表3)。结果,与BCO2蛋白多态位点一致的泛素化修饰位点为K416,磷酸化修饰位点为S535。
2.5 蛋白质稳定性分析 利用I-Mutant2.0评估nsSNP引起的蛋白质稳定性的影响(见表4),可见BCO2-202中除D510E和K416N使蛋白质稳定性升高,其他位点多态性均使得蛋白质稳定性下降;BCO2-201中除D354A和K260N使蛋白质稳定性升高,其他位点多态性均使得蛋白质稳定性下降。
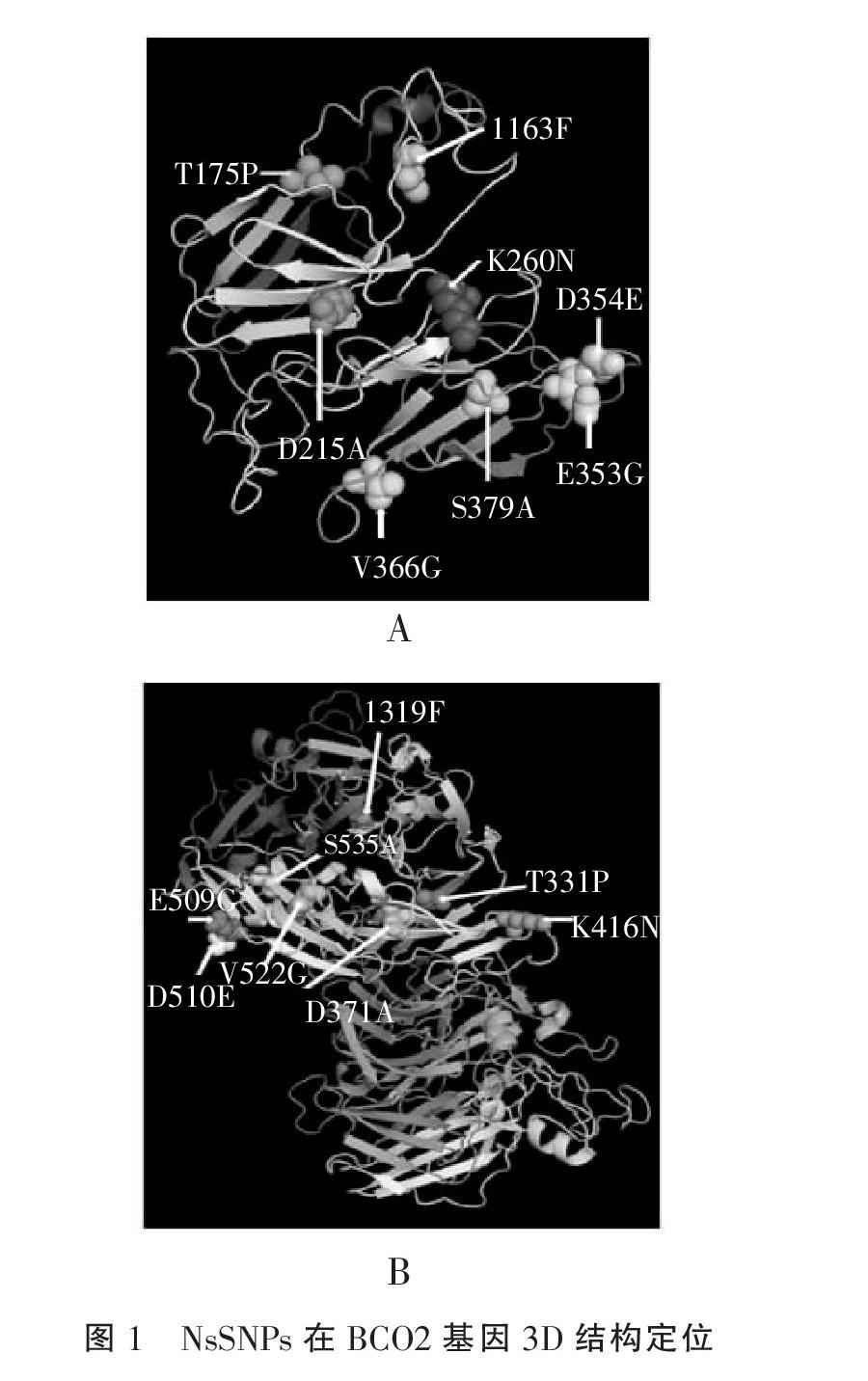
2.6 蛋白质高级结构建模 利用在线建模服务器SWISS-MODEL为鸡BCO2-201和BCO2-202两个转录子蛋白质突变体建模,并利用软件PyMOL将功能性错义突变分别定位到BCO2-201(图1A)和BCO2-202(图1B)蛋白质高级结构。
3 讨论与结论
本研究通过蛋白质的结构和功能特性这个角度验证鸡的BCO2基因编码区中的nsSNPs是否有害。首先,从Ensembl检索到BCO2基因编码区8个nsSNPs,并用四款软件对其进行功能预测,初步筛选出候选的有害nsSNPs;同时,本研究又从蛋白质翻译后修饰以及氨基酸位点进化保守水平的角度对候选nsSNPs潜在生物學功能进行评估。在发现的8个nsSNPs中,其中D371A被4个方法均预测为有害突变;进化保守性预测结果也显示D371属于高度保守,这意味着该位点对BCO2功能正常发挥十分重要。因此D371A在BCO2所有的nsSNPs中危害最大,相应的多态位点为功能性位点。另外,位点S535A为磷酸化修饰位点,它可破坏影响蛋白质之间的信号传导致使蛋白质功能不能正常发挥,加之有3个方法均预测S535A为有害突变,同时S535还是保守性位点,所以S535A为第2个功能位点。第3个候选功能位点为T331P,该位点也被3个nsSNPs功能预测软件预测为有害突变,且该位点也是进化保守性位点,因此不可忽视该突变对BCO2蛋白质功能的影响;最后,虽然K416为泛素化修饰位点,该位点突变可能通过影响蛋白质合成后的泛素化过程,破致使蛋白质功能不能正常发挥,但4种软件对K416N的预测结果均为中性,因此该突变有待进一步研究。
参考文献:
[1] Cao,R.,et al.,dbSAP:single amino-acid polymorphism database for protein variation detection[J].Nucleic Acids Res, 2017,45(D1): D827-D832.
[2] Katsonis, P., et al., Single nucleotide variations: biological impact and theoretical interpretation[J].Protein Sci, 2014,23(12): 1650-66.
[3] Kelly, J.N. and S.D. Barr, In silico analysis of functional single nucleotide polymorphisms in the human TRIM22 gene[J].PLoS One,2014,9(7): e101436.
[4] Rebai, M. and A. Rebai, In silico characterization of functional SNP within the oestrogen receptor gene[J].J Genet, 2016,95(4): 865-874.
[5] Saleh, M.A., et al., Impacts of Nonsynonymous Single Nucleotide Polymorphisms of Adiponectin Receptor 1 Gene on Corresponding Protein Stability: A Computational Approach[J].Biomed Res Int,2016,2016: 9142190.
[6] Singh, R.K. and K. Mahalingam, In silico approach to identify non-synonymous SNPs in human obesity related gene,MC3R (melanocortin-3-receptor)[J].Comput Biol Chem,2017,67:122-130.
[7] Wu, L., et al., Molecular aspects of beta, beta-carotene-9',10'-oxygenase 2 in carotenoid metabolism and diseases[J].Exp Biol Med (Maywood), 2016,241(17):1879-1887.
[8] Eriksson, J., et al., Identification of the yellow skin gene reveals a hybrid origin of the domestic chicken[J].PLoS Genet,2008,4(2):e1000010.
[9] Strychalski,J.,et al.,A novel AAT-deletion mutation in the coding sequence of the BCO2 gene in yellow-fat rabbits[J].J Appl Genet,2015,56(4): 535-537.
[10] Niu, Y., et al., Biallelic beta-carotene oxygenase 2 knockout results in yellow fat in sheep via CRISPR/Cas9[J].Anim Genet,2017,48(2):242-244.
[11] Vage, D.I. and I.A. Boman, A nonsense mutation in the beta-carotene oxygenase 2(BCO2)gene is tightly associated with accumulation of carotenoids in adipose tissue in sheep (Ovis aries)[J].BMC Genet, 2010,11:10.
[12] Kumar, P., S. Henikoff, and P.C. Ng, Predicting the effects of coding non-synonymous variants on protein function using the SIFT algorithm[J].Nat Protoc, 2009,4(7):1073-81.
[13] Adzhubei, I.A., et al., A method and server for predicting damaging missense mutations[J].Nat Methods,2010,7(4):248-249.
[14] Tang, H. and P.D. Thomas, PANTHER-PSEP: predicting disease-causing genetic variants using position-specific evolutionary preservation[J].Bioinformatics,2016,32(14):2230-2232.
[15] Choi, Y. and A.P. Chan, PROVEAN web server: a tool to predict the functional effect of amino acid substitutions and indels[J].Bioinformatics, 2015,31(16): 2745-2747.
[16] Ashkenazy, H., et al., ConSurf 2016: an improved methodology to estimate and visualize evolutionary conservation in macromolecules[J].Nucleic Acids Res, 2016,44(W1): W344-350.
[17] Xue, Y., et al., GPS 2.1:enhanced prediction of kinase-specific phosphorylation sites with an algorithm of motif length selection[J].Protein Eng Des Sel,2011,24(3):255-260.
[18] Capriotti, E., P.Fariselli, and R. Casadio, I-Mutant2.0:predicting stability changes upon mutation from the protein sequence or structure[J].Nucleic Acids Res,2005,33(Web Server issue): 306-310.收稿日期:2019-03-22
基金項目:河北省教育厅重点项目(项目编号:ZD2018225),河北科技师范学院博士启动基金(项目编号:2018YB002),河北省现代农业产业技术体系蛋鸡产业创新团队岗位项目(项目编号:HBCT2013090206)。
作者简介:郝文文(1996-),女,研究生在读,研究方向为家禽遗传育种,E-mail:794911295@qq.com。
通讯作者:张传生(1976-),男,宁阳县人,教授,主要从事动物遗传育种的研究。E-mail:cszhang1976@126.com。
