腹腔镜袖状胃切除术治疗肥胖合并非酒精性脂肪性肝病的疗效分析
2019-07-08李震代喆陈凯袁玉峰刘志苏潘定宇
李震,代喆,陈凯,袁玉峰,刘志苏,潘定宇
(武汉大学中南医院,1.肝胆胰外科,2.内分泌科,3.手术麻醉科,湖北 武汉 430071)
近20年来非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)发病率逐步攀升,美国有1/3的人群患NAFLD,该病在欧洲和中东地区发病率为20%~30%,在中国发病率为15%~30%[1]。NAFLD是肥胖症常见的并发症之一,其实质为胰岛素抵抗在肝脏的表现形式,伴随应激和慢性炎症引起的肝纤维化可使它进展为肝硬化甚至是肝癌,严重威胁着人类的健康和生命[2-3]。除此之外,NAFLD的临床结局还与代谢异常所致的动脉粥样硬化性心血管事件等密切相关[4-6]。随着减重代谢外科飞速发展,外科手术以其安全性、有效性和持久性,逐渐成为治疗病态肥胖及其相关合并症的最佳方案[7-9],也为肥胖型NAFLD的治疗提供了新思路。本研究拟通过回顾性分析本中心的腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)治疗肥胖合并NAFLD病人的临床资料,并应用无创性肝脏瞬时弹性超声(FibroTouch)评估手术疗效,探讨其治疗效果以及可能的机制。
资料与方法
一、病例资料
2017年8月至2018年12月武汉大学中南医院肝胆胰外科收住并行减重手术的病态肥胖病人60例,收集病人的性别、年龄、身高、体重、血压、家族史、既往史等。手术方式为LSG,共计60例,手术指征为体质量指数(body mass index,BMI)≥32.5 kg/m2或BMI≥27.5 kg/m2同时合并有肥胖相关代谢并发症(高血压、糖尿病、血脂异常),合并有糖尿病的手术病人为胰岛素抵抗型肥胖并且术前胰岛储备功能结果良好。根据国际糖尿病协会2009年代谢综合征的诊治指南对本研究收集的病例做如下诊断:高血压诊断标准为>130/85 mmHg;高血糖的诊断标准为已诊断的2型糖尿病或开始糖尿病药物治疗或者空腹血糖>7.0 mmol/L或餐后2 h血糖>11.1 mmol/L;高三酰甘油血症诊断标准为血清三酰甘油>1.5 g/L;低-高密度脂蛋白血症诊断标准为血清高密度脂蛋白<0.4 g/L(女性)或<0.5 g/L(男性)。
所有病人都有腹型肥胖,腹型肥胖的诊断标准为腰围>102 cm(男性)或腰围>88 cm(女性)。既往史收集排除过量饮酒史(男性饮酒折合乙醇量> 30 g/d,女性> 20 g/d)和其他可导致脂肪肝的特定原因,包括:未应用乙胺碘呋酮、甲氨蝶呤、他莫昔芬、糖皮质激素等药物,并排除基因3型丙型肝炎病毒感染、肝豆状核变性、自身免疫性肝炎、全胃肠外营养、乏β脂蛋白血症、先天性脂质萎缩症、乳糜泻等可以导致脂肪肝的特定疾病。
二、肝脏瞬时弹性超声测定与评分
所有病人均行无创性肝脏瞬时弹性超声以测定肝脏的硬度值(liver stiffness mesure,LSM)和脂肪受控衰减参数(fat controlled attenuation parameter,CAP)。机器型号为:FibroTouch-B,测定3个点,每个点自动测10次取平均值,最终结果取中间值。根据LSM测定值可以判断肝脏纤维化的程度:LSM<7.3 kPa(F0~F1)、7.3~9.7 kPa(F2)、9.8~12.4 kPa(F2~F3)、12.5~17.5 kPa(F3~F4)、>17.5 kPa(F4)(F0为无纤维化、F1为轻度纤维化、F2为显著纤维化、F3为进展期纤维化、F4为肝硬化);根据CAP测定值可以判断肝脏脂肪堆积程度:<240 dB/m(正常)、240~265 dB/m(轻度脂肪肝)、266~295 dB/m(中度脂肪肝)、>295 dB/m(重度脂肪肝)。所有病人均知情同意并签署了该临床研究的知情同意书。
三、生化检测与方法
手术当天清晨6:00抽取病人空腹静脉血,己糖激酶法测定血清葡萄糖浓度(机器型号:贝克曼的AU5831)。化学发光法测定血清胰岛素水平,并利用胰岛素稳态模型计算胰岛素抵抗指标(HOMA-IR)值,计算公式为空腹血糖水平(mmol/L)×空腹胰岛素水平(mU/L)/22.5。酶法测定血常规、肝功能、血脂全套等。无创性肝纤维化指标(APRI)计算公式为:[天冬氨酸转氨酶(aspartat aminotransferase,AST)/正常上限值]/血小板计数(×109/L)×100。
四、手术方式
按照《中国肥胖和2型糖尿病外科治疗指南》2014版的术式要点,手术方法简介如下:病人取“大”字形仰卧、头高脚低位,脐右上方距离剑突大约20 cm处为观测孔,双侧腹直肌外缘取观测孔水平上方约3 cm为主操作孔,左腋前线肋下2 cm为辅助操作孔,剑突偏右为辅助操作孔以肝挡牵拉肝脏暴露胃。沿胃大弯侧自幽门至贲门逐步游离胃结肠韧带及胃脾韧带,至食管左侧,置入36F胃管,自幽门上方约4 cm以切割缝合器靠近胃管切除胃大弯及胃底直至食管左侧。切割线以倒刺线行全层加强缝合。
五、统计方法
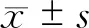
结 果
一、一般情况
所有手术均在腹腔镜下完成,无中转开腹或死亡病例。2例病人术前诊断胆囊结石且有胆囊炎发作史,取得病人知情同意后,同时行腹腔镜胆囊切除术。手术时间(81.2±7.9) min(61~180 min),术中出血(21.7±2.3) ml(10~60 ml),术后住院时间为(6.2±0.7) d(5~30 d)。术后1例出现胃腔狭窄,1个月后行胃镜下球囊扩张术后狭窄问题解决;3例出现腹壁切口脂肪液化,定期换药后痊愈;1例因术后血压波动导致出血,再次手术止血;无穿孔、吻合口漏、胃食管反流等并发症。
具有完整随访资料的60例病人中,男性29例(48.3%),女性31例,年龄(31.9±9.3)岁(18~65岁),BMI(37.7±5.4) kg/m2(30.8~55.1 kg/m2)。其中16例(26.7%)病人合并有糖尿病,60例(100%)合并脂肪肝,23例(38.3%)合并脂代谢异常,18例(30%)合并高尿酸血症,20例(33.3%)合并高血压,5例(8.3%)合并糖耐量异常,4例(6.7%)合并胃食管反流病,3例(9.6%,3/31,此处发病率只针对女性病人)合并多囊卵巢综合征,2例(3.3%)合并胆囊结石,2例(3.3%)合并Ⅱ型呼吸衰竭,1例(1.7%)合并IgA肾病。
二、术前体重、胰岛素抵抗与肝脂肪变和肝硬度的关系
术前的BMI与LSM和CAP呈显著正相关,且相关系数较高;APRI与肝脏硬度指标和肝脏脂肪含量呈显著正相关,证明APRI这一模型与影像学诊断趋势是一致的,且肝脂肪变伴随着纤维化;HOMA-IR与肝脏脂肪含量呈显著正相关,说明胰岛素抵抗与肝脏脂肪沉积相关;但是HOMA-IR与肝脏硬度没有相关性,说明胰岛素抵抗不直接引起肝纤维化。见图1。
三、术后肥胖和糖脂改善情况
术后平均随访4个月(3.13~5.97个月):多余体重减少百分比(percentage of excess weight loss,%EWL)为(73.2±12.6)%;BMI由术前的(37.7±5.4) kg/m2下降到术后的(28.9±4.1) kg/m2(P<0.001);术后的糖代谢指标空腹血糖、糖化血红蛋白(glycosylated hemoglobin,HbA1c)以及脂代谢指标总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)均分别较术前明显改善(P<0.05或P<0.001);而低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)术后变化不明显,与术前相比差异无统计学意义。见表1。

表1 60例病人术前与术后糖脂代谢情况比较
四、术后肝功能、BMI、胰岛素抵抗、脂肪肝与肝纤维化的改善情况
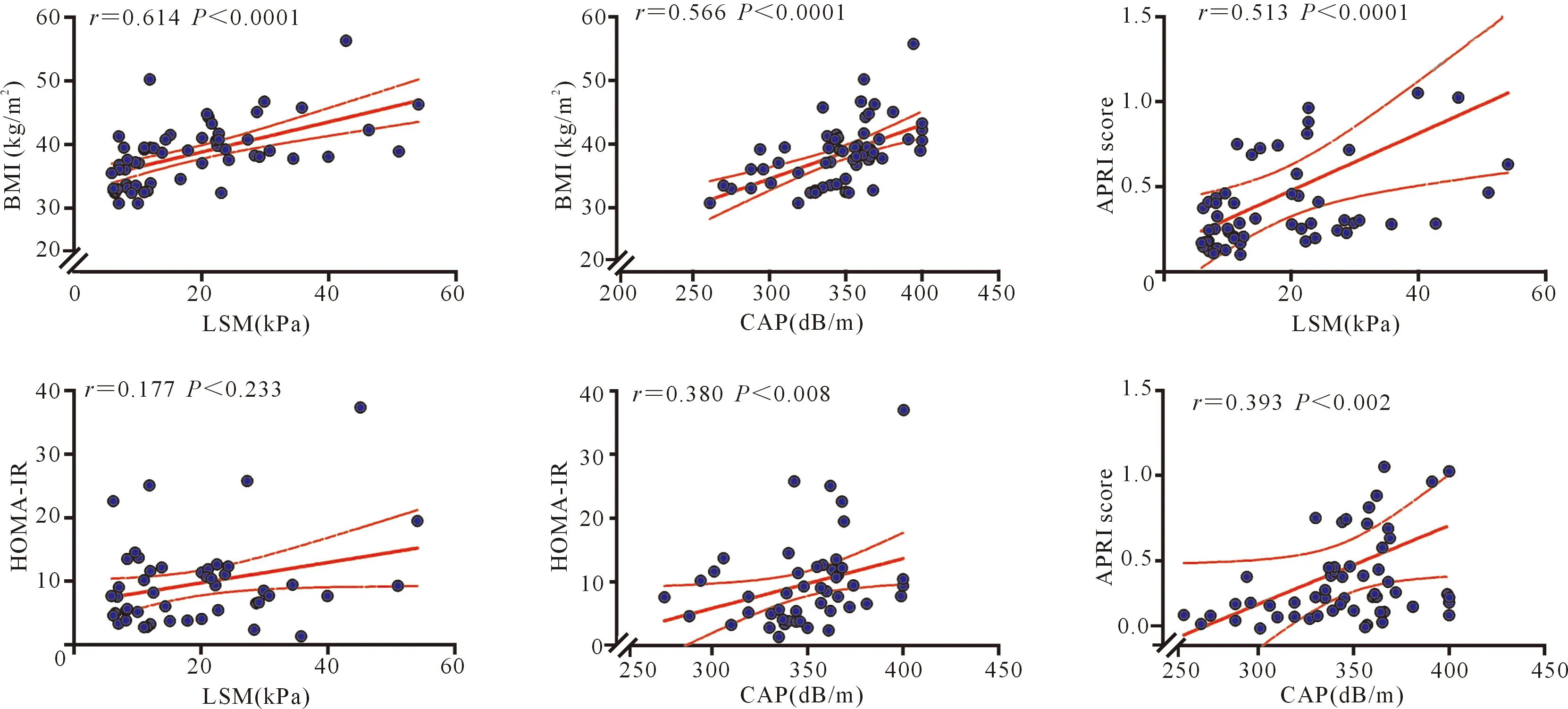
图1 术前BMI、APRI、HOMA-IR分别与肝脂肪变和肝硬度相关性分析
术后平均随访4个月(3.13~5.97个月),结果如下:术前AST为(40.45±30.9) U/L,术后降至(19.14±4.5) U/L,差异有统计学意义(P=0.003);丙氨酸转氨酶(alanine aminotransferase,ALT)由术前的(58.59±42.6) U/L降至术后的(18.45±9.7) U/L(P<0.001);BMI由术前的(37.7±5.4) kg/m2降到术后的(28.9±4.1) kg/m2(P<0.001);胰岛素抵抗模型HOMA-IR由术前的7.6±5.7降至术后的2.2±1.4(P<0.001);肝脏硬度测定LSM由术前的(16.3±11.7) kPa下降至术后的(9.9±6.0) kPa(P<0.001);肝脏脂肪含量CAP值由术前的(342.1±38.8) dB/m降至术后的(280.9±40.3) dB/m(P<0.001);无创性肝纤维化指标APRI由术前的0.58±0.89 下降到术后的0.24±0.14(P=0.002 2)。见图2。
根据LSM术前51.6%的病人进展期纤维化(F3以上),术后降为21.4%。术前所有病人均有脂肪肝,其中只有1例病人轻度脂肪肝(CAP= 261 dB/m,占1.7%),5例病人中度脂肪肝(占8.3%),其余病人全部为重度脂肪肝(占90.0%)。术后25.0%病人肝脏脂肪含量恢复正常,14.3%轻度脂肪肝,25.0%中度脂肪肝,35.7%重度脂肪肝。
讨 论
非酒精性脂肪性肝病防治指南(2018年更新版)对NAFLD的诊断提出:病理学上显著肝脂肪变和影像学诊断脂肪肝是其重要特征,肝脂肪变及其程度与肝脏炎症损伤和纤维化密切相关,并可以预测代谢综合征和2型糖尿病的发病风险。病理学诊断固然是“金标准”,但受限于有创性和高成本,临床难以普及,尤其对于术后随访难以实施。常规的CT等影像学检查可以提供弥漫性脂肪肝、局灶性脂肪肝、不均质性脂肪肝的影像学信息,但是难以量化。B型超声对轻度脂肪肝敏感性低。受控衰减参数(CAP,dB/m)是一项基于超声的肝脏瞬时弹性成像平台(VCTE,FibroScan)定量诊断脂肪肝的新技术,CAP可以诊断出5%以上的肝脂肪变,准确区分轻-中-重度脂肪肝(S1-S2-S3),同时还可以检测肝脏弹性值(LSM,kPa)[10]。权威肝病杂志Hepatology发文指出虽然BMI、糖尿病等因素可能会影响CAP检测结果,但是CAP对于NAFLD诊断可媲美组织病检[11]。Garg等[12]研究表明LSM和CAP对进展期肝纤维化和重度肥胖病人测量是可靠的。Zeng等[13]研究表明国产超声的肝脏瞬时弹性成像平台FibroTouch的检验效能还要优于FibroScan。图3展示的检测方法,右侧曲线图展示的是CAP值对于脂肪肝诊断的敏感性问题,该文献建议的阈值点与我院该系统的阈值基本一致[11]。另有文献表明,无创性肝纤维化模型APRI、FIB-4和NAFLD纤维化评分(NFS)均适合用于诊断NAFLD及其引起的肝纤维化[14]。本研究主要采用FibroTouch和APRI对NAFLD指标进行评估,是具有合理性和准确性的。

图2 对比术前术后的肝功能、BMI、胰岛素抵抗模型、肝脂肪变与肝硬度的变化
LSG治疗NAFLD在国外文献中已有报道。一项前瞻性研究结果显示,LSG术后1年病人肝功能指标得到明显改善,并且术前和术后的肝活检病理证实肝脏脂肪变和纤维化的病理学分级均降低[15]。该文献指出肥胖是与NAFLD密切相关的,胰岛素抵抗与NAFLD之间关系不显著,而本研究结果中HOMA-IR与CAP呈显著正相关,说明胰岛素抵抗与肝脏脂肪沉积相关;但是HOMA-IR与LSM没有相关性,说明胰岛素抵抗不直接引起肝纤维化。此外,术前的BMI与LSM和CAP呈显著正相关,且相关系数较高,说明肥胖是导致NAFLD以及非酒精性脂肪性肝炎的直接因素,与该文献一致; APRI与LSM和CAP呈显著正相关,证明APRI这一模型与FibroTouch影像学诊断趋势是一致的,且肝脂肪变伴随着纤维化。
NAFLD的发生发展机制至今尚未明确,综合最新文献研究有以下几点:①首次打击-胰岛素抵抗,肥胖病人尤其是后天出现的肥胖人群,细胞膜上胰岛素受体(数量基本稳定)随着脂肪细胞体积增大而密度相对降低,出现受体水平的胰岛素抵抗,从而使瘦素及肿瘤坏死因子α表达增加,并进一步介导代谢和免疫功能紊乱。②再次打击,即各种原因引起的氧化应激或脂质过氧化损伤所致的脂肪性肝炎,包括肠道微生物群(microbiota)改变导致的肝脏炎症。③胰岛素抵抗和脂肪性肝炎持续状态引发进展性肝纤维化[16]。NAFLD的治疗方式主要有减轻体重、胰岛素增敏剂、他汀类药物、胰高血糖素样肽GLP-1(利那鲁肽)、针对肠道菌群治疗等[17]。而上述单一的治疗方式往往难以取得较好的疗效,最新的研究表明LSG可以成为NAFLD治疗的新策略。但LSG手术治疗NAFLD的机制未明,文献回顾其可能机制有:①LSG缩小胃容量、增加进食后饱腹感、胃排空加快、显著降低Ghrelin分泌量、同时增加胆囊收缩素(CCK)和酪酪肽(PYY)的分泌,这些改变可以减少病人术后摄食量和调节能量负平衡,从而达到减重效果;②LSG发挥其减重效应的同时可以缓解胰岛素抵抗,降低血清胰岛素水平和促进胰岛功能恢复,调节糖脂代谢;③LSG可以增加胰高血糖素样肽-1(GLP-1)的分泌,不仅可以缓解2型糖尿病而且对NAFLD有直接治疗效果;④LSG可改善肠道菌群构成和肠道通透性,从而改善NAFLD[18-20]。本研究结果也证实了LSG术后短期内病人体重大幅下降,同时伴随着糖脂代谢的改善、胰岛素抵抗改善、脂肪肝与肝纤维化的改善。
本研究尚存在一定的局限性和不足:①本回顾性研究纳入病例数较少,随访时间较短;②缺乏术后的病理学证据支持;③未排除术后的饮食构成对NAFLD转归的影响;④肥胖症会影响FibroScan检测成功率,虽然本研究采纳的病历均成功测量10次,但是重度的肝脂肪变(CAP值显著增高)、显著的肝脏炎症(转氨酶>5倍正常上限)、肝脏淤血和胆汁淤积等都会高估LSM值判断肝纤维化之程度[21]。
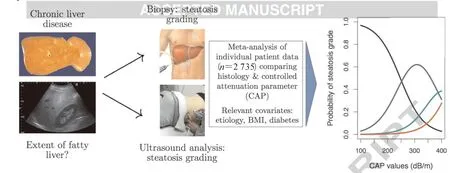
图3 无创性肝脏弹性瞬时成像(VCTE)的检测与CAP诊断阈值判定
综上所述,控制代谢紊乱、控制体重是治疗NAFLD首要目标,重度肥胖病人单纯依靠运动、节食或药物往往无法达到。LSG作为主流的减重术式,可以使病人体重得到长期有效的控制,同时兼得改善血脂、糖代谢、胰岛素抵抗及肠道菌群等效应,从而发挥治疗NAFLD的作用。但具体的治疗机制及长期疗效仍需大样本、长期的临床随访以及基础研究证实。最后,肝脏瞬时弹性超声在临床中评估肥胖相关的NAFLD方便、快捷、准确,具有很大的临床应用价值。
