固定化酵母菌实验条件的探究和改进*
2019-07-08殷亚妮许东升吉祖筠曹安康
殷亚妮 许东升 吉祖筠 曹安康
(南京师范大学附属中学 江苏南京 210003)
酵母菌固定化是学生亲自体验和实践固定化技术的一项实验,充满趣味,特别是实验成功后得到的充满弹性的凝胶珠,更是深受学生喜爱。但学生在实验中也遇到很多难题,例如海藻酸钠加热时易焦糊,凝胶珠易拖尾或形状大小不一,发酵过程中凝胶珠易破裂等,针对这些问题进行了实验探究和改进。
1 比较实验效果,确定最适条件
1.1 海藻酸钠浓度对凝胶珠形成和酵母菌固定化的影响 人教版教材中要求“称取0.7 g 海藻酸钠……加入10 mL 水……直至完全溶化,用蒸馏水定容至10 mL”,即海藻酸钠溶液浓度为7%。为了解海藻酸钠浓度对酵母菌固定化效果的影响,配制了3 组浓度为4%、7%和10%的海藻酸钠溶液,分别与等体积的酵母菌液混合均匀,并用注射器将混合液滴加到0.05 mol/L 的CaCl2溶液中固定30 min,制成凝胶珠。
1.1.1 海藻酸钠浓度对于凝胶珠形状的影响首先,比较凝胶珠成形效果(表1),发现海藻酸钠浓度越低,凝胶珠越易形成规则球形,浓度过高时,拖尾严重,呈蝌蚪状。推测浓度低时,溶液黏着性低,易从注射器口处滴落,且在溶液表面张力作用下,能在下落过程中快速形成球形;而随着浓度升高,溶液黏着性增加,无法快速从注射器口滴落,易拖尾,凝胶珠成形效果较差。

表1 海藻酸钠浓度对凝胶珠成形的影响
称取上述3 种凝胶珠各4 g,分别置于50 mL 10%的葡萄糖溶液中进行酒精发酵。连续10 d,在每天同一时间观察凝胶珠的状态并测量发酵液中的酵母菌数量。实验发现,浓度为4%和7%的海藻酸钠溶液形成的凝胶珠形态结构稳定,在整个实验期间都未发生破裂,但10%的海藻酸钠溶液形成的凝胶珠在发酵1 d 后有部分破裂,且头部直径越大的凝胶珠越容易破裂(图1)。

图1 不同浓度海藻酸钠固定得到的凝胶珠
1.1.2 海藻酸钠浓度对酵母菌固定化的影响 对比发酵液中游离的酵母菌数量(表2),发酵前期,10%海藻酸钠组高于其他2 组,且随培养时间的增加,数量不断增加;但在发酵后期(发酵7~10 d 该组的数值无明显变化,推测可能与该组凝胶珠在前期逐渐发生破裂有关。4%海藻酸钠组和7%海藻酸钠组在发酵前期数值都较低;但随培养时间的延长,4%海藻酸钠组的游离酵母菌数呈显著上升趋势,与前期相比,增幅为20~30 倍;而7%海藻酸钠组的数目仅增加2~3 倍。考虑到酵母菌在无氧条件下进行酒精发酵产能较少,不利于其增殖,可以推测4%海藻酸钠组的游离酵母菌多来自于凝胶珠,说明海藻酸钠浓度过低时,形成的凝胶珠孔径较大,酵母菌容易泄漏,固定效果并不理想。

表2 发酵液中游离酵母菌数(个/mL)
综上所述,从凝胶珠成形和酵母菌固定效果等方面综合考虑,在4%、7%、10%的3 个浓度中,7%的海藻酸钠更适合用于固定酵母菌。
1.2 固定化时间对酵母菌固定化的影响 CaCl2溶液使凝胶珠成形的原理是,CaCl2溶液中的Ca2+与海藻酸钠发生反应,迅速在表面形成了交联的海藻酸钙聚合物[1],充分浸泡后,Ca2+与海藻酸中的多个氧原子发生螯合作用,使海藻酸链间结合得更加紧密(图2)[2],并最终导致凝胶珠的形成。品质良好的凝胶珠应该具有一定的弹性,且能在发酵过程中很好地维持自身形态结构。
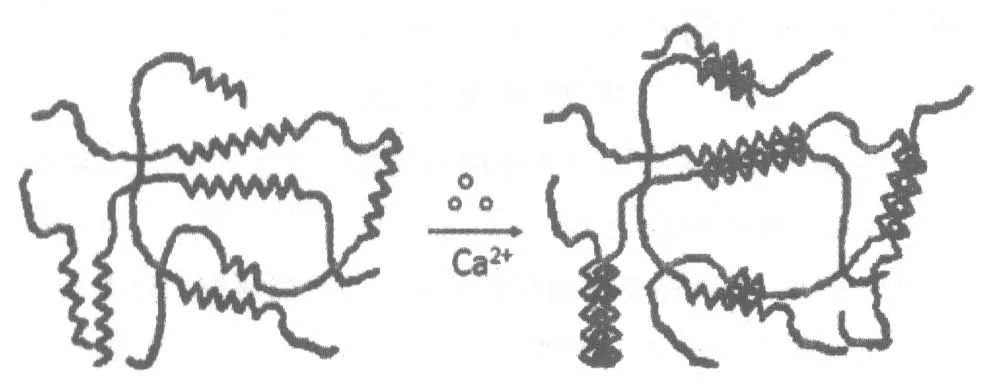
图2 海藻酸钠和海藻酸钙的结构差异[2]
1.2.1 固定化时间对凝胶珠形态的影响 教材建议用0.05 mol/L 的CaCl2固定30 min,若改变固定化的时间,会产生怎样的影响?设置5 组不同的固定化时间,分别为10 min、20 min、30 min、40 min和50 min,用游标卡尺测量各组凝胶珠的直径(表3),发现凝胶珠的直径随固定化时间的增加而变小,推测是因为固定化时间越长,Ca2+与海藻酸钠反应越充分,形成了更多不易溶于水的海藻酸钙彼此交联在一起,使得凝胶珠结构更紧凑。

表3 固定化时间与凝胶珠直径的关系
1.2.2 固定化时间对酵母菌固定效果的影响为了解固定化时间对酵母菌固定效果的影响,称取上述5 组凝胶珠各4 g,分别在50 mL 10%的葡萄糖溶液中发酵,连续10 d,每天同一时间观察凝胶珠状态。发现固定10 min 的凝胶珠从发酵第1 天起有40%的凝胶珠破裂(图3);发酵3 d后有少量凝胶珠沉于发酵液底部,并随发酵时间的延长,破裂及下沉凝胶珠比例不断增加;发酵7 d 后,所有凝胶珠都沉底,另外4 组的凝胶珠则无破裂和沉底现象。可见,固定化时间过短(10 min),凝胶珠结构不稳定,易在发酵中破裂,并在一定程度上增加酵母菌的泄漏。
图3 固定10 min 的凝胶珠发酵中大量破裂
同时,每天同一时间测量发酵液中的酵母菌数量,发现固定化时间越长的凝胶珠,其发酵液中酵母菌数量越少,但几组的酵母菌数量差异并不大,最多相差2~3 倍。
结合海藻酸钠浓度的实验,可得出结论:海藻酸钠浓度是影响包埋孔径,防止酵母菌泄漏流失的主要因素;合适的固定化时间则是凝胶珠结构稳定性的保证;固定化时间在20~50 min 时,无显著差异,考虑时间成本,建议大家在使用0.05 mol/L 的CaCl2溶液固定凝胶珠时,时间以20~30 min 为宜。
2 改进实验操作 提高实验效率
2.1 改变海藻酸钠的加热方式 常温下,海藻酸钠不易溶解,需要加热,人教版教材中建议用“酒精灯进行加热,边加热边搅拌......且加热时要用小火,或者间断加热,反复几次,直到溶化为止”。但实际操作中,酒精灯火焰大小无法控制,只能采用间隔加热的方式,时不时用试管夹将小烧杯从火焰正上方平行移走,学生无法灵活掌握加热时间,很容易出现海藻酸钠焦糊并黏着在烧杯底部的情况。因此,改用恒温水浴锅进行加热,当水温为60℃时,20 mL 规定浓度的海藻酸钠彻底溶化只需3~5 min,且不会焦糊。与酒精灯加热相比,水浴加热易于控制热量大小,海藻酸钠溶液的水分挥发也相对较少,能保持其浓度[3-4]。
2.2 有效缩短固定化时间 能否在保证固定效果的前提下适当缩短固定化时间?考虑到凝胶珠结构稳定性与海藻酸钙的形成有关,尝试通过增加CaCl2溶液的浓度缩短固定化时间,设置了3组实验,分别为0.05 mol/L CaCl2固定化30 min,0.1 mol/L CaCl2固定化15 min,及0.2 mol/L CaCl2固定化7.5 min。得到凝胶珠后分别加入葡萄糖溶液进行发酵,在10 d 的发酵过程中,3 组凝胶珠都未出现破裂和下沉现象,甚至在实验结束1 个月后,3 组凝胶珠的形态依然保持完好,无明显差别,故可通过提高CaCl2浓度缩短固定化时间节约课时。
2.3 设计并制作固定化酵母菌简易装置 制作凝胶珠时,教材要求“以恒定的速度缓慢地将注射器中的溶液滴加到配制好的CaCl2溶液中”,此外,实验中发现注射器的高度和角度也会影响凝胶珠的形状。学生初次操作,很难保证滴定速度的“恒定”和“缓慢”,导致凝胶珠大小不一,内部气泡过多等。针对这些问题,利用常用的学习工具和实验工具制作简易的酵母菌固定化装置(图4)。该装置搭建和操作方式如下:

图4 酵母菌固定化简易装置
1)用注射器吸取已经混合好的海藻酸钠与酵母菌溶液,吸取时要避免注射管中产生气泡,然后将注射器滴注口的混合溶液擦拭干净备用。
2)用试管夹夹持注射器,并将其垂直固定在距离CaCl2溶液一定高度的位置,观察注射器的活塞轴在重力下移动情况。
3)将小件重物(例如小砝码、橡皮块等)压在注射器的活塞柄上,观察活塞轴移动情况,可通过调换重物,改变压力大小,使活塞轴缓慢、匀速向下移动,将混合溶液排出注射器,即可以制备出形态大小均一的凝胶珠。
3 结论与展望
3.1 实验结论 海藻酸钠用酒精灯火加热溶解时,火势大小难以控制,易发生焦糊,可用恒温水浴锅(设定水温为60℃)进行加热。
随着海藻酸钠浓度的增加,凝胶珠孔径逐渐减小,酵母菌越难泄漏,固定效果越好;但同时混合液粘稠度增加,拖尾严重,凝胶珠成形效果较差。综合而言,浓度为7%的海藻酸钠溶液比4%和10%的更适合固定酵母菌。
凝胶珠在CaCl2溶液中的固定化时间越长,凝胶珠形态结构越稳定,越不易破裂。一般而言,在0.05 mol/L 的CaCl2溶液中需固定20~30 min,但若增加CaCl2溶液的浓度,则固定化时间可等比减少,例如在2 mol/L 的CaCl2溶液中只需固定7.5 min。
3.2 展望 可以考虑研究相同条件下,固定化的酵母菌和游离的酵母菌在增殖和发酵方面的差别,例如酒精的产生效率是否相同等。
