白术内酯Ⅰ通过TLR4/MyD88通路调控肺癌A549细胞增殖侵袭的研究
2019-07-08刘志强褚艳杰王彦博
刘志强 褚艳杰 刘 静 王彦博
肺癌是呼吸系统常见的恶性肿瘤,发病率及死亡率逐年升高,5年生存率在4%~17%之间[1]。肿瘤的发生和发展与免疫系统不能产生有效的抗肿瘤免疫反应有关[2]。MyD88是天然免疫受体TLR4信号转导通路的接头蛋白,TLR4与MyD88共同表达,通过激活多种促炎细胞因子和抗凋亡蛋白影响肿瘤患者的生存期及预后[3-4]。白术内酯Ⅰ(AtractylenolideⅠ)是从白术中提取的天然倍半萜内酯,已经用于抗炎和癌症治疗。临床研究表明,白术内酯Ⅰ可以改善胃癌患者食欲和(Karnofsky,KPS)评分,且副作用少[5]。但有关白术内酯Ⅰ对肺癌的作用研究甚少,其分子机制研究尚不清楚。
因此,本研究探讨TLR4/MyD88在肺癌组织中的表达情况,并将白术内酯Ⅰ作用于人肺癌A549细胞,通过检测细胞活力、细胞侵袭及TLR4/MyD88通路相关蛋白,阐明白术内酯Ⅰ抑制肺癌细胞增殖侵袭的作用机制,为白术内酯Ⅰ的临床应用提供依据。
1 材料和方法
1.1 肿瘤组织样本
选取2017年8月—2018年8月在哈尔滨医科大学附属肿瘤医院就诊的28例患者手术切除的肺癌组织及癌旁组织。病理诊断由哈尔滨医科大学附属肿瘤医院病理科完成。所有患者均签署了书面知情同意书。本研究经哈尔滨医科大学伦理委员会批准。
1.2 细胞培养及分组处理
人肺癌A549细胞系购自中科院上海细胞库。细胞置于10%胎牛血清的RPMI-1640培养基中培养。白术内酯Ⅰ购于MCM®小分子网站(http://www.medchemexpress.cn/),溶解于DMSO中。细胞分组为:(1)白术内酯Ⅰ处理组:给予100 μM/L白术内酯Ⅰ;(2)对照组:给予相应浓度DMSO,作为对照组。
1.3 RNA提取和定量RT-PCR
使用TRIzol试剂(Invitrogen)按照说明书从肺癌组织及癌旁组织中提取RNA。使用PrimeScript®RT试剂盒合成cDNA,SYBR Premix Ex Taq试剂盒在ABI7900序列检测器上进行qPCR,β-actin作为内参,引物信息见表1。

表1 实时定量PCR引物Table 1 Real-time quantitative PCR primers
1.4 细胞侵袭测定
使用聚碳酸酯滤膜(8 μm孔径)测定试剂盒(Corning)测定细胞侵袭迁移能力。将无胎牛血清培养基中约5×104个A549细胞接种在预先涂有基质胶的上室中,下室加入200 μL含胎牛血清的培养基。次日加入白术内酯Ⅰ、DMSO处理细胞。48 h后,使用棉签擦拭顶部腔室以除去非侵入性细胞。细胞置于100%甲醇中固定,0.1%结晶紫染色。显微镜拍照,Image-Pro Plus 6.0计数。
1.5 免疫组化染色
将肺癌组织或癌旁组织用4%多聚甲醛固定7天,转移至不同浓度的乙醇中脱水后包埋在石蜡中,切片用于免疫组化染色。组织切片置于柠檬酸盐缓冲液(pH6.0)中108℃温育5 min进行抗原修复,并于3%H2O2室温中预处理15 min,然后用PBS洗涤。随后山羊血清孵育20 min。孵育一抗TLR4(Abcam,1∶50)及MyD88(Abcam,1∶100)后置于湿盒中4℃过夜。次日孵育二抗(辣根过氧化物酶缀合的抗兔IgG),使用二氨基联苯胺(DAB)显色。每组随机选择三个视野,进行显微镜拍照。
1.6 MTT检测细胞增殖
适当浓度A549细胞铺入96孔板,贴壁后分别加入白术内酯Ⅰ、DMSO后,按24 h、48 h、72 h时间点处理。弃原细胞培养基,每孔加入200 μL MTT溶液,37℃恒温条件下孵育4 h,弃上清液,每孔加200 μL DMSO,于ELx80TM光吸收酶标仪(BioTek)上机检测,记录490 μm处吸光度值。
1.7 Western blot
用RIPA裂解缓冲液裂解白术内酯Ⅰ及DMSO处理后的细胞,提取样品总蛋白,质量标准化样品与6×缓冲液混合后加热至100℃,维持7 min。配置10%SDS-聚丙烯酰胺凝胶,电泳70 V 30 min,110 V 2 h;300 mA恒流转膜60 min。室温封闭2 h,孵育一抗TLR4(Abcam,1∶500),MyD88(Abcam,1∶1 000)及β-catenin(Abcam,1∶2 000)4℃过夜,次日用红外荧光标记二抗避光孵育1 h,使用Odyssey红外成像系统显色蛋白条带并分析。
1.8 统计学分析

2 结果
2.1 TLR4及MyD88 mRNA在肺癌组织及癌旁组织中的表达
经qRT-PCR检测28例肺癌组织和相应癌旁组织中TLR4及MyD88的mRNA表达,发现TLR4及MyD88的mRNA水平在肺癌组织中显著升高,与癌旁组织比较差异有统计学差异(P=0.016;P=0.007)(图1A,B),说明TLR4/MyD88通路与肺癌发生发展高度相关。
2.2 TLR4及MyD88蛋白在肺癌组织及癌旁组织中的表达
免疫组化结果显示,在肺癌组织中TLR4蛋白水平及MyD88蛋白水平显著高于癌旁组织(P=0.004,P=0.007)(图2A、图2C)。图2B,2D为免疫组化染色阳性率统计图,证明了TLR4/MyD88通路在肺癌中发挥着关键作用。

图1 肺癌组织及癌旁组织中TLR4及MyD88的mRNA表达Figure 1 The expression of TLR4 and MyD88 mRNA in lung cancer and adjacent normal tissues Note:*P<0.05,**P<0.01,when compared with the adjacent normal tissues.
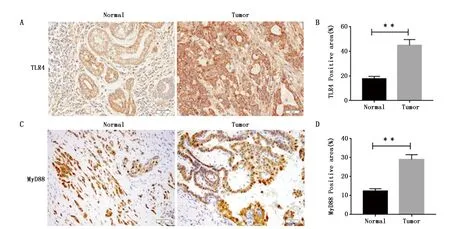
图2 肺癌组织及癌旁组织中TLR4及MyD88的蛋白表达Figure 2 The expression of TLR4 and MyD88 protein in lung cancer and adjacent normal tissues Note:B.n=5,**P=0.004;D.n=5,**P=0.007.
2.3 白术内酯Ⅰ调控肺癌细胞的侵袭能力
相对于对照组,白术内酯Ⅰ处理组A549细胞穿过基质胶的细胞数量显著减少(图3A),两组之间比较有统计学差异(P=0.028)。图3B为穿过基质胶细胞数量统计图,说明白术内酯Ⅰ抑制了A549细胞侵袭转移。

图3 Transwell检测白术内酯Ⅰ对A549侵袭能力的影响Figure 3 The effect of Atractylenolide I on invasive ability of A549 cells.* P<0.05,when compared to the negative controlNote:n=10,*P=0.028.
2.4 白术内酯Ⅰ影响肺癌细胞的增殖活力
与对照组相比较,白术内酯Ⅰ处理组显著抑制了A549细胞的增殖活力,有统计学差异(P<0.05)(图4)。进一步证实了白术内酯Ⅰ的抗肿瘤作用。
2.5 白术内酯Ⅰ影响TLR4/MyD88蛋白的表达
Western blot实验结果显示,给予白术内酯Ⅰ后,A549细胞的TLR4/MyD88蛋白的表达较对照组显著降低(图5A),差异有统计学意义(P<0.05)。图5B为统计图,说明白术内酯Ⅰ通过抑制TLR4/MyD88通路发挥抗肿瘤作用。

图4 MTT检测白术内酯Ⅰ对A549细胞活力的影响Figure 4 The effect of Atractylenolide I on viability of A549 cellsNote:n=5,*P<0.05.

图5 白术内酯Ⅰ抑制A549中TLR4/MyD88通路Figure 5 Atractylenolide I inhibited the expression of TLR4 and MyD88 protein in A549 cells Note:*P<0.05,when compared with the negative control.
3 讨论
2019年,全球肺癌新发病例数估计为2 596 112例,死亡病例数估计为228 150例。尽管在治疗方面取得了许多进展,但晚期肺癌的5年总生存率仍然很低[6]。多年来,肺癌一直被认为是非免疫原性肿瘤。然而随着免疫相关标志物如细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性死亡1(PD-1)/程序性死亡配体1(PD-L1)在CD8+肿瘤浸润淋巴细胞(TIL)中的发现以及对肿瘤免疫治疗的逐渐推广[7],近年来免疫抑制对肿瘤生长和转移的影响受到了极大关注。分子诊断学和免疫治疗学的新进展推动了新型治疗药物的快速发展,这些药物开创了肺癌管理的新时代,且具有良好的疗效和安全性[8]。
白术内酯Ⅰ是白术的主要天然成分之一,因其具有抗炎、抗过敏、抗肿瘤等多种作用而受到越来越多的关注。研究发现[9],白术内酯Ⅰ可以通过阻断Notch通路而有效地抑制肿瘤细胞的增殖,并诱导细胞凋亡。先前的研究表明[10],白术内酯Ⅰ对于K562慢性粒细胞白血病、U937急性髓细胞白血病和Jurkat T淋巴瘤细胞有细胞毒作用,可诱导白血病细胞发生ROS介导的凋亡。此外,白术内酯Ⅰ通过RAS/ERK和PI3K/AKT信号转导通路在黑色素瘤细胞中发挥抗增殖、诱导细胞分化和抑制细胞迁移的作用[11]。近期研究表明,抑制PDK1和lncRNA HOTAIR介导的EZH2基因表达有助于增强白术内酯Ⅰ和厄洛替尼对人肺癌细胞的抑制作用[12],并能通过激活ERK1/2,抑制肺癌细胞的生长[13]。本研究证实白术内酯Ⅰ可抑制A549细胞的增殖与侵袭转移,说明白术内酯Ⅰ具有抗肿瘤作用。白术内酯Ⅰ处理组TLR/MyD88的表达水平下降,进一步验证白术内酯Ⅰ通过TLR/MyD88通路影响了肺癌的发生发展。
一般认为局部细胞因子的释放和炎症诱发可以导致肿瘤免疫抑制的发生[14],而Toll样受体(TLRs)在其中发挥至关重要的作用。TLRs作为一类进化保守的模式识别受体,能选择性的识别病原微生物所携带的病原体相关分子模式,在固有免疫中介导炎症反应的发生。在此过程中,髓样分化因子88(MyD88)是关键的衔接分子,也是免疫抑制和肿瘤发生过程中的关键分子[15-16]。TLRs被配体识别后,可将信号传递给细胞内的接头分子,然后通过NF-KB和IRF-3等多种信号传导通路激活炎症,进而引起白细胞介素6等多种细胞因子的释放和抗凋亡蛋白表达的增加。有研究表明炎症相关NF-KB通路激活以及活化后所引起的炎症因子的分泌均可促进肿瘤细胞的增殖和侵袭转移[17],增加肿瘤细胞的凋亡抗性从而引起化疗耐药。另外,慢性炎症导致的免疫抑制,如T细胞和NK细胞功能不全,也有利于肿瘤细胞生长[18-19]。以上这些发现为寻找治疗肺癌的新方法提供了理论基础。在本研究中,发现在肺癌组织中,TLR4/MyD88的mRNA和蛋白的表达水平显著升高,为肺癌靶向干预治疗提供新思路。
本研究首先通过收集临床患者样本,确定TLR4/MyD88通路在肺癌组织中高表达,说明了TLR4/MyD88通路与肺癌发生发展高度相关。通过检测肺癌A549细胞的增殖侵袭情况,验证白术内酯Ⅰ通过拮抗TLR4/MyD88发挥抗肿瘤作用,进一步阐明了白术内酯Ⅰ抑制肺癌的作用机制,为肺癌的临床治疗提供新思路。
