CXCR家族蛋白在不同乳腺癌亚型中的表达及临床预后分析
2019-07-08王晓雅唐荣芝孙朝晖李林海
王晓雅 肖 斌 廖 扬 唐荣芝 孙朝晖 李林海
乳腺癌是中国女性最常见的癌症,发病率位居所有女性肿瘤第一位[1]。根据细胞表面受体的表达特征,乳腺癌可分为4种亚型:Luminal A、Luminal B、HER2阳性及三阴型(Triple negative breast cancer,TNBC)[2],其中TNBC的治疗难度最高,并且预后最不理想[3-4]。趋化因子是一类能趋化细胞定向移动的小分子分泌蛋白[5],通常由70~100个氨基酸组成,可分成四种类型:CXC类、CC类、C类和CX3C类。趋化因子受体是一类介导趋化因子行使功能的GTP蛋白耦联的跨膜受体,CXCR家族蛋白是趋化因子受体的重要的亚家族。研究表明,CXCR家族蛋白既可以通过活化免疫细胞或抑制血管增殖发挥抗肿瘤的作用,又能够趋化肿瘤细胞和血管增殖,促进细胞外基质降解,最终促进肿瘤生长浸润、趋化转移[6]。因此CXCR家族蛋白在肿瘤发生发展过程中起着重要的双向调节作用。
CXCR家族包括CXCR1-7共七种蛋白及其异构体[7],对非小细胞肺癌的小鼠模型以及临床组织样本的研究中发现,CXCR2缺陷型小鼠异位灶自发转移明显减少,原发肿瘤坏死明显比CXCR2非缺陷型小鼠增多,CXCR4mRNA在癌组织中高表达而正常组织中没有表达[8-11]。Choi等[9]通过检测晚期结直肠癌患者血清标本发现具有更多转移灶患者的血清CXCR4水平明显高于非转移患者。CXCR4还通过RUNX2-CXCR4轴促进人胃癌的侵袭和转移[10]。对前列腺癌以及前膀胱癌临床样本的分析也得到相似的结论,CXCR6和CXCR7在这两种肿瘤细胞中均有高水平的表达[12-13]。通过查阅文献发现,CXCR家族蛋白在肺癌、结直肠癌、胃癌、膀胱癌、前列腺癌等肿瘤中的高表达是明确的但是作用机制尚未有详细的报道,其在乳腺癌中的诊断和联合靶向治疗价值也尚不明确。本文拟研究CXCR家族蛋白在乳腺癌各亚型及癌旁组织中的表达水平,阐明差异表达蛋白与患者预后的相关性,为乳腺癌的早期分子诊断以及联合靶向治疗提供参考。
1 材料与方法
1.1 数据获取
登陆TCGA数据库(https://cancergenome.nih.gov/)下载CXCR家族蛋白在四个亚型(HER2、Luminal A、Luminal B和TNBC)乳腺癌组织以及癌旁织中的表达共计797例相关数据,并根据分子分型将乳腺癌样本分为四类,其中HER2 37例,Luminal A 443例,Luminal B 126例,TNBC 115例,癌旁组织76例。
1.2 预后分析
从PRECOG网站(https://precog.standford.edu/)中获取CXCR家族蛋白各成员的表达水平与乳腺癌预后关系的生存曲线(图2),结合数据对各个蛋白进行预后分析。
1.3 统计学分析

2 结果
2.1 CXCR家族蛋白在各亚型乳腺癌组织以及癌旁组织中表达数据的统计
CXCR2P1、CXCR2、CXCR3、CXCR4、CXCR5、CXCR6、CXCR7在乳腺癌组织以及癌旁组织中表达有统计学差异(P<0.05),其中CXCR2P1、CXCR3、CXCR4、CXCR5、CXCR6在乳腺癌组织中高表达,CXCR2、CXCR7在乳腺癌组织中低表达;CXCR1在乳腺癌组织以及癌旁组织中表达没有统计学差异(P>0.05)(表1)。

表1 CXCR蛋白在各亚型乳腺癌以及正常组织表达水平Table 1 The expressive levels of CXCR proteins in various subtypes of breast cancer tissues and adjacent tissues
Note:Breast cancer patients were divided into 4 subtypes:HER2,Luminal A,Luminal B and TNBC.Normal referred adjacent tissues of breast cancer.Brest cancer referred all 4 subtypes of breast cancer samples.
2.2 CXCR家族蛋白在乳腺癌组织以及癌旁组织中表达水平
CXCR2、CXCR3、CXCR4、CXCR5、CXCR6、CXCR2P1和CXCR7在HER2、LuminalA、LuminalB、TNBC和癌旁组织中表达具有统计学差异(P<0.05)(图1)。其中CXCR2在HER2和Luminal A、Luminal A和Luminal B、Luminal A和TNBC亚型之间有统计学差异(P<0.05);CXCR3在HER2和Luminal B、Luminal B和TNBC亚型之间有统计学差异(P<0.05);CXCR4、CXCR5、CXCR6和CXCR7分别在HER2和Luminal A、 Luminal B和TNBC、 HER2和TNBC、Luminal A和Luminal B中无表达差异(P>0.05),而在其他各亚型间的表达均有统计学差异(P<0.05);除HER2和TNBC比较以外,CXCR7在各亚型之间均有统计学差异(P<0.05);除HER2和Luminal A、HER2和Luminal B比较以外,CXCR2P1在各亚型之间均有统计学差异(P<0.05)。

图1 CXCR家族蛋白在乳腺癌各亚型及癌旁组织中表达水平Figure 1 The figures showed the expression of CXCR family proteins in different subtypes of breast cancer tissues and adjacent tissuesNote:A.The expression of CXCR2P1 in different subtypes of breast cancer and adjacent tissues(F=349.8,P<0.001);B.The expression of CXCR2 in different subtypes of breast cancer and adjacent tissues(F=2.902,P<0.001);C.The expression of CXCR3 in different subtypes of breast cancer and adjacent tissues(F=54.89,P<0.001);D.The expression of CXCR4 in different subtypes of breast cancer and adjacent tissues(F=16.09,P<0.001);E.The expression of CXCR5 in different subtypes of breast cancer and adjacent tissues(F=252.7,P=0.011);F.The expression of CXCR6 in different subtypes of breast cancer and adjacent tissues(F=6.515,P=0.015);and G.The expression of CXCR7 in different subtypes of breast cancer and adjacent tissues(F=6.478,P<0.001).* P<0.05,** P<0.01,*** P<0.001,when compared to the corresponding group.
2.3 差异表达CXCR家族蛋白与患者无病生存期(DFS)的关系
CXCR3高表达患者DFS差于低表达患者(P<0.0001)(图2A),CXCR4、CXCR7、CXCR6高表达患者DFS优于低表达患者(图2B、2C、2D),但差异无统计学意义。
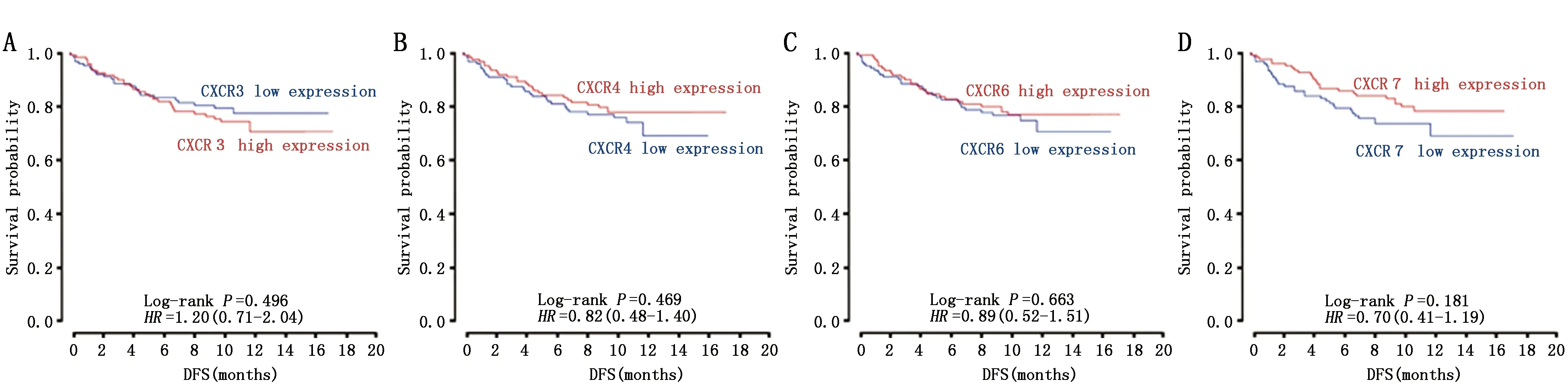
图2 差异表达CXCR蛋白与乳腺癌预后的关系Figure 2 The relationship between the differential expression of CXCR family and prognosis of breast cancerNote:Figures A-D were derived from Miller LD[14],etc.
3 讨论
本研究通过对TCGA中的乳腺癌表达谱数据进行统计分析,发现在CXCR家族蛋白中CXCR3、CXCR4、CXCR6、CXCR7在乳腺癌组织和正常组织中表达具有统计学差异,提示这些蛋白可能是乳腺癌的诊断或治疗靶点。
CXCR家族蛋白在恶性肿瘤中的生物学作用具有复杂性和多样性。CXCR3是趋化因子CXCL9的受体,属于视紫红质样七跨膜GPCR和CXCR亚家族的超家族,CXCR3有三种异构体,分别是CXCR3-A、CXCR3-B和CXCR3-alt[15]。Li等[16]采用逆转录聚合酶链反应(RT-PCR)和实时RT-PCR分析发现乳腺癌组织中CXCR3的水平明显高于正常组织,CXCR3的表达与淋巴结转移数、肿瘤大小、pTNM肿瘤分期呈正相关。其作用机制可能是CXCR3配体通过调控组织蛋白酶B(CTSB)从而促进乳腺癌侵袭和转移[17]。本文的研究结果显示CXCR3在乳腺癌的HER2、Luminal A、Luminal B和TNBC各亚型中的表达水平均高于癌旁组织,生存预后曲线也提示CXCR3高表达的患者预后较差,以上数据都支持CXCR3可作为乳腺癌的潜在的诊断或治疗靶点。
CXCR4在高度转移性乳腺癌的发展中起着重要作用,使用CXCR4拮抗剂能够选择性地促进乳腺癌细胞的凋亡,同时对其它淋巴细胞、单核细胞或巨噬细胞不具有细胞毒性[18]。而在斑马鱼异种移植模型,CXCR4抑制剂也成功阻断了TNBC早期转移的发生[19]。本研究中CXCR4在乳腺癌组织的表达量远高于癌旁组织,与文献中提到的CXCR4的促癌作用相符,充分说明CXCR4可能作为TNBC转移的靶向治疗靶点。有研究表明CXCR6/ERK1/2/RhoA/cofilin/F-actin通路在乳腺癌的发生发展中十分重要[20],另一项研究也表明CXCR6在乳腺癌高侵袭性细胞系中的表达水平显著高于低侵袭性细胞系[21],说明CXCR6的表达与乳腺癌的侵袭力密切相关。本文研究结果也提示CXCR6在四个亚型乳腺癌中的表达全部都高于癌旁组织,CXCR6也有望成为乳腺癌治疗的潜在靶点。
在本研究中我们发现CXCR4、CXCR6的预后图与数据以及文献报道的结果并不完全符合,可能是由于CXCR蛋白的生理作用取决于具体的细胞类型,在不同的细胞中发挥不同的作用导致,CXCR蛋白自身不同的亚型和异构体也可能产生不同的生理作用,例如CXCR3-A和CXCR3-B产生完全相反的生理功能[15]。另外由于本研究的实验数据是从TCGA数据库直接获取,但是TCGA的样本数据不包含患者的基本情况以及预后,只能描绘静态的突变或者变异,并且不能反映基因水平到蛋白水平的改变,无法得知研究对象处于乳腺癌的哪一病理阶段,这是TCGA数据库的一个不足之处,而CXCR蛋白在乳腺癌不同的病理阶段是否有不同的表达特征也不清楚,因此这一推测还有待进一步的实验研究。
TCGA数据库收录了各种人类癌症的临床数据、基因变异、mRNA表达、miRNA表达、甲基化等数据,是肿瘤研究者重要的数据来源。其数据分为三个等级,其中1、2等级的数据通常是限制下载,需要权限才可获取,等级3的数据大部分是开放下载的。TCGA数据库对癌症生物学、基因组学技术、生物储藏库和生物信息学领域的最新成果的应用都具有很大的帮助,科学合理地应用TCGA数据库将给我们的科研工作带来事半功倍的效果。本课题组在后续的研究中将继续采用多种实验方法继续验证CXCR家族蛋白在乳腺癌各亚型中的差异表达情况。
综上所述,CXCR蛋白可能是乳腺癌治疗的潜在靶点,以单个或者联合多个CXCR蛋白进行靶向治疗可能给转移性或难治性乳腺癌带来肯定的治疗效果有助于预测患者的预后。
