采用肝癌球体细胞筛选鉴定识别肝癌干细胞的单抗
2019-07-08孙力超孙立新杨治华冉宇靓
孙力超 杨 婧 孙立新 张 媛 杨治华 冉宇靓
肝癌是我国常见的恶性肿瘤之一,病死率居恶性肿瘤第三位。肝癌治疗失败的主要原因是复发、转移[1]。肝癌的治疗以手术、介入、放疗的局部治疗为主,而肝癌的靶向药物仅为索拉非尼且疗效较差。大量研究发现,肿瘤组织中存在着肿瘤干细胞,它具有自我更新、高致瘤性、高侵袭、高转移的能力,且能抵抗放化疗,是肿瘤转移和复发的根源[2]。因此如能获得靶向肝癌干细胞的单抗治疗肝癌将有望克服临床上现有这些治疗手段的缺陷,改善肝癌患者的预后。为了获得抗肝癌干细胞单抗,在前期研究中,我们从人肝癌组织中分离获得肝癌细胞,经过体外无血清成球培养、富集肝癌干细胞后,免疫小鼠,并利用杂交瘤技术制备了富含抗肝癌干细胞单抗的单抗库[3]。研究证实无血清悬浮培养可以富集、培养肿瘤干细胞[4]。为了高效筛选抗肝癌干细胞单抗,本研究采用人肝癌细胞株HCC97L无血清成球细胞作为肝癌干细胞模型去筛选识别抗肝癌干细胞的单抗,并鉴定其功能,为靶向肝癌干细胞治疗肝癌提供新的靶点。
1 材料与方法
1.1 细胞免疫荧光检测
以1×104/孔MHCC97L细胞接种于96孔细胞培养板,37℃、5%CO2培养24 h。活细胞免疫荧光:加入单抗28C10以及对照一抗,室温孵育1 h;活细胞洗液(含1%BSA的PBS)洗涤5次,每次5 min;室温下,4%的多聚甲醛固定15 min;固定细胞洗液(含0.1%BSA、0.05%tween-20的PBS)洗涤5次,每次5 min;100 l biotin-IgG(1∶300稀释),室温反应30 min。洗涤3次,加入100 l Cy3-Avidin(1∶1 000稀释),室温避光反应30 min。用50 μL含10 μg/mL DAPI、50%甘油的PBS封闭。固定细胞免疫荧光:先将细胞固定,再孵育一抗,其他方法同活细胞免疫荧光。
1.2 流式细胞术
以1×106个/管,加入单抗28C10以及对照一抗,室温孵育1 h,PBS洗涤3次,加入FITC标记二抗避光反应30 min,PBS洗涤3次,流式细胞仪检测。
1.3 MHCC97L细胞PKH26染色以及无血清悬浮成球培养
采用红色荧光染料PKH26标记肿瘤干细胞[5]。根据PKH26说明书操作,首先消化细胞,制成浓度2×107个/mL的细胞悬液,PKH26染色,室温孵育5 min后用等量含质量百分比为10%血清的培养液终止反应,PBS洗3次,用含EGF(20 ng/mL)、bFGF(20 ng/mL)、B27(1∶50)、LIF(10 ng/mL)、LG(L-Glutamine,2 mmol/L)和Heparin的完全培养基重悬,低黏附的6孔细胞培养板中培养。
1.4 CCK-8法检测28C10阳性细胞的顺铂耐药性
流式分选MHCC97L 28C10+细胞、28C10-细胞和MHCC97L亲本细胞。以4 000个/孔接种于96细胞培养板,并加入含顺铂的培养基终浓度为0、0.5、1、1.5、2 μmol/L培养7天后,加入CCK-8,检测波长450 nm处的吸光度值,计算各组的半数抑制浓度(IC50)。
1.5 单抗28C10阳性细胞的裸鼠体内致瘤性实验
流式细胞分选获得MHCC97L 28C10+细胞、28C10-细胞和MHCC97L亲本细胞。28C10+细胞接种2×103、1×104、2×104细胞/只,28C10-细胞接种2×104、6×104、1×105细胞/只,接种裸鼠的皮下,每组5只,观察成瘤情况。
1.6 免疫组化
采用SP法免疫组化检测,操作程序按试剂盒说明书进行。对组织切片进行脱蜡和水化,采用微波炉和柠檬酸盐缓冲液进行抗原修复。内源性过氧化物酶阻断溶液室温孵育10 min;山羊血清室温封闭10 min;加单抗28C10,4℃孵育过夜。加入biotin-羊抗鼠/兔IgG,室温孵育10 min;加入链霉菌抗生素蛋白-过氧化物酶,室温孵育10 min,PBS冲洗;DAB显色;苏木素复染,盐酸-酒精分色,氨水反蓝,脱水,封片。染色评分标准:根据阳性癌细胞占切片内全部肿瘤细胞的比例将其分为,阴性:未发现阳性细胞;弱阳性:阳性细胞<33.0%;中阳性:阳性细胞在34.0%~66.0%之间;强阳性:阳性细胞>67.0%,在结果统计中,认为弱阳性与阴性为阴性,中阳性与强阳性为阳性。
1.7 实时定量PCR法
采用Trizol提取总RNA,逆转录成cDNA,总RNA用量为1 mg,总体积20 μL。按照qPCR试剂产品说明书进行实时定量PCR。反应体系20 μL:模板2 μL,上下游引物各0.4 μL,qPCR试剂10 μL,H2O 7.2 μL,3个平行孔。反应条件:预变性95℃,5 min;变性95℃,10 s,退火延伸60℃,30 s,40个循环。PCR引物:
Sox 2上游引物:CATCACCCACAGCAAATGACA,下游引物:TCCTACCGTACCACTAGAACTT;Oct-4上游引物:TATACACAGGCCGATGTGG,下游引物:GTGCATAGTCGCTGCTTGA,Nanog上游引物:ATGCCTCACACGGAGACTG,下游引物:CTGCGTCACACCATTGCTA;
GAPDH上游引物:GAACGGGAAGCTCACTGG,下游引物:GCCTGCTTCACCACCTTCT。采用相对表达量2-ΔΔct的方法处理数据。
1.8 统计学处理
统计学处理采用SPSS 17.0软件分析,两组间计量资料比较采用t检验,计数资料的比较采用χ2检验和连续性校正χ2检验,两组以上独立样本比较采用方差分析(ANOVA),P<0.05表示差异有统计学意义。
2 结果
2.1 MHCC97L细胞中存在有肿瘤干细胞
采用无血清悬浮培养及PKH26染色实验证明[5],MHCC97L细胞中的肿瘤干细胞能被PKH26标记,并能够在无血清培悬浮培养条件下形成细胞球(图1)。流式检测发现MHCC97L细胞、球体细胞中CD90阳性比例分别为4.76%、16.2%,较MHCC97L亲本细胞提高近3倍(图2)。我们选择MHCC97L的sphere细胞筛选抗肝癌干细胞单抗。
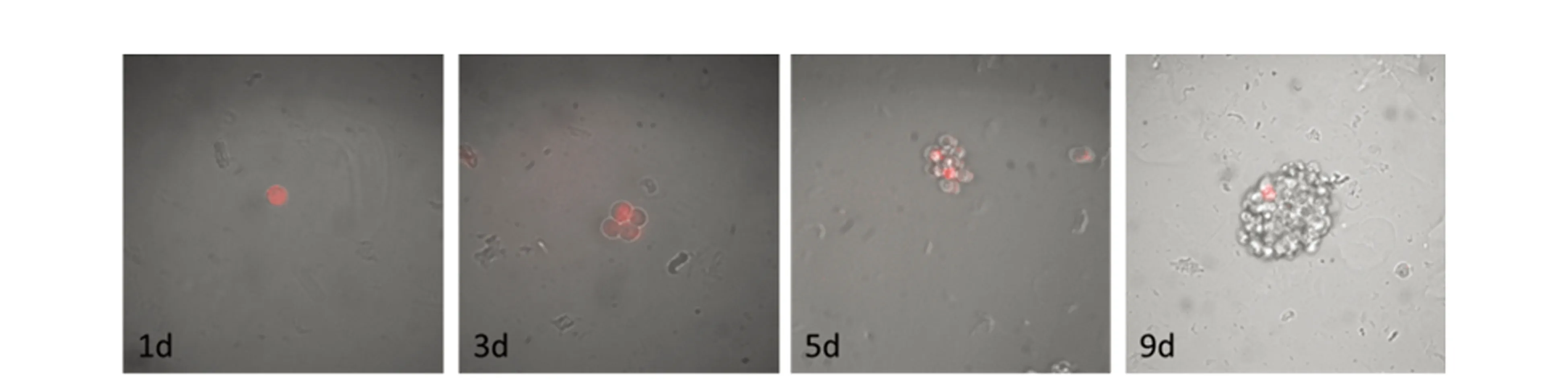
图1 MHCC97L细胞的PKH26染色Figure 1 Sphere formation of PKH26 dye-labeled in hepatic cancer MHCC97L cells

图2 流式检测CD90在MHCC97L细胞和sphere细胞中的表达Figure 2 Expression of CD90 in MHCC97L cells and sphere cells detected by flow cytometry
2.2 抗人肝癌干细胞单抗的筛选
采用抗体成球抑制实验筛选抗人肝癌干细胞单抗,共获得6株能显著抑制MHCC97L无血清成球的杂交瘤单抗,抑制率分别为54.67%,50.33%,45.73%,42.26%,39.11%,37.63%(表1)。
2.3 抗人肝癌干细胞单抗28C10的鉴定
2.3.1 MHCC97L sphere细胞中28C10+细胞所占比例 流式细胞检测结果显示,MHCC97L亲本细胞以及sphere细胞中28C10+细胞比例分别为7.98%、10.7%,富集了近1.34倍,提示单抗28C10可识别肝癌干细胞(图3)。

图3 流式检测28C10识别的抗原蛋白在MHCC97L细胞和sphere细胞中的表达Figure 3 Expression of antigen recognized by 28C10 in MHCC97L cells and sphere cells detected by flow cytometry
2.3.2 28C10识别抗原与CD90在MHCC97L细胞中的定位 细胞免疫荧光检测单抗28C10识别的抗原蛋白和肝癌干细胞标志物CD90在MHCC97L细胞中的定位,结果显示单抗28C10所识别的抗原定位于细胞膜,且能与CD90共定位,提示单抗28C10可识别肝癌干细胞(图4)。

图4 MHCC9L细胞中28C10与CD90的共定位Figure 4 Co-localization of 28C10 and CD90 in MHCC97L cells
2.3.3 28C10+MHCC97L细胞中干性相关基因的表达 采用Real-Time PCR方法检测MHCC97L 28C10+细胞中的干性相关转录因子Oct-4、Sox 2和Nanog的表达,结果显示,MHCC97L 28C10+细胞Sox-2和Oct-4表达显著高于MHCC97L 28C10-细胞(P<0.05),提示28C10+细胞具有肿瘤干细胞特征(图5)。

图5 MHCC9-L 28C10+细胞中干性相关基因的表达Figure 5 The expression of Sox-2,Nanog and Oct-4 related stem cells in MHCC9-L 28C10+ cells
2.3.4 28C10+MHCC97L细胞自我更新能力的分析 采用流式细胞分选技术分选MHCC97L细胞中28C10+细胞、28C10-细胞,将其和亲本细胞进行无血清悬浮培养,结果显示,28C10+细胞的成球数为(103±7)个,显著高于MHCC97L细胞的成球数(68.7±6.8)个和28C10-细胞的成球数(47.7±8.3)个(P<0.05),进一步提示单抗28C10识别肝癌干细胞(P<0.05)(图6)。
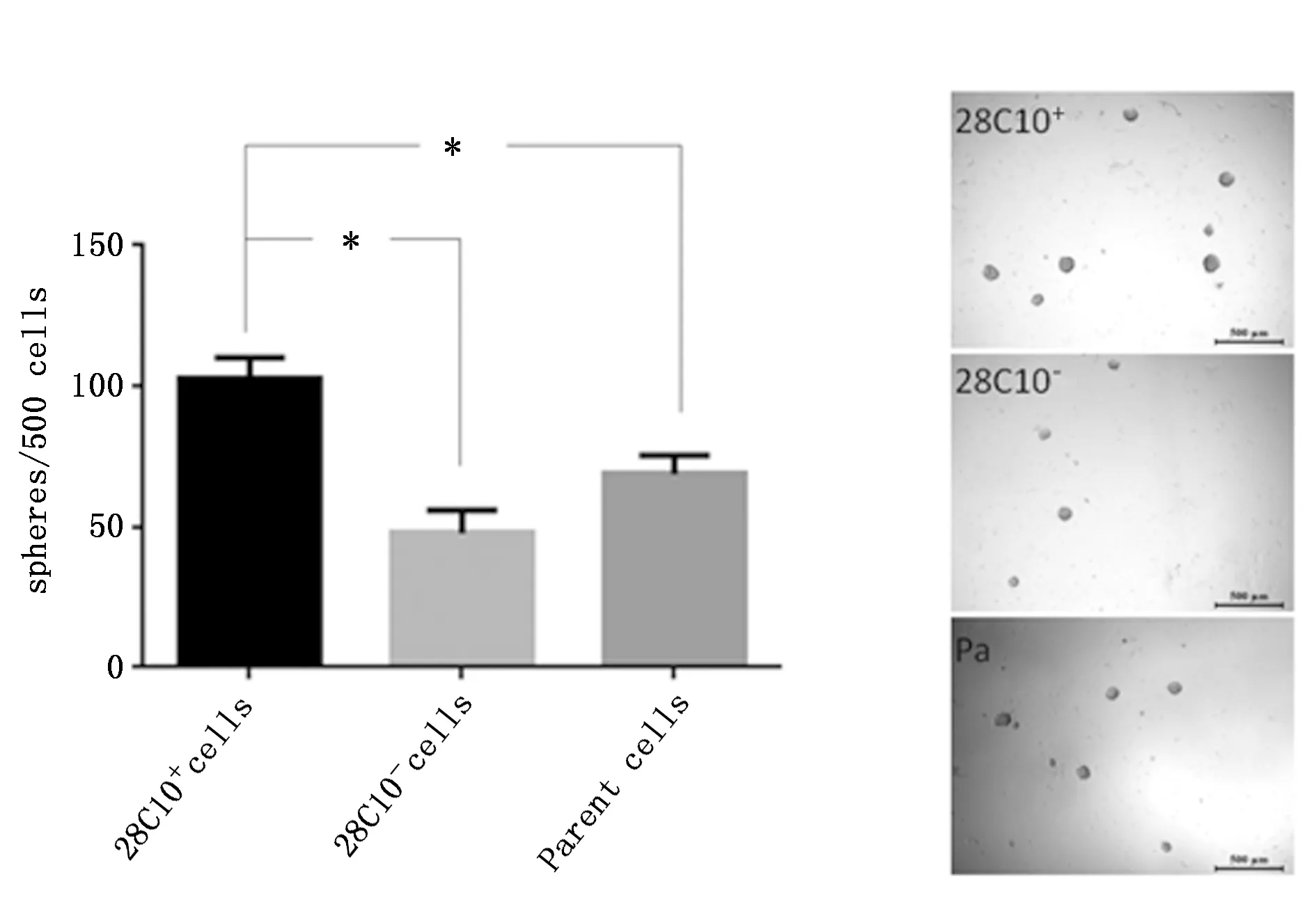
图6 28C10+细胞、28C10-细胞和亲本细胞无血清成球能力Figure 6 Sphere forming capacity of 28C10+,28C10- and parent MHCC9-L cells in serum-free suspension cultureNote:*P<0.05.
2.3.5 28C10+MHCC97L细胞侵袭能力的分析 侵袭实验结果显示,MHCC97L细胞中28C10+细胞的侵袭细胞数(341.8±54.6)/视野显著高于28C10-细胞侵袭细胞数(102.2±15)/视野(P<0.05),提示单抗28C10识别的肝癌干细胞侵袭能力强(图7)。
2.3.6 28C10+MHCC97L细胞的顺铂耐药性分析 CCK8检测结果显示,28C10+细胞较28C10-细胞以及亲本细胞更加耐受顺铂处理,IC50分别为1.96 μg/mL、1.16 μg/mL和1.43 μg/mL。提示单抗28C10识别的细胞具有耐药的特征(图8)。

图7 28C10+细胞、28C10-细胞和MHCC97L的侵袭能力Figure 7 Invasive capacity of 28C10+,28C10- and parent MHCC97L cellsNote:*P<0.05.

图8 28C10+细胞、28C10 -细胞和亲本细胞在不同浓度顺铂作用下的存活率Figure 8 Comparison of the Cisplatin-resistance capacity of 28C10+,28C10- and parental MHCC97L cellsNote:*P<0.05.
2.3.7 28C10+细胞在裸鼠体内致瘤性分析 将28C10+、28C10-细胞和亲本细胞分别接种至裸鼠皮下观察致瘤性,结果显示,2个月时2×104个28C10+细胞即可形成肿瘤,成瘤率为40%。另外1只未形成肿瘤的裸鼠形成了肺部转移灶(1/5),而28C10-细胞未形成肿瘤(图9)。提示单抗28C10识别细胞有较强的致瘤性和转移能力(表2)。
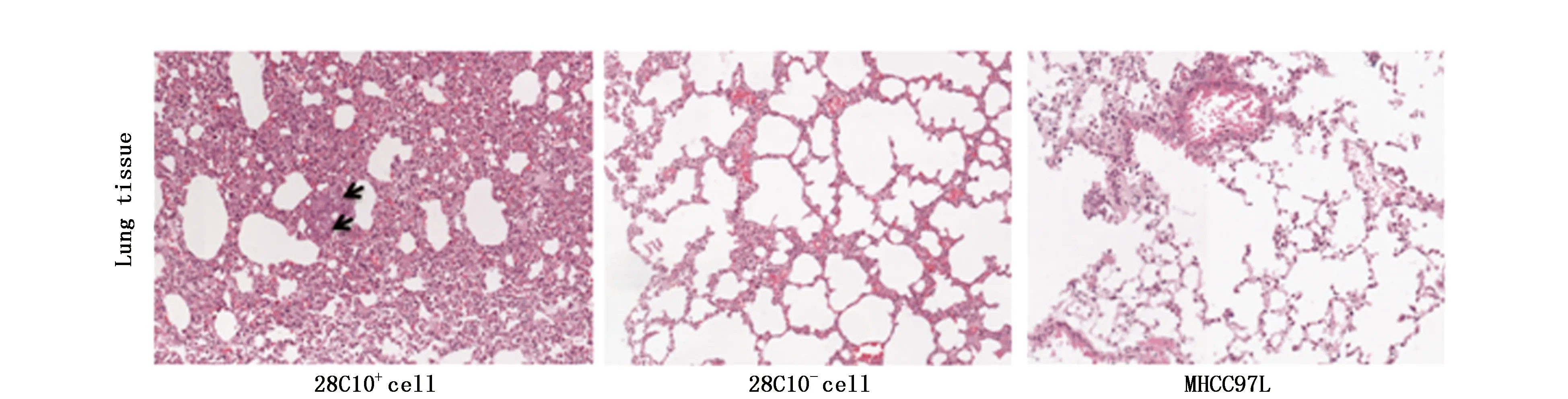
图9 28C10+、28C10-细胞和MHCC97L细胞发生肺转移情况Figure 9 Lung metastasis formed in nude mice implanted by 28C10+,28C10- and parent MHCC97L cells
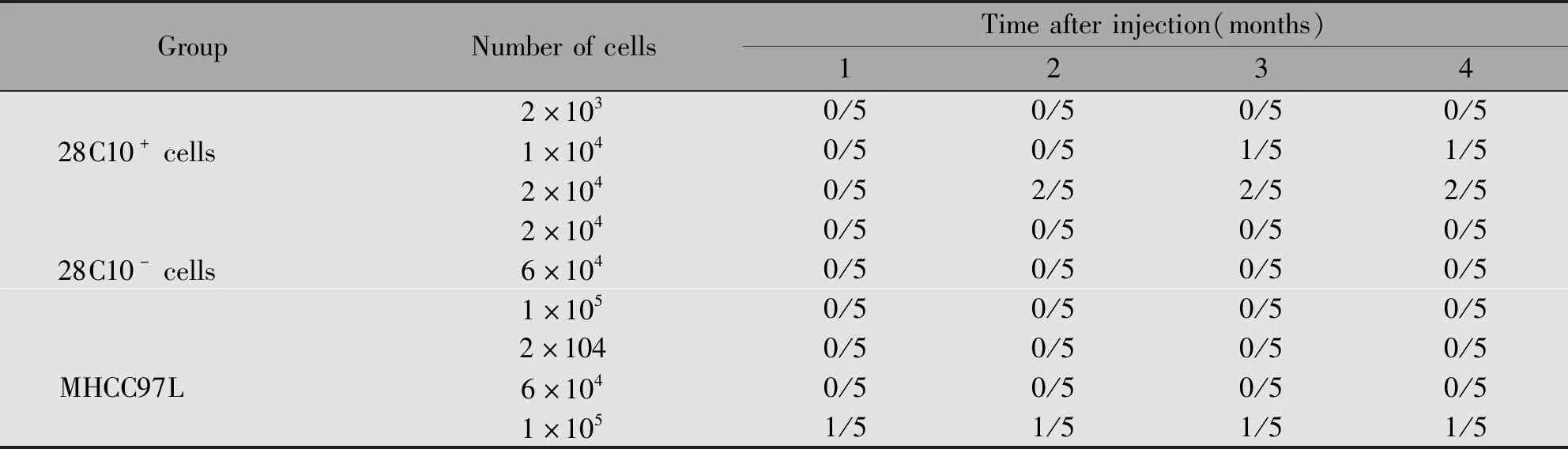
表2 28C10+、28C10-、MHCC97L细胞接种裸鼠的致瘤性Table 2 Tumorigenicity of 28C10+,28C10- and parent MHCC97L cells
2.3.8 单抗28C10对人肝癌组织的识别情况及临床特征的关系 免疫组化结果显示,单抗28C10识别的抗原在人肝癌组织中的阳性率为72.0%(77/107),临床相关性分析结果显示,28C10识别的抗原在肝癌组织中的表达与肝癌组织分化密切相关(P<0.05)(表3)。

表3 28C10识别的抗原表达与肝癌患者临床病例特征之间的关系Table 3 The Relation between antigen levels recognizing by 28C10 and clinical parameters of patients with hepatic cancer
2.3.9 单抗28C10识别抗原的鉴定 采用免疫亲和层析技术分离28C10识别的抗原,并经LC-MALDI-TOF/TOF质谱鉴定,经Mascot数据库序列比对分析,结果显示单抗28C10靶抗原为HSP90α蛋白(图10)。

图10 蛋白质谱结果Figure 10 The result of LC-MALDI-TOF/TOF
3 讨论
肿瘤干细胞是存在于肿瘤组织中的一小部分(约占1%~5%)具有干细胞特性的癌细胞,是肿瘤转移和复发的根源[6]。目前有多篇研究发现肝癌细胞系、肝癌组织中存在有肝癌干细胞,EpCAM[7]和CD90[8]是肝癌干细胞标志物,并且发现这两个亚群细胞具有不同的功能。EpCAM+肝癌细胞生长快,CD90+肝癌细胞更易发生肺转移[9-10]。目前仍没有肝癌干细胞特异的标志物。如能获得肝癌干细胞特异靶点将有利于阐明肿瘤干细胞在肝癌生长、转移和预后中的作用及其机制。
为了获得肝癌干细胞特异靶点,我们首先利用已经建立的功能性单抗库技术平台,从人肝癌组织中分离获得癌细胞,经过体外无血清悬浮培养富集肿瘤干细胞,免疫小鼠,制备了抗肝癌干细胞的单抗库,前期研究发现该单抗库中含有特异识别肝癌干细胞的单抗[11]。
无血清悬浮培养可以培养、富集肿瘤干细胞[12]。为了能够高效筛选出抗肝癌干细胞单抗,我们选择MHCC97L sphere细胞为细胞模型去筛选识别肝癌干细胞的单抗。抗体体外功能实验结果显示单抗库中有6株杂交瘤单抗能显著抑制MHCC97L细胞在无血清培养基中形成细胞球,抑制率分别为54.67%,50.33%,45.73%,42.26%,39.11%,37.63%。结合杂交瘤细胞分泌抗体的产量,我们选择产量高、抑制率强的单抗28C10进一步鉴定。细胞免疫荧光结果显示单抗28C10识别的抗原定位于细胞膜和细胞浆,并且该抗原与CD90的表达在MHCC97L细胞中可共定位。流式细胞检测发现在MHCC97L细胞中28C10+细胞较28C10-细胞的比例富集1.34倍,且MHCC97L 28C10+细胞Sox-2和Oct-4表达显著高于MHCC97L 28C10-细胞,提示单抗28C10可识别肿瘤干细胞。
为了进一步证明单抗28C10能够识别肝癌干细胞,我们流式分选出28C10+细胞分别进行体外无血清成球、侵袭、耐药实验。结果显示MHCC97L 28C10+较28C10-细胞在无血清培养基中能很好的成球具有更强自我更新能力,且该细胞侵袭能力强,并能耐受顺铂的处理。我们还将经过流式分选出28C10+MHCC97L细胞,接种于裸鼠,检查其致瘤能力,结果发现28C10+细胞2个月可形成肿瘤,成瘤率为40%,其致瘤能力远强于28C10-细胞。另外1只未形成肿瘤的裸鼠形成了肺部转移灶(1/5)。以上实验充分证明28C10是识别肝癌干细胞的单克隆抗体。提示单抗28C10识别细胞为肿瘤干细胞。免疫组化结果显示,单抗28C10识别的抗原在人肝癌组织中特异性表达,阳性率为72.0%。
进一步验证单抗28C10的组织特异性,我们收集了107例组织标本,检测28C10识别的抗原在肝癌组织中的表达情况,结果显示,单抗28C10能特异识别肝癌组织,阳性率为72.0%,具有很好的组织特异性。临床相关性分析显示28C10识别的抗原在肝癌组织中的表达与肝癌组织分化密切相关。质谱鉴定结果显示单抗28C10靶抗原为HSP90α蛋白。在此基础上,我们将进一步研究该单抗体内外抑制肝癌干细胞的分子机制,最终希望为靶向肿瘤干细胞治疗肝癌提供候选靶标和抗体药物。
