盐类水解的规律、影响因素及其应用
2019-07-08河北
河北
所谓盐类水解,是指在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。其实质是盐电离出来的阴离子跟水电离产生的H+结合,而阳离子跟水电离产生的OH-结合,进而破坏水的电离平衡,水的电离程度增大,导致c(H+)≠c(OH-),使得溶液呈碱性、酸性或中性。水解反应是可逆的吸热反应,是酸碱中和反应的逆反应,只是水解反应的程度较微弱。
一、盐类水解及其规律
盐类水解必须具备两个条件:(1)盐必须溶于水;(2)盐中必须有弱酸阴离子或弱碱阳离子。其规律可简单表述为“有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性。”

盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否中性pH=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH+4、Cu2+酸性pH<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性pH>7

溶液中的“四大常数”Ka(Kb)、Kw、Kh、Ksp只与温度有关,其中:Ka、Kb、Kw随温度的升高而增大。
(1)CH3COONa、CH3COOH溶液中,Ka、Kh、Kw的关系是Kw=Ka·Kh。
(2)M(OH)n悬浊液中Ksp、Kw、pH间关系

【例1】(2016·全国丙卷·13)下列有关电解质溶液的说法正确的是
( )
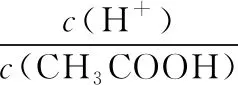
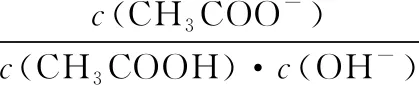
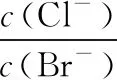
【答案】D

【例2】(2014·上海卷)室温下,甲、乙两烧杯均盛有5 mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4。关于甲、乙烧杯中溶液的描述正确的是
( )
A.溶液的体积10V甲≤V乙
B.水电离出的OH-浓度:10c甲(OH-)≤c乙(OH-)
C.若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙
D.若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙
【答案】AD
【解析】本题考查弱电解质的电离和盐类水解。由题意原甲、乙两烧杯均盛有5 mL的溶液,向乙烧杯中加水稀释至pH=4,若该酸为强酸则10V甲=V乙,若为弱酸10V甲

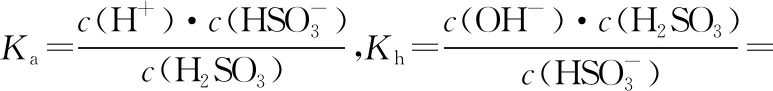
二、溶液中粒子浓度比较的规律
1.溶液中粒子浓度比较的两个理论依据

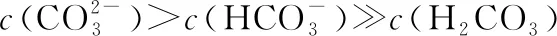
2.电解质溶液中的离子定量关系

3.解题思路
4.大小比较方法

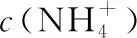
(3)多元弱酸溶液:如H2S溶液:c(H+)>c(HS-)>c(S2-)>c(OH-)
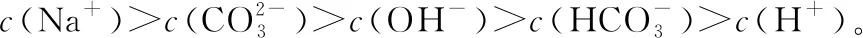
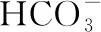
(6)混合溶液:混合溶液中离子浓度的比较,要注意能发生反应的先反应后再比较,同时要注意混合后溶液体积的变化,一般情况下,混合液的体积等于各溶液体积之和。
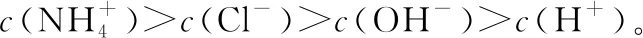
②分子的电离小于相应离子的水解:如在0.1 mol·L-1的NaCN和0.1 mol·L-1的HCN溶液的混合液中,各离子浓度的大小顺序为c(Na+)>c(CN-)>c(OH-)>c(H+)。
( )
A.加入氢氧化钠固体 B.加水
C.通入二氧化碳气体 D.加入饱和石灰水溶液
【答案】D

【跟踪训练】常温下,对于pH均为9的NaOH溶液、CH3COONa溶液,下列说法正确的是
( )
A.两溶液稀释10倍后,pH相等
B.两溶液加热至相同的温度后,pH相等
C.两溶液中各加入等体积的pH等于5的HCl溶液后,pH相等
D.两溶液中水的离子积相等
【答案】D
【解析】A.加水稀释促进醋酸钠水解,导致溶液中pH大小为CH3COONa>NaOH,故A错误;B.水的电离和盐类水解都是可逆过程,加热促进水的电离和醋酸根离子水解平衡正向进行,pH=9的氢氧化钠溶液pH变化不大,CH3COONa溶液加热促进水解溶液pH增大,pH不相等,故B错误;C.两溶液中各加入等体积的pH等于5的HCl溶液后,盐酸和氢氧化钠溶液恰好完全反应,溶液显中性,和醋酸钠反应生成醋酸,溶液显酸性,pH不同,故C错误;D.常温下,水的离子积常数随温度变化,对于pH均为9的NaOH溶液CH3COONa溶液中水的离子积相等,故D正确;故选D。
三、影响盐类水解的因素
影响盐类水解的因素表现在两个方面:
(1)内因:盐本身的性质,组成盐的酸根相对应的酸越弱(或阳离子对应的碱越弱),水解程度就越大,溶液的碱性或酸性越强。
(2)外因:

因素水解平衡水解程度水解产生离子的浓度温度升高正向移动增大增大浓度增大正向移动减小增大减小(即稀释)正向移动增大减小外加酸碱酸弱碱阳离子的水解程度减小碱弱酸根离子的水解程度减小


条件移动方向H+数pH现象升温正向移动增多减小颜色变深通HCl逆向移动增多减小颜色变浅加H2O正向移动增多增大颜色变浅加NaHCO3正向移动减小增大生成红褐色沉淀,放出气体
【例3】(2015·天津卷)室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质。有关结论正确的是
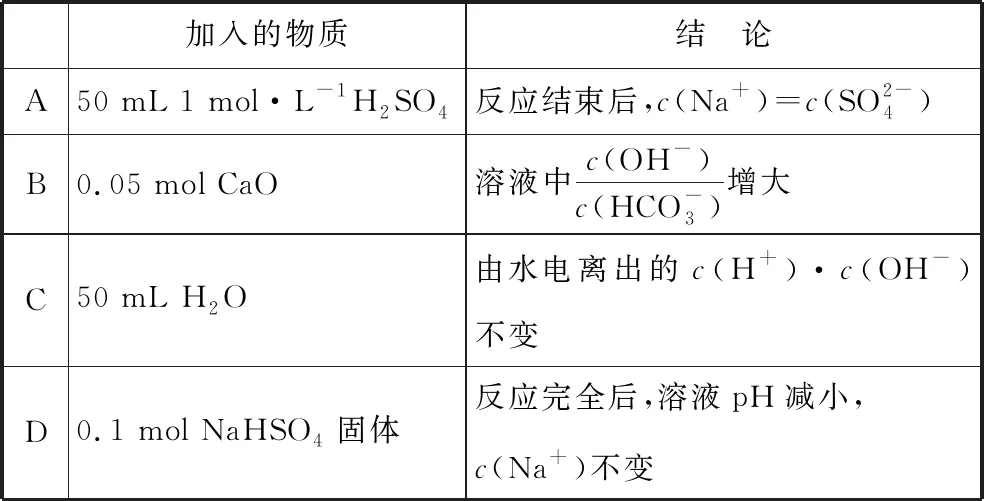
( )
【答案】B


( )

B.升高温度,溶液pH减小
C.稀释溶液,溶液中所有离子浓度都减小
【答案】A

【跟踪训练】0.1 mol·L-1AlCl3溶液,温度从20℃升高到50℃,浓度增幅最大的离子是
( )
A.Cl-B.Al3+C.H+D.OH-
【答案】C

四、盐类水解的应用
盐类水解的应用有很多,从理论上说,包括:

(2)判断酸性强弱:NaX、NaY、NaZ三种盐pH分别为8、9、10,则酸性HX>HY>HZ;
(3)物质的提纯:除去MgCl2溶液中的Fe3+,可加入MgO、镁粉、Mg(OH)2或MgCO3;

(6)加热蒸发和浓缩盐溶液时产物的判断:加热浓缩不水解的盐溶液时一般得原物质;加热浓缩Na2CO3型的盐溶液一般得原物质;加热浓缩FeCl3型的盐溶液,最后得到Fe(OH)3,灼烧得Fe2O3;加热蒸干(NH4)2CO3或NH4HCO3型的盐溶液时,得不到固体;加热蒸干Ca(HCO3)2型的盐溶液时,最后得相应的正盐;加热Mg(HCO3)2、MgCO3溶液最后得到Mg(OH)2固体;加热Na2SO3型盐溶液,最后被空气氧化为Na2SO4。
盐类水解的实际应用也有许多情况,如溶液配制、试剂贮存、分离除杂、泡沫灭火器原理等:
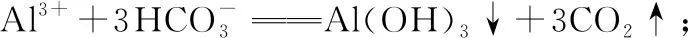


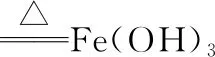
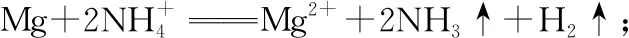
(7)盐溶液的配制:
①配制强酸弱碱盐溶液,需在溶液中分别加入几滴相应的强酸,抑制弱碱阳离子的水解。如FeCl3、SnCl2溶液时常将它们溶于较浓的盐酸中,然后再用水稀释到相应的浓度,以抑制它们的水解;配制Fe2(SO4)3、CuSO4等溶液时,滴几滴稀硫酸。
②配制强碱弱酸盐溶液时,需滴几滴相应的强碱,可使水解平衡逆向移动,抑制弱酸根离子的水解,如配制Na2CO3、NaHS溶液时滴几滴NaOH溶液。
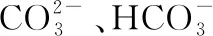
(9)制备某些金属氧化物:如果溶液浓度较低,可以利用水解反应来获得纳米材料(氢氧化物可变为氧化物)。如果水解程度很大,还可用于无机化合物的制备,如制TiO2:

(10)判断中和滴定终点时溶液酸碱性,选择指示剂以及当pH=7时酸或碱过量的判断等问题时,应考虑到盐的水解。如CH3COOH与NaOH刚好反应时pH>7,若二者反应后溶液pH=7,则CH3COOH过量。指示剂选择的总原则是,所选择指示剂的变色范围应该与滴定后所得盐溶液的pH范围相一致。即强酸与弱碱互滴时应选择甲基橙,弱酸与强碱互滴时应选择酚酞。
(11)物质的提纯(水解除杂):
如MgCl2溶液中混有少量Fe3+杂质时,因Fe3+水解的程度比Mg2+的水解程度大,可加入MgO或MgCO3等,导致水解平衡正向移动,生成Fe(OH)3沉淀而除去。
【例5】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的
( )
A.20 mL 2 mol/L FeCl3溶液
B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液
D.40 mL 2 mol/L NH4HCO3溶液
【答案】A
【解析】本题综合考查物质的性质,主要对水解原理应用及根据元素守恒的计算等知识考查,加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况来解答。
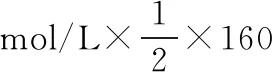
【例6】合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是
( )
A.金属焊接时可用NH4Cl溶液作除锈剂
B.配制FeSO4溶液时,加入一定量Fe粉
C.长期施用铵态氮肥会使土壤酸化
D.向FeCl3溶液中加入CaCO3粉末后有气泡产生
【答案】B
【解析】NH4Cl溶液水解显酸性,能和铁锈反应从而除去铁锈,故和盐类水解有关,A错误;亚铁离子易被氧化,配制FeSO4溶液时,加入一定量Fe粉的目的是防止氧化,与盐类的水解无关,B正确;铵根水解显酸性,所以长期施用铵态氮肥会使土壤酸化,与盐类的水解有关,C错误;FeCl3是强酸弱碱盐,水解显酸性,故加入碳酸钙后有气泡产生,和盐类的水解有关,D错误。
【跟踪训练】下列根据反应原理设计的应用,不正确的是
( )




【答案】D

