猪源肠球菌明胶液化表型与5种毒力基因的检测分析
2019-07-08李岱霞蒋逸凡黎满香
李岱霞,朱 娜,蒋逸凡,任 杰,黎满香
(湖南农业大学动物医学院,湖南长沙410128)
肠球菌(Enterococcus)是一种广泛分布于大自然中的革兰氏阳性菌,在人和动物体内,肠球菌主要分布于消化道、口腔以及阴道内,是一类非常重要的条件致病菌。其中,粪肠球菌(E.feacalis)是肠球菌中最为常见,感染率最高的菌种,其感染的疾病给多种畜禽带来危害[1-2],这些疾病以感染性心内膜炎、败血症、尿路感染、脑膜炎、菌血症等为主。粪肠球菌的致病力与其携带的毒力因子以及毒力因子是否表达有着重大关系,主要包括心内膜炎抗原(efaA)、聚集物质(AS、asal、asa373)、明胶酶(gelE)、胶原蛋白黏附素(ace)、表面蛋白(esp、sprE)、溶血素(cyl)、类金黄色葡萄球菌附属基因(fsrABC)以及两个假定相关的毒力基因EF3314 和EF0591 等。
群体感应(Quorum-sensing,tfQS)是指细菌根据细胞密度变化进行基因表达调控的一种生理行为。QS 系统能够启动菌体中相关基因的表达(如胞外多糖以及胞外酶的毒力基因)[3]。fsr(Enterococcus faecalis regulator)是粪肠球菌的一种明胶酶内酯介导的QS 系统,其fsr基因座的遗传群体包括:反应调节子(fsrA)、前肽加工蛋白(fsrB)、组氨酸激酶(fsrC)、明胶酶(gelE)、丝氨酸蛋白酶(sprE)。fsr和gelE均是产生明胶酶所必需的,gelE和sprE基因共同参与宿主的组织损伤,感染试验表明,fsrABC在gelE和sprE的表达调控方面起着重要作用,两者均依赖于fsrABC蛋白的激活[4-5]。不仅如此,fsr 系统与肠球菌的致病性还有着直接的联系[6-7]。
gelE 及sprE 是两种存在于肠球菌表面的蛋白释放酶,前者可以直接或间接降解宿主细胞的的胶原蛋白或组织蛋白,有利于粪肠球菌及其致病物质向宿主组织周围扩散,进一步加重对各组织的伤害。gelE基因的上游是调节因子基因fsr,下游是sprE基因,gelE与sprE基因的完全表达由fsrA、fsrB及fsrC基因编码的密度感应系统调控,在fsrABC的调节下,gelE与sprE在某些方面具有竞争作用,如结合自溶素等,具有优势的一方更易完全表达并发挥其生物学作用。肠球菌作为一种机会性致病菌,判断其毒力的高低主要依赖于表型试验[8],如溶血试验和明胶试验等。gelE基因的完全表达对粪肠球菌呈现明胶液化的表型具有一定的作用,gelE液化明胶对粪肠球菌的致病机制具有重要意义,且与肠球菌的致病力有重要的关系。近年来,许多学者通过对肠球菌毒力基因的流行病学调查发现,粪肠球菌较屎肠球菌及其它肠球菌更容易出现明胶液化的现象,其致病性也相对较强,但并不是所有检测到gelE毒力基因的粪肠球菌均能够液化明胶[9-10],国内外就这部分明胶液化阴性菌株与gelE基因相关性报道已有很多,但对与该表型可能有关的其它基因的研究相对较少。本实验采用PCR 方法,检测375 株不同来源的肠球菌分离株的gelE、fsrA、fsrB、fsrC以及sprE这5 种毒力基因,并对这些肠球菌进行了液化明胶试验,了解不同来源猪肠球菌中毒力基因分布及差异,为肠球菌毒力基因的分子流行病学及临床治疗提供依据。
1 材料与方法
1.1 菌 株 2012 年~2016 年分离自健康猪粪便中的193 株肠球菌,包括粪肠球菌148 株,其它肠球菌45 株;分离自2014 年~2015 年健康猪肛门拭子中的139 株肠球菌,包括粪肠球菌13 株,屎肠球菌(E.faecium) 42 株,其它肠球菌84 株;2014 年~2015 年分离自经确诊为流行性腹泻病毒(PEDV)感染病猪肛门拭子中的43 株肠球菌,包括粪肠球菌9株,屎肠球菌29 株,其它肠球菌5 株。以上菌株均由湖南农业大学动物医院保存。
1.2 主要试剂 Mix 酶购自天根生化科技(北京)有限公司;DM2000 Plus DNA Marker 购自北京康为世纪生物科技有限公司;TSB 购自北京兰伯瑞生物公司;明胶购自生工生物工程(上海)股份有限公司。
1.3 肠球菌5 种毒力基因的扩增 采用水煮法提取分离的肠球菌的DNA,制备PCR 模板,引物序列参照文献[6]设计,并由北京擎科生物技术有限公司合成,PCR 扩增5 种毒力基因的目的片段。 PCR程序如下:94 ℃5 min;94 ℃ 30 s;按照各毒力基因特异性引物要求的退火温度设置,时间为30 s,72 ℃ 40 s;35 个循环;72 ℃ 7 min。PCR 扩增产物经琼脂糖凝胶电泳检测,统计结果。
1.4 肠球菌的明胶液化试验 按照TSA 配置方案制成明胶平板,将所有肠球菌分离菌无菌穿刺接种于明胶平板上,37 ℃培养18 h~24 h,4 ℃放置2 h后观察明胶液化的情况并记录。若发生明胶液化现象则菌落周围会出现浑浊明亮的光圈。根据试验结果分析5 种毒力基因与明胶液化表型的关系。
2 结 果
2.1 肠球菌5 种毒力因子基因的检测结果 以375株不同来源猪肠球菌DNA 为模板,其中粪肠球菌170 株,屎肠球菌71 株,其它肠球菌134 株,采用特异性引物对5 种毒力基因进PCR 扩增。结果显示,gelE、fsrA、fsrB、fsrC以及sprE这5 种毒力相关基因均能够检测到,检出比例为:gelE(155/375,41.3 %)、sprE(183/375,48.8 %)、fsrA (172/375,45.9 %)、fsrB(191/375,50.9 %)、fsrC(183/375,48.8 %) (表1)。该5 种毒力基因普遍存在于粪肠球菌中,且不同肠球菌之间毒力基因的携带率存在极显著差异(p<0.01)。

表1 375 株肠球菌分离株毒力基因检测结果Table 1 The virulence gene detection of the 375 Enterococcus isolates
2.2 肠球菌5 种毒力基因不同组合统计结果 对375 株肠球菌5 种毒力基因不同组合检测结果进行统计,结果显示31.7 % (119/375)的肠球菌未检测到任何1 种毒力基因;10.4 % (39/375)的菌株中同时检测到1 种毒力基因;11.5 % (43/375)的菌株同时检测到2 种毒力基因;10.4 % (39/375)的菌株同时检测到3 种毒力基因;6.7 % (25/375 )的菌株同时检测到4 种毒力基因;29.3 % (110/375)的菌株同时检测到5 种毒力基因(表2)。表明,不同来源及不同种肠球菌之间所拥有的毒力基因种类及组合方式存在差异,其中粪肠球菌拥有更多的毒力基因组合,是主要的毒力基因携带者。

表2 375 株肠球菌分离株毒力基因不同组合检测情况统计Table 2 Summary of the different combination of virulence genes in 375 Enterococcus isolates
2.3 肠球菌明胶液化试验结果 对375 株肠球菌进行明胶液化试验,结果显示来自健康猪新鲜粪便的肠球菌中仅有104 株粪肠球菌能够分解明胶(104/193),分离自健康猪肛门拭子的肠球菌中仅1株粪肠球菌能够液化明胶(1/139),分离自PED 病猪肛门拭子的肠球菌中仅1 株粪肠球菌能够液化明胶(1/43) (表3)。比较3 种不同肠球菌的明胶液化试验结果显示,屎肠球菌和其它肠球菌中均未发生明胶溶解,该表型更容易出现在粪肠球菌中。
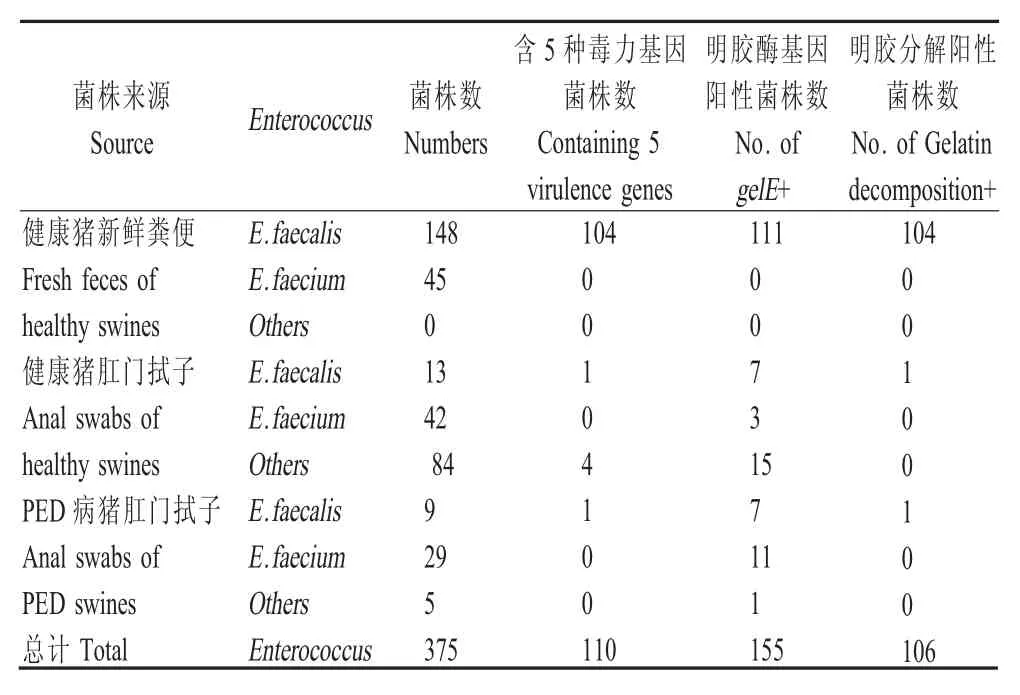
表3 375 株肠球菌分离株明胶液化试验结果Table 3 The result of gelatin liquefaction test in 375 strains of Enterococcus isolates
2.4 肠球菌gelE基因和明胶液化表型关系的分析结果 在193 株分离自健康猪新鲜粪便的肠球菌中,共111 株肠球菌检测到gelE基因,且全部为粪肠球菌,其中能够分解明胶的有104 株;139 株分离自健康猪肛门拭子的肠球菌中,仅7 株检测到gelE,且7 株均是粪肠球菌,其中1 株能够液化明胶;43株分离自PED 病猪肛门拭子的肠球菌中,仅7 株菌检测到gelE基因,且全为粪肠球菌,其中仅1 株发生明胶液化现象。粪肠球菌gelE检出率比屎肠球菌和其它肠球菌高,且更容易出现明胶液化表型,但并不是所有检测到gelE基因的粪肠球菌均能够发生明胶液化现象,表明存在肠球菌明胶液化的表型与基因型不完全一致的现象。
2.5 肠球菌明胶液化表型与5 种毒力基因关系的分析结果 对所有菌株的明胶液化试验结果与毒力因子组合检测结果统计后显示,由健康猪新鲜粪便中分离到的193 株肠球菌中,共104 株粪肠球菌能够分解明胶,且这些菌均检测到全部5 种毒力基因;由健康猪肛门拭子中分离到的139 株肠球菌中,13 株粪肠球菌仅1 株能够分解明胶,且该菌也能同时检测到全部5 种毒力基因;由PED 病猪肛门拭子分离到的43 株肠球菌中,9 株粪肠球菌中仅1 株发生了明胶分解,且该菌也同时检测到5 种毒力基因。以粪肠球菌明胶的溶解情况为因变量,5 种毒力基因的分布情况为自变量对此结果进行卡方检验,结果显示,两者之间存在极显著差异(p<0.01),初步表明,粪肠球菌gelE基因及参与gelE 表达的fsrABC、sprE基因对肠球菌明胶液化表型的出现均具有一定促进作用。
3 讨 论
本研究结果显示,粪肠球菌的各个毒力基因检出率均高于屎肠球菌及其它肠球菌,检出率最高的是sprE基因,占粪肠球菌总数的75.9 %,其次是fsrB,占 75.3 %,其余 3 种毒力基因gelE、fsrA、fsrc的检出率分别为73.5 %、68.2 %、71.2 %,张肖肖等在不同肠球菌携带毒力基因的比较中也发现不同肠球菌之间携带的毒力基因有差异,粪肠球菌毒力基因的携带率是肠球菌属中最高的[11]。分析5种毒力基因的不同组合情况显示,375 株肠球菌中,同时检测到5 种毒力基因的共有110 株,其中106株为粪肠球菌,占粪肠球菌总数的62.4 %,表明粪肠球菌较屎肠球菌及其它肠球菌更易同时检测到5种毒力基因,与先前的报道相符[12]。这可能与粪肠球菌更易出现致病性从而导致机体的感染有关。在这110 株肠球菌中,其中109 株肠球菌虽然是从健康猪分离得到,但其在宿主体内也可能存在较大的安全隐患。
粪肠球菌的致病性是多因子和多功能协同作用的结果,虽然各毒力基因检出率的高低并不能完全说明其致病性的高低,但通过大量医学临床对致病肠球菌、共生菌、食物源肠球菌以及环境肠球菌的研究得出结论,即拥有更多毒力基因组合的菌株其致病力也相对更强[13]。本实验结果显示,某些健康猪源肠球菌毒力基因组合方式差异较大,有的同时含有这5 种毒力基因,而有的则不含这5 种基因中的任何一种,但却均未出现临床感染情况。部分学者解释说虽然粪肠球菌中能够检测到毒力基因,但并不是所有毒力基因均能够完全表达,或是毒力基因表达的水平下调或过低,表达后的组合也不尽相同[14-15],还可能有其它多种因素如环境等造成上述结果。此外,这些来自正常菌群且具有多毒力基因组合的粪肠球菌,一旦其中起关键作用的毒力基因完全发挥作用,在其它完全表达的毒力因子的协同作用下,势必会给动物以及人类的健康带来威胁,这也提醒我们要防患于未然。
本研究从375 株不同来源肠球菌中,共检测到155 株gelE 阳性菌株,而其中的106 株肠球菌能够液化明胶,这与崔成等得出的结果具有一定相似性[16]。部分肠球菌表型和基因型的不一致,Eaton 等对此的解释是,在某些条件下gelE基因处于沉默状态,调控gelE基因的几个操纵子发生了缺失,或者是没有完全表达,也或者是检测的操纵子中的基因不够,忽略了对表型也很重要的其它基因[17]。同时,该106 株液化明胶的肠球菌均为粪肠球菌,表明粪肠球菌更易出现明胶液化的表型,其表型与基因型一致性较高,这与王送林等的报道一致[18]。经统计显示,含全部5 种毒力基因的粪肠球菌,其液化明胶的机率明显高于其它毒力基因组合的粪肠球菌(p<0.01),gelE基因阳性却不能液化明胶的粪肠球菌可能缺失fsrABC与sprE中的一种或几种,据此初步推测,除gelE基因外,可能还有其它能够液化明胶的基因,如fsrABC基因以及sprE基因等,其作用可能是调控gelE完全表达而实现粪肠球菌对明胶的液化,这也在一定程度上验证了Eaton 的解释[17]。编码明胶酶的gelE基因及编码丝氨酸蛋白酶的sprE基因位于同一个操纵子中,其表达由fsrABC 编码的密度感应系统调节[19]。gelE基因能否完全表达对明胶液化表型以及肠球菌致病力起着重要作用。Vinai等推测在fsr 群体感应系统的调节下,完全表达的gelE会结合并激活自溶素,使宿主细胞的胶原蛋白或组织蛋白降解从而表现出明胶液化的表型,并且能够缩短粪肠球菌的长度促使其向周围组织扩散[20];除此之外,gelE还对粪肠球菌表面合成的异常致病蛋白起到清除作用,使其正常致病蛋白在粪肠球菌表明停留并发挥致病作用。对于这5 种毒力基因之间存在的调控关系及其在肠球菌致病过程中的作用机制等,尚待进一步的研究。
