头孢硫脒新杂质的制备及结构解析
2019-07-06刘玲林顺权袁晓蒲含林
刘玲 林顺权 袁晓 蒲含林,*
(1 暨南大学细胞生物学系,广州 510630;2 广州牌牌生物科技有限公司,广州 510663)
头孢硫脒(图1)又称仙力素,是我国自主研发并第一个进入临床试验的第一代头孢菌素类药物。头孢硫脒是一个广谱抗生素,在临床应用中,对大部分革兰阳性菌和部分革兰阴性菌表现出很强的杀灭作用。临床研究表明,头孢硫脒对由金黄色葡萄球菌、表皮葡萄球菌、肺炎克雷伯菌、肠球菌等引起的呼吸道、泌尿系统、软组织、烧伤及手术后等的感染效果良好,尤其对抗药性较强的耐甲氧西林金黄色葡萄球菌、耐甲氧西林表皮葡萄球菌作用明显[1]。
药物中部分杂质的存在,会引起不良反应,影响药效。为了完善头孢硫脒的质量检测标准,文献调研发现头孢硫脒有关物质的研究中,已发表的文献均采用LC-MS推测有关物质的大致化学结构,对杂质结构中的一些原子或基团的变化未做细致研究,对于氧化杂质这样有两个以上位点可以加氧的,难以推测其氧化杂质的具体结构[2-7]。本文还提出了双键转移杂质的合成和分离纯化方法,对这两个杂质用核磁共振谱结合质谱进行了结构分析,确证了其结构。本研究为头孢硫脒生产工艺的改进、质量研究及贮藏条件的确定提供了依据[8-9]。
1 仪器与试剂
1.1 试剂
磷酸氢二钠、双氧水、三乙胺、三甲基氯硅烷均为分析纯;乙腈为色谱纯;水为公司自制的去离子水;头孢硫脒原料购于武汉泽山城生物医药技术有限公司。
1.2 仪器
HITACHI高效液相色谱仪、DF-101S集热式恒温加热磁力搅拌器、Thermo Fisher LCQ Fleet、BRUKER AVANCE Ⅲ 500MHz超导核磁共振谱仪。
2 头孢硫脒杂质的制备
2.1 液相色谱条件

图1 头孢硫脒的结构式Fig.1 Structural formula of cefathiamidine
流动相为磷酸盐缓冲液(取无水磷酸二氢钠2.76g,柠檬酸1.29g,加水溶解并稀释至1L):乙腈(80:20);流速1.0mL/min;色谱柱Wondasil C18-WR(4.6mm×250mm, 5μm),柱温30℃,检测波长为254nm,进样量10μL。
2.2 液相色谱-质谱联用条件
采用Thermo Hypersil Gold C18(160mm×2.1mm, 3μm)色谱柱,以0.05%甲酸水:乙腈(90:10)为流动相,流速0.4mL/min,检测波长254nm,柱温为30℃,进量为10μL;离子源为ESI,正离子检测模式,离子扫描范围m/z:150~2000;喷雾电压:4000V;金属毛细管温度:275℃;鞘气压力:35arb;辅助气压力:5arb。
2.3 核磁测试条件
实际照射频率:125.76MHz;去偶场频率:500.13MHz,溶剂:DMSO-d6,图谱范围:δ: 0~210ppm。
2.4 杂质的制备方法
2.4.1 氧化杂质的制备
取头孢硫脒原料1g,溶于50mL水,常温下加入30%双氧水5mL,搅拌反应2h,参照“2.1”项方法用HPLC定位反应液中目标杂质,结果如图2所示,目标杂质的保留时间为3.813min。将反应液注入ODS分离柱,乙腈-水洗脱,洗脱过程如表1所示。冷冻干燥后得到白色固体样品,纯度>98%,通过核磁共振及多级质谱分析其结构。
2.4.2 双键转移杂质的制备
以DCM为溶剂溶解头孢硫脒,加入适量三乙胺和三甲基氯硅烷,在-10℃下混合反应1h。用与反应液等体积的水萃取反应液,取水层,重复萃取3次,合并萃取液。参照“2.1”项中方法用HPLC定位目标杂质,结果如图3,目标杂质的保留时间为5.44min。将萃取的水层注入ODS材料分离柱,乙腈-水洗脱,洗脱过程如表2所示。冷冻干燥后得到黄白色固体粉末,纯度>95%,借助核磁共振及多级质谱分析其结构。

图2 氧化杂质反应液的HPLC检测Fig.2 HPLC detection of oxidized impurity reaction solution

表1 氧化杂质分离纯化过程Tab.1 Separation and purification process of oxidized impurity
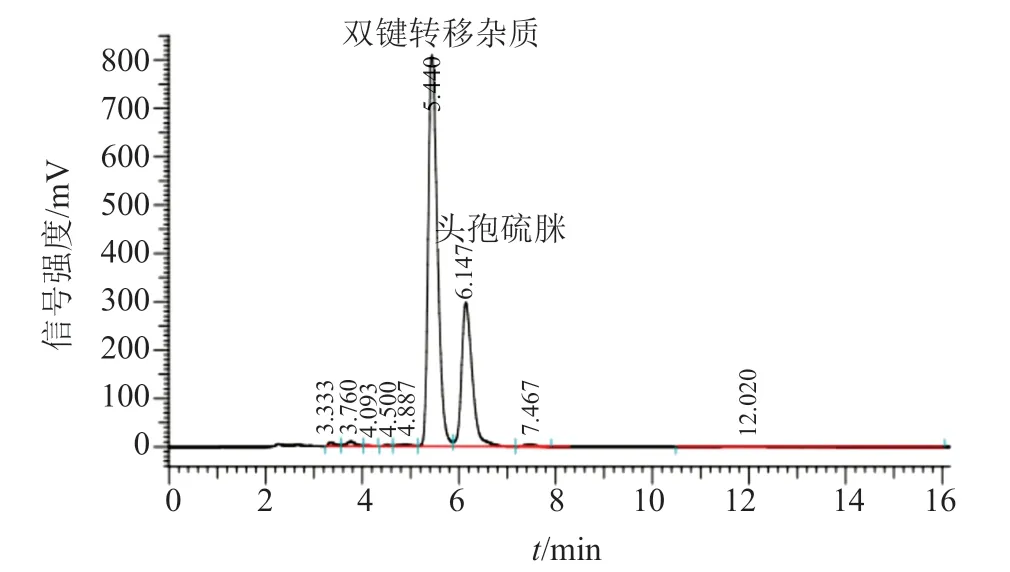
图3 双键转移杂质反应液的HPLC检测Fig.3 HPLC detection of double bond transfer impurity reaction solution

表2 双键转移杂质分离纯化过程Tab.2 Separation and purification process of double bond transfer impurity
3 杂质的结构解析
通过上述制备和分离过程,得到两个杂质的纯品,分别取固体样品20mg,用于结构分析测定。
3.1 杂质质谱及分析
取供试品溶液,参照“2.2”项下的质谱条件,采用一级全扫描质谱方式采集数据,得氧化杂质及双键转移杂质三级质谱图。
3.1.1 氧化杂质
如图4所示,m/z:[M+H]+489.10为头孢硫脒分子正好增加一个氧原子(489.10-1.0=488.2=472.2+16.0)。碎片290.97为杂质分子6-、7-位断开后,7-位上酰胺键断裂后连有氨基的六元环部分。273.94为碎片290.97去掉一个羧基上的羟基(290.97-17),219.01为碎片273.94的1-位上的乙酰氨基断裂离去后的六元环部分(273.94-54.93),200.92为碎片219.01的2-位羧基脱水后的碎片(219.01-18.09),158.94为碎片200.92断裂3-位侧链上的乙烯醇后的片段(200.92-42),具体裂解过程如图5。
3.1.2 双键转移杂质
如图6所示,分子离子峰为m/z:[M+H]+473.2, 碎片428.78是分子中去掉端部的异丙基后的部分,片段412.96是碎片428.78中去掉一个羧基氧原子,片段353.91是前一个片段断裂掉侧链上的乙酰氧基后的碎片,311.61为前一片段断裂烯丙基后的碎片,269.03为前一片段断裂异丙烯基后的碎片,201.06为除去两个环和一个亚甲基的剩余侧链部分,155.88为201.06断裂甲酰胺基后的片段,127.77为前一片段断裂亚甲胺后的碎片,具体裂解过程如图7所示。
3.1.2 杂质核磁信息

图4 氧化杂质的多级质谱Fig.4 Multistage mass spectrometry of oxidized impurity

图5 氧化杂质裂解Fig.5 Possible fragmentation of oxidized impurity

图6 双键转移杂质多级质谱Fig.6 Multi-stage mass spectrometry of double bond transfer impurity
取两个杂质样品,用DMSO溶解后,按“2.3”项下条件进行NMR分析,通过NMR结果对推断的结构进行确证。氧化杂质与双键转移杂质核磁碳谱、氢谱归属表信息如表3所示。
4 结论
如图8所示,氧化杂质的质谱分子离子峰与其结构一致为头孢硫脒增加一个氧原子,其一级、二级、三级和四级质谱图中主要碎片峰的出现都能与推测结构式分子中对应的断裂碎片的分子量相对应,从各级质谱的碎片峰推断氧化发生在5-位硫原子上。13C NMR谱中C-2和C-3的化学位移值显示其均为季碳原子,1H NMR谱中六元环上有-CH2-(C-4)的峰。
双键转移杂质的质谱分子离子峰与杂质的分子量一致,一级、二级和三级质谱图中主要碎片峰的出现都能与推测结构式分子中对应的断裂碎片的分子量相对应,13C NMR谱中C-3和C-4的化学位移值显示其为双键碳原子峰。1H NMR谱中少了未发生双键转移时的六元环上的-CH2-(C-4)峰。
综上所述,本文确定了头孢硫脒双键转移和头孢硫脒氧化杂质的具体结构,本研究结果为头孢硫脒质量控制提供了借鉴,同时也建议头孢硫脒在存储和运输过程中应尽量避免碱性环境,避免与空气过多接触。
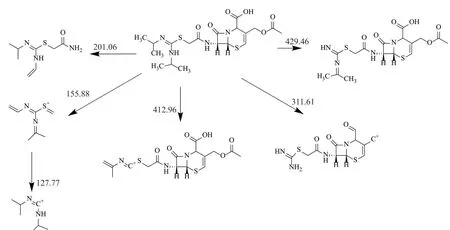
图7 双键转移杂质多级质谱裂解路线Fig.7 Multi-stage mass spectrometry cracking route for double bond transfer impurities

表3 双键转移杂质与氧化杂质的1H NMR、13C NMR化学位移归属Tab.3 1H NMR and 13C NMR chemical shift assignment of double bond transfer impurities and oxidized impurities
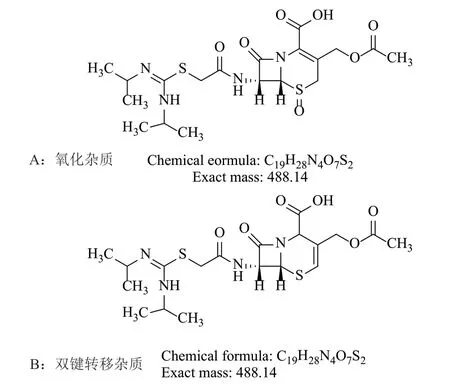
图8 杂质结构Fig.8 Structure of impurities
