基于高效液相色谱法对农产品中吡虫啉的提取和净化
2019-07-05卢兰香张艳侠祝建华刘艳明
卢兰香,薛 霞,张艳侠,杨 昊,王 骏,祝建华,刘艳明*
(山东省食品药品检验研究院,山东 济南 250101)
吡虫啉,化学名称为1-(6-氯吡啶-3-吡啶基甲基)-N-硝基亚咪唑烷-2-基胺,为内吸性新烟碱类杀虫剂,具有广谱、高效、低毒、低残留,害虫不易产生抗性,对人、畜、植物和天敌安全等特点[1],并具有触杀、胃毒和内吸等多重作用[2],广泛应谷物、蔬菜、茶叶等大多数农作物。随着吡虫啉用量增多及使用范围的日益扩大,其安全性也备受关注。研究表明,吡虫啉影响蜜蜂的采食量和死亡率[3-4],被人或动物长期食用后,会在体内蓄积,引起慢性中毒[5]。许多国家已经制定了吡虫啉在相关农产品中的最高允许限量。澳大利亚规定谷物中最高残留限量为0.05 mg/kg[6];日本肯定列表中茶叶中的限量标准为10 mg/kg,蔬菜中的最大残留限量为5 mg/kg[7];韩国也对茶叶中吡虫啉提出检测要求;我国GB 2763—2016《食品中农药最大残留限量》[1]中规定吡虫啉的最高残留限量:茶叶为0.5 mg/kg,谷物为0.05 mg/kg,黄瓜为1 mg/kg。
目前,吡虫啉的残留分析标准和研究方法主要有气相色谱(gas chromatography,GC)法[9-10]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法[11-13]、高效液相色谱法[14-18]和液相色谱-串联质谱法[19-26]。GC和GC-MS方法常受到化合物极性、沸点及前处理方法相对复杂和耗时长等限制。液相色谱-串联质谱法仪器昂贵难以普及,基质效应严重,定量存在一定的局限性。高效液相色谱法具有普及率高、定量准确、兼容性好等特点,广泛用于农药残留的检测。已报道的吡虫啉残留的前处理技术主要包括加速溶剂萃取[27]、基质固相分散、分散固相萃取、微波辅助萃取、超临界流体萃取、凝胶渗透色谱[21]、液相微萃取[17-18,23]、分子印迹技术[28]、胶束介质萃取、逆固相基质分散法、QuEChERS(quick, easy,cheap, effective, rugged and safe)[16,25-26]和固相萃取(solid-phase extraction,SPE)[14-15,19-20]等。由于农产品样品的多样性和复杂性,常采用的净化方式有SPE和QuEChERS两种。对于农产品中吡虫啉的高效液相色谱检测方法法报道较多,但对于不同提取方式下不同基质中吡虫啉提取的影响,及不同净化方式对不同农产品的净化效果的系统研究鲜见报道。
本实验选取蔬菜中的黄瓜、谷物中的大米及茶叶3 种基质为研究对象,对直接用乙腈提取和加水后再用乙腈提取两种不同提取方式和SPE、QuEChERS两种净化方式进行深入讨论,拟建立吡虫啉农药残留的高效液相色谱检测方法。该方法可以为农产品中吡虫啉农药残留的监测提供一定的参考。
1 材料与方法
1.1 材料与试剂
茶叶、大米、黄瓜 市购。
吡虫啉标准品 农业部环境质量监督检验测试中心(天津);XBridge C18色谱柱(150 mm×4.6 mm,3.5 µm) 美国Waters公司;醋酸钠提取盐试剂包(6 g MgSO4、1.5 g NaOAc)、15 mL PSA/C18净化管(400 mg乙二胺-N-丙基硅烷(primary secondary amine,PSA)、400 mg C18、1 200 mg MgSO4)、WondaSep GC-e/PSA(500 mg,500 mg,6 mL) 岛津技迩(上海)商贸有限公司;乙腈、甲苯(均为色谱纯) 美国Fisher公司;氯化钠(分析纯) 西陇化工股份有限公司。
1.2 仪器与设备
2695高效液相色谱仪(配备2998二极管阵列检测器)美国Waters公司;AB204-S型电子天平 瑞士Mettler Toledo公司;SB-800DTD型超声波清洗器 宁波新芝生物科技股份有限公司;3-18K型冷冻离心机 德国Sigma公司;Milli-Q超纯水制备器 美国Millipore公司;涡旋混合器 德国IKA公司;N-EVAP-45型氮吹仪美国Organomation Associates公司。
1.3 方法
1.3.1 标准溶液的配制
取吡虫啉标准品(1 000 mg/L),使用前根据需要用乙腈-0.1%磷酸(1∶1,V/V)稀释至适当浓度的标准工作液,4 ℃避光保存。
1.3.2 样品前处理
1.3.2.1 SPE处理过程
提取:称取适量(精确到0.01 g)粉碎均匀的试样(黄瓜10 g、大米5 g、茶叶2 g),置于50 mL聚丙烯具塞离心管中,加入10 mL水(大米和茶叶加水,黄瓜不加水),涡旋混匀,加入乙腈20 mL,涡旋,超声提取30 min。加入5 g氯化钠,剧烈振荡,静置,离心,使乙腈和水分层,取乙腈层10 mL于15 mL离心管中,45 ℃氮吹浓缩至近干。加入2 mL乙腈-甲苯(3∶1,V/V)溶解残渣,待净化。
净化:分别用5 mL乙腈、5 mL乙腈-甲苯(3∶1,V/V)活化SPE柱,将上述样品提取液分别上样,上样开始用15 mL离心管收集淋洗液,再用2 mL乙腈-甲苯(3∶1,V/V)清洗装浓缩液的15 mL离心管(重复1 次),倒入SPE柱;剩余用约10 mL乙腈-甲苯(3∶1,V/V)淋洗,收集所有流出液,氮吹至近干,用1 mL乙腈-0.1%磷酸(1∶1,V/V)复溶,经0.22 μm有机相微孔滤膜过滤后上机测定。
1.3.2.2 QuEChERS处理过程
称取适量(精确到0.01 g)粉碎均匀的试样(黄瓜10 g、大米5 g、茶叶2 g),分别置于不同的50 mL聚丙烯具塞离心管中,加入10 mL水(大米和茶叶加水,黄瓜不加水),涡旋混匀,加入乙腈20 mL,涡旋,超声提取30 min。加入醋酸钠提取盐试剂包,剧烈摇匀后,超声提取20 min,离心,取上层提取液到15 mL PSA/C18净化管中,充分摇匀后离心。取上清液10 mL于15 mL离心管中,45 ℃氮吹浓缩至近干。用1 mL乙腈-0.1%磷酸(1∶1,V/V)复溶,经0.22 μm有机相微孔滤膜过滤后上机测定。
1.3.3 模拟阳性样品的制作
大米模拟阳性样品的制作方法:把一定浓度的吡虫啉标准溶液加入一定量的大米中,充分混匀,然后使溶剂全部挥发,放置7 d,粉碎均匀,过20 目筛,混匀,得到添加量约1 mg/kg的模拟阳性样品。
黄瓜和茶叶的阳性样品:均购自于超市,经检测是阳性样品。
1.3.4 高效液相色谱条件
XBridge C18色谱柱(150 mm×4.6 mm,3.5 µm);流动相:0.1%磷酸(A)和乙腈(B)。梯度洗脱程序:0~5 min,85%~80% A;5~15 min,80%~75% A;15~16 min,75%~5% A;16~20 min,5% A;20~21 min,5%~85% A;21~25 min,85% A;检测波长:270 nm;流速:0.8 mL/min。柱温:35 ℃;进样量:10 µL。
1.4 数据处理
通过与仪器配套的Empower 3色谱数据处理系统完成数据采集与处理,以及Origin 8.0进行绘图。
2 结果与分析
2.1 前处理条件的优化
2.1.1 样品提取条件的优化
2.1.1.1 加水提取和不加水提取的比较

图1 提取方式对阳性样品吡虫啉提取效果的影响Fig. 1 Effect of different extraction methods on imidacloprid content in positive samples
农产品中吡虫啉的残留分析常用的提取溶剂有乙腈、丙酮、二氯甲烷、乙酸乙酯、石油醚、甲醇等。由于乙腈的提取效率高,提取杂质少,有利于后续盐析和净化,操作简便,因此采用乙腈作为提取溶剂[13]。为验证不同提取条件对吡虫啉提取的影响,实验采用SPE净化方式,分别考察直接用乙腈提取和加水后再用乙腈提取对黄瓜、大米、茶叶阳性样品提取效果见图1;对阴性样品和阳性样品回收率的影响见图2。
由图1可见,对于阳性样品,大米、茶叶中吡虫啉的含量,加水提取是未加水提取的数倍;而黄瓜加水提取和不加水提取几乎无差异。原因可能是一方面大米和茶叶为干性样品,加水后能使其充分浸润,提取溶剂与样品能够充分接触;另一方面吡虫啉极性比较大,水的极性和渗透性强于乙腈和甲醇,加水后减弱了农药与基质之间的相互作用,所以加水后大米和茶叶中吡虫啉更容易被溶剂提取。而蔬类的黄瓜样品本身含有大量的水,所以直接用乙腈提取和加水后再用乙腈提取结果差异很小。

图2 提取方式对吡虫啉回收率的影响Fig. 2 Effect of different extraction methods on imidacloprid recovery
由图2可见,对于阳性样品和阴性样品,加水提取和不加水提取,不同农产品吡虫啉的回收率均不存在明显的差异,可能是由于加标时加入的吡虫啉为游离状态,即使不加水提取,也能够比较容易的被乙腈萃取,导致两种提取方式回收率都正常。
以上实验结果表明,不同基质的试样,虽然加水提取和不加水提取的回收率均正常,但是对于大米、茶叶等干性样品存在提取不完全的问题。所以实验选择黄瓜用乙腈直接提取,大米和茶叶加水后再用乙腈提取。
2.1.1.2 加水量的选择
如图3所示,采用SPE净化方式,当加水量2 mL和5 mL时,茶叶和大米样品不能完全浸润,但随着加水量的增加,检测结果变化很小。因此实验选择最终加水量为10 mL。
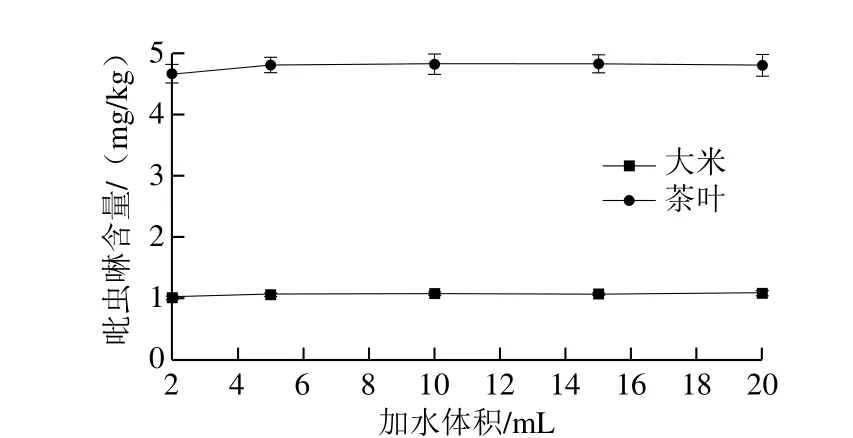
图3 加水体积对吡虫啉提取效果的影响Fig. 3 Effect of water added to agricultural products on the extraction efficiency of imidacloprid
2.1.1.3 浸泡时间的选择
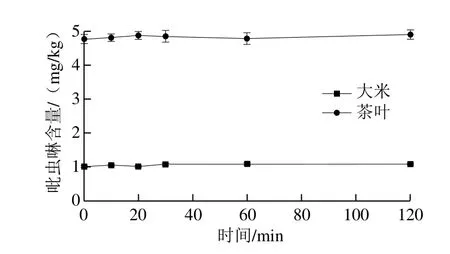
图4 加水浸泡时间对吡虫啉提取效果的影响Fig. 4 Effect of soaking time on the extraction efficiency of imidacloprid
图4 表明:加水浸泡时间对大米、茶叶阳性样品提取率和阴性样品回收率的影响差异很小,而且随着浸泡时间的延长,提取出的干扰成分增多,不利于后续过程中目标物的净化和分离。因此,实验选择不浸泡。
2.1.2 样品净化方式选择
农产品种类繁多,基质比较复杂。比如蔬菜中存在的酚类、色素、有机酸、油脂、甾类、烯烃类等干扰物;茶叶中含有的大量色素、有机酸、茶多酚等物质。农产品中吡虫啉的残留分析中常用的净化方式有SPE和QuEChERS。吡虫啉农药残留分析的SPE净化方法中Carb-NH2[19-20]、Carb-PSA[14-15]两种小柱净化效果比较好。因为活性碳小柱能够有效去除色素,PSA、氨基(NH2)主要用于去除有机酸、脂肪酸、糖类及部分色素。但是两者相比,PSA有两个氨基,更能有效去除干扰,所以实验选用WondaSep GC-e/PSA小柱。而QuEChERS与传统方法相比,具有分析对象范围广、基质适用范围广、稳定性好、低成本、操作简单快捷等优点[29]。为验证这两种净化方式对吡虫啉净化效果的影响,实验采用黄瓜、大米、茶叶阳性样品按照1.3.2节方法进行实验,结果见图5。
由图5可见,大米基质简单,两种净化方式净化效果都比较好。对于黄瓜基质,QuEChERS净化方式杂峰较多,提取液色素不能被完全除去,净化效果不理想;虽然QuEChERS也能够实现目标物与杂质的分离,但SPE净化方式明显优于QuEChERS。而茶叶基质更复杂,采用QuEChERS净化方式时,茶叶中的脂肪酸、有机酸和极性色素等干扰基质不能被有效除去。采用SPE净化方式时,茶叶提取液无色透明,能够有效去除干扰基质,实现目标物与杂质的完全分离,达到净化目的。所以对于基质复杂的农产品优先选用SPE净化方式,而基质简单的样品QuEChERS与SPE净化效果差别不大。
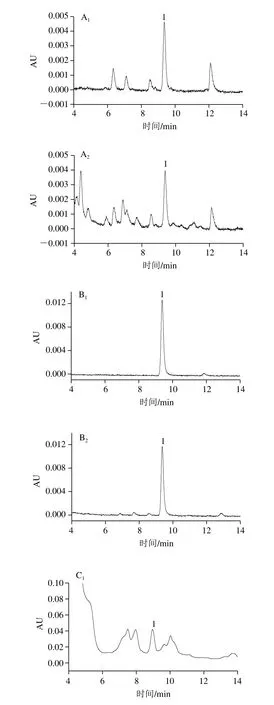
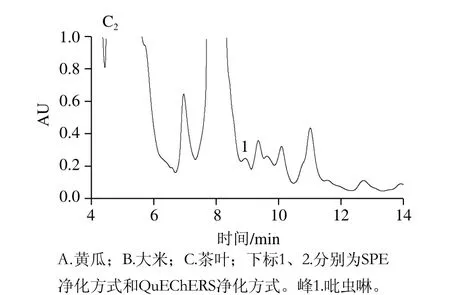
图5 不同净化方式对阳性样品吡虫啉净化效果的影响Fig. 5 Comparison of different methods for the purification of imidacloprid
2.2 色谱条件的优化
实验比较Symmetry Shield C18、Xbrige C18、Atlantis T3三种色谱柱对分离效果的影响。结果发现相同的流动相条件下吡虫啉在Xbrige C18色谱柱的分离时间较Atlantis T3短,峰形优于Symmetry Shield C18。在等度分离时,由于农产品基质的复杂性,不易实现目标物与杂质的分离,而且容易干扰后续测定,所以实验采用梯度分离。
本实验比较文献中几种不同常用体系的流动相:甲醇和水、乙腈和水、甲醇和0.1%磷酸、乙腈和0.1%磷酸。结果表明:乙腈和0.1%磷酸分离效果和峰形最佳。
2.3 方法学评价
2.3.1 线性范围、检出限和定量限
将标准储备液用乙腈-0.1%磷酸(1∶1,V/V)逐级稀释得质量浓度为0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0 µg/mL的系列标准工作溶液。将系列标准工作溶液按质量浓度从低到高的顺序,按1.3.4节条件进行测定,以吡虫啉峰面积(Y)对质量浓度(X)作标准曲线。采用空白基质加标的方法,以信噪比为10得到目标物的定量限,以信噪比为3得到目标物的检出限,结果见表1。吡虫啉在0.05~10.0 µg/mL之间线性关系良好,线性回归方程为:Y=9.31×104X+3.87×103,R2=0.999。
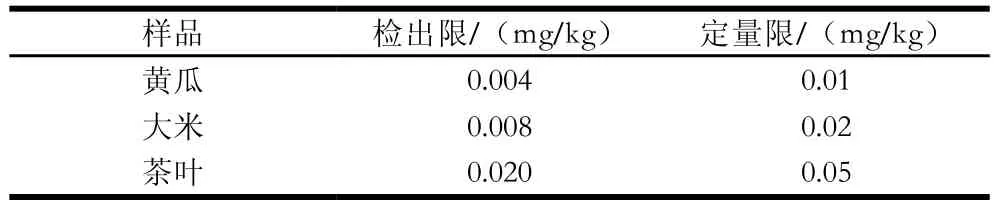
表1 黄瓜、大米、茶叶3 种样品的检出限与定量限Table 1 Limits of detection and limits of quantitation for cucumber, rice and tea
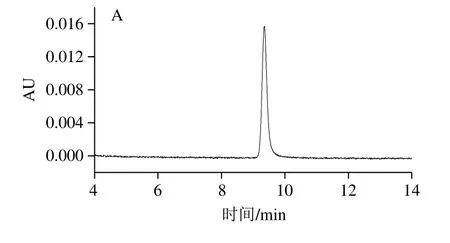
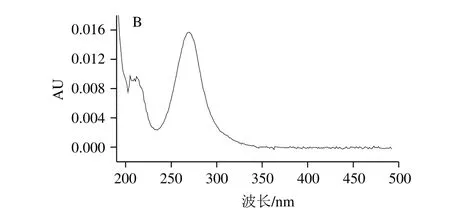
图6 吡虫啉标准溶液(2.0 μg/mL)的高效液相色谱(A)和光谱(B)图Fig. 6 HPLC chromatogram (A) and spectrum (B) of imidacloprid standard solution
2.3.2 回收率和精密度实验结果
实验采取阴性样品中添加0.05、0.1 mg/kg和1.0 mg/kg进行加标回收实验,每个水平平行测定6 次,得到方法的回收率及精密度,见表2。结果显示,3 个水平的加标回收率在88.3%~109.1%之间,相对标准偏差在1.9%~3.5%之间。
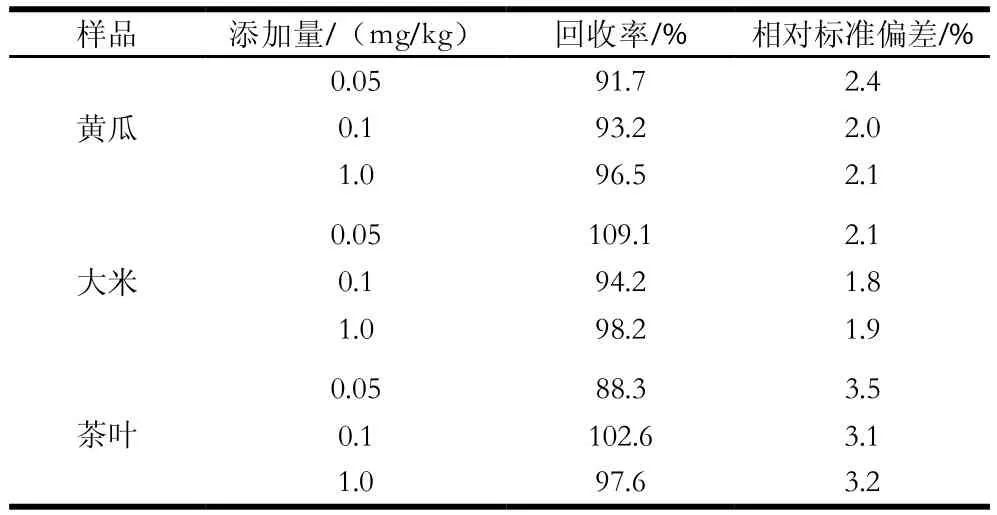
表2 黄瓜、大米、茶叶3 种样品的回收率及精密度(n= 6)Table 2 Recoveries and precision (RSD) for spiked cucumber,rice and tea (n= 6)
2.4 实际样品的测定结果
应用本方法对市售的黄瓜、大米、茶叶各40 批次样品进行分析,吡虫啉残留量检测结果为:黄瓜有1 批次样品检出,含量为0.171 mg/kg,低于GB 2763—2016中规定的限量要求;大米均未检出;茶叶有6 批次样品检出,其中5 批次含量为0.102~0.425 mg/kg,1 批次高于GB 2763—2016的限量要求,含量为4.811 mg/kg。
3 结 论
本实验建立了农产品中吡虫啉农药残留的高效液相色谱检测方法。结果表明:加水和不加水两种不同的提取方式,对于含水量较高的蔬菜,结果无差异;而对于谷类、茶叶等干性样品,结果差异比较大,加水量和浸泡时间对结果影响很小。对于基质复杂的农产品SPE净化效果明显优于QuEChERS,而基质简单的农产品二者差别很小。本实验可为农产品中吡虫啉农药残留测定方法的建立提供技术支持。
