可视化LAMP检测常见肉制品中猪肉成分
2019-07-05康怀彬王德国
朱 凯,康怀彬,王德国
(1.河南科技大学食品与生物工程学院,河南 洛阳 471000;2.许昌学院食品与生物工程学院,河南 许昌 461000)
食品安全问题一直是制约肉制品行业乃至食品行业快速稳定发展的一大难题。一般而言,肉类食品安全问题分为两种,第1种是天然存在的,如大肠杆菌[1]、阪崎克罗诺杆菌[2]、副溶血性弧菌[3]等微生物污染,第2种是人为制造的,如兽药残留[4]、肉类掺杂掺假[5]等。其中肉类掺杂掺假给我国食品行业带来了十分恶劣的影响,其主要表现症状为以次充好,因此发展实用的肉类掺假检测方法是大势所趋、而快速、低成本的检测方法不仅受到商业化市场的青睐,在进出口肉制品检测、市场抽查、中小型肉制品企业生产也有较大发展空间。
现有的肉类掺假检测方法主要分为传统方法和现代技术分析两大类。传统方法鉴别肉品质主要依赖于感官判断和形态学检验[6],其局限性较大,多用于个人、家庭、肉制品商店等小规模鉴别。现代技术分析多以特征性的脂肪、蛋白质、核酸作为靶标物进行肉类掺假检验[7],当前主要分析手段有红外光谱分析、色谱分析、核磁共振法、质谱分析、免疫分析和核酸分析等[8]。环介导等温扩增(loop-mediated isothermal amplification,LAMP)法属于核酸分析法,此技术是由Notomi等[9]发明,相比于传统聚合酶链式反应(polymerase chain reaction,PCR)技术,具有特异性更强、灵敏度更高等的优点,目前广泛运用于医学、植物学、食品学、动物科学等领域,受到国内外专家学者及市场的认可。LAMP法检测掺假肉的研究中,现已开发出多种肉类的不同改良的LAMP检测方法,已有报道研究[10-12]对马肉、牛肉、牛羊肉成分的掺假进行了LAMP检测;杨丽霞等[13]建立了鸡、鸭源性成分的LAMP可视化检测方法;徐淑菲等[14]建立了牛源性成分荧光LAMP检测方法;刘少宁等[15]建立了鉴别绵羊肉中狐狸源性成分的LAMP检测方法。以上实验均证明了LAMP检测法在肉类检测上的可靠性。
猪肉在我国肉制品中占据主要地位,我国是世界上最大的猪肉生产国和消费国。近年来猪肉价格持续走低[16],使得猪肉掺假的成本越来越低,不法商贩往往将廉价的猪肉掺入到牛肉、羊肉、驴肉等价格较高的肉类中,以次充好。部分专家学者采用LAMP检测法检测猪肉成分的研究,如Lee等[17]针对线粒体D环基因和18S rRNA基因设计特异性猪引物,通过便携式实时荧光检测器检测结果,建立了加工肉中猪肉成分检测的实时荧光LAMP法,优点是实验时间短、可用于现场及时检测;Roy等[18]将LAMP技术与磁珠技术相结合,LAMP扩增产生大量DNA与磁性物质结合形成聚集体,其表现为在纸上形成肉眼可见的黑点,以达到可视化的目的,成功建立检测鸡、猪肉成分掺假的可视化LAMP法,其优点是可视化、对仪器需求低;Ran Guangyao等[19]以钙黄绿素为染料,建立了检测猪肉成分可视化LAMP检测方法;杨丽霞等[20]针对猪肉线粒体DNA COXI基因设计LAMP引物,加入荧光染料SYBR Green I,建立了检测牛羊肉中猪肉成分的实时荧光LAMP法;李向丽等[21]针对猪、鸭、羊的Cytb基因设计特异性引物,自主研发恒温荧光检测仪,以SYTO-9为染料,建立了猪、鸭、羊源成分的检测恒温实时荧光LAMP法。本实验以间苯二酚钠盐为指示剂,目的是建立更简单、更实用的可视化LAMP猪肉检测方法。
1 材料与方法
1.1 材料与试剂
猪肉、牛肉、羊肉均购于河南省许昌市农贸市场,驴肉、马肉购于淘宝,鸡肉、鸭肉及其他猪肉制品购于许昌美高美超市。
Buffer缓冲液、BstDNA聚合酶(10 000 U/mL)New England Biolab(北京)有限公司;dNTP(浓度10 mmol/L) 生工生物工程(上海)股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 美国Amresco公司;DEPC水 上海翊圣生物科技有限公司;TE缓冲液(pH 8.0) 武汉百浩天生物科技有限公司;SYBR Green I 北京索莱宝科技有限公司;SYBR qPCR Mix 日本东洋纺公司。
指示剂配制(10 mmol/L):称取0.002 371 g的4-(2-吡啶偶氮)-间苯二酚钠盐于离心管中,加入1 mL DMSO溶解,并混匀。
1.2 仪器与设备
水浴锅(实验室定制) 河南康鸿生物科技有限公司;SCO-3201A数控定时超声波清洗机 上海声彦超声波仪器有限公司;BCD-215KAJ冰箱 青岛海尔股份有限公司;1-14K高速离心机 德国Sigma公司;Step one plus实时荧光定量PCR仪 美国ABI公司;FA2004B电子天平 上海佑科仪器仪表有限公司;NanoDrop One微量核酸蛋白测定仪 美国Thermo公司。
1.3 方法
1.3.1 LAMP引物设计与配制
根据GenBank数据库猪源基因,选取保守序列线粒体细胞b(GenBank: X56295.1)通过BLAST在线比对软件进行分析,选取保守性和特异性都较好的片段,利用Primer Explorer Version 5在线设计软件设计一套LAMP引物,如表1所示,交由安徽通用生物公司合成,所有引物均用TE缓冲液(pH 8.0)稀释至100 μmol/L,按体积比FIP(BIP)∶LF(LB)∶F3(B3)为8∶4∶1混合均匀,作为最终引物混合液。
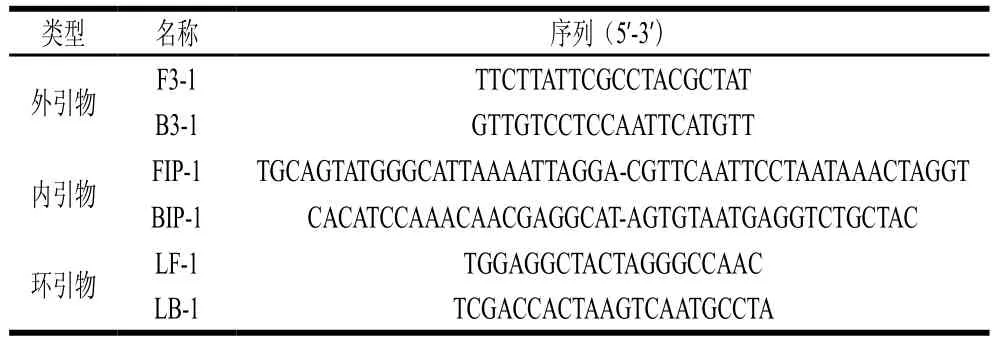
表1 猪引物序列Table 1 Primer sequences used for amplification of the porcine mitochondrial cytochrome b gene
1.3.2 DNA制备
1.3.2.1 线粒体提取
选择使用试剂盒提取猪线粒体DNA,稍加改良。将不超过500 mg肌肉组织剪成小块,加入1 mL磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.9)洗涤并用滤纸吸干,然后加入1 mL溶液I,冰浴研磨50 次;将研磨好的混合物移至离心管中4 ℃、1 000×g离心5 min,取上清液移至新离心管;将上清液4 ℃、12 000×g离心10 min,再弃上清液,留下白色沉淀;向白色沉淀中加入0.5 mL溶液I,剧烈摇晃使沉淀溶于液体,后4 ℃、1 000×g离心5 min;取上清液至新离心管,4 ℃、12 000×g离心10 min,再弃上清液,留下白色沉淀就是线粒体。
1.3.2.2 线粒体纯化
向含有线粒体的离心管中加入190 μL buffer LC,10 μL蛋白酶K,充分混匀;加入200 μL buffer CQ到裂解液中,混匀;加入200 μL无水乙醇,充分混匀;取全部混合液加入到DNA纯化柱,室温放置2 min,10 000 r/min离心1 min,弃收集的废液;向纯化柱加入300 μL buffer WB,10 000 r/min离心1 min,再次弃废液;加400 μL buffer WB到DNA纯化柱,14 000 r/min离心2.5 min,弃废液;将DNA纯化柱放入新管,悬空滴加80 μL buffer EB到柱膜上,室温温育5 min,10 000 r/min离心1 min;重复上一步骤,buffer EB添加量从80 μL变为50 μL,收集的液体即为线粒体DNA提取液,即可直接用于实验。
1.3.2.3 简化DNA提取步骤
将不超过500 mg肌肉组织剪成小块,加入1 mL PBS(pH 7.9)洗涤并用滤纸吸干;加入1 mL TE缓冲液(pH 8.0),冰浴研磨50 次;将研磨好的混合物移至离心管中4 ℃、1 000×g离心5 min,取上清液移至新离心管;将上清液4 ℃、12 000×g离心10 min,再弃上清液,留下白色沉淀;向白色沉淀中加入0.5 mL TE缓冲液(pH 8.0),剧烈摇晃使沉淀溶于液体,后4 ℃、1 000×g离心5 min;取上清液至新离心管,4 ℃、12 000×g离心10 min,再弃上清液;加入50~100 μL TE缓冲液(pH 8.0),剧烈振荡使沉淀溶于液体;超声波振荡6 min,充分破碎线粒体使线粒体DNA释放出来,此提取液即可直接用于LAMP实验。
1.3.3 模拟样品的制备
向其他肉类按比例添加猪肉,制造掺假模拟样品,因受到电子天平精度(0.000 1 g)限制,最低可制造掺假比0.1%的掺假样品;用核酸蛋白测定仪对1.3.2.3节纯化后的纯猪肉线粒体DNA模板溶液进行测定,确定浓度并按照一定比例进行稀释,稀释液为TE(pH 8)缓冲液,制成模板浓度为100、10、1 pg模板溶液。将上述提取的掺假样品和模板溶液于-20 ℃保存。
1.3.4 LAMP猪肉成分检测体系优化
将增强剂、混合引物、buffer、dNTP、Mg2+、Mn2+、指示剂、BstDNA聚合酶、DEPC水、模板DNA于冰浴条件下依次加入到1.5 mL EP管中,混合均匀,放入水浴锅反应1 h。待反应结束后于白色背景下观察颜色变化,若结果为橘红色则说明DNA未扩增,为阴性结果;若结果为明黄色则说明DNA已扩增,为阳性结果。
1.3.4.1 LAMP温度优化
根据预实验结果,调整实验温度,若预实验的阴性对照和阳性对照均发生变色反应则提高反应温度,若阴性、阳性对照均未发生变色反应则降低温度,若阴性对照不变色,阳性对照变色则说明此温度较为合适,上下调整温度选择无假阳性,反应较快的温度为最适反应温度。
1.3.4.2 LAMP体系优化
根据预实验结果,参考1.3.4.1节的方法,对LAMP体系进行优化,间苯二酚钠盐和Mn2+结合作为指示剂,其配方较为固定,只需要对Mg2+浓度进行优化,观察不同Mg2+浓度下空白实验、阳性对照结果,选择无假阳性、反应较快的一组Mg2+为最适Mg2+浓度。
1.3.5 LAMP特异性实验
为验证该引物的特异性是否能区分不同肉类,按1.3.2节方法提取牛、羊、鸡、鸭、马、驴等其他肉类线粒体DNA,以优化好的体系配制反应液,加入不同肉的模板DNA,两两对照,在最适温度下反应1 h,观察颜色变化。最后用该引物进行荧光定量LAMP实验,通过分析扩增曲线和熔解曲线进一步确定特异性。
1.3.6 LAMP灵敏度实验
为验证该方法的最低检测限,用不同比例的掺假样品和不同浓度的模板溶液进行灵敏度实验,以优化好的体系配制反应液,按猪肉线粒体DNA含量从高到低依次排序,在最适温度下反应1 h,观察颜色变化,以能稳定变色的该组检测限为最低检测限。由于样品新鲜度、研磨是否充分、人为因素误差等会对DNA提取效果产生一定的影响,因此,多次提取DNA并重复灵敏度实验,确保该实验结果准确可靠。
1.3.7 LAMP适应性、稳定性实验
从最常见的猪肉制品中提取线粒体DNA,于优化体系下反应60 min,观测反应结果,判断该实验方法的适应性。重提DNA、重配试剂,并在不同时间、多次重复该实验,观察是否有假阳性出现,测定该体系的稳定性。
1.3.8 其他方法比较验证
1.3.8.1 实时荧光定量LAMP
为验证可视化LAMP的可靠性,同时进行实时荧光定量LAMP实验,引物同可视化LAMP引物,体系稍作改变,将Mn2+、间苯二酚钠盐改为SYBR Green I,每20 μL反应体系中加入0.2 μL(50×),用DEPC水补足体系,反应温度同可视化LAMP最佳反应温度,设置120 个循环,每个循环30 s,即总反应时间为1 h,观察扩增曲线。
1.3.8.2 实时荧光定量PCR[22]
为进一步验证可视化LAMP的可靠性,同时还进行实时荧光定量PCR实验,以LAMP反应的两条外引物(F3、B3)为荧光PCR的引物,按照THUNDERBIRD SYBR qPCR Mix说明书配制反应体系,观察扩增曲线和熔解曲线。
qPCR条件:95 ℃预变性1 min,95 ℃变性15 s,60 ℃退火25 s,72 ℃延伸1 min,40 个循环;熔解曲线从60 ℃开始,速率为1.5%。
2 结果与分析
2.1 不同线粒体DNA提取方法对比

图1 不同提取方式提取猪线粒体DNA的LAMP实验Fig. 1 Comparison of pig mitochondrial DNAs extracted by different extraction methods
如图1所示,不同提取方法提取DNA的LAMP实验结果均为明黄色,简化后的猪线粒体DNA提取方法实际LAMP效果与试剂盒法相似,提取时间仅为原来的一半,且试剂更为安全,此后实验均用简化后的DNA提取法。
2.2 预实验结果
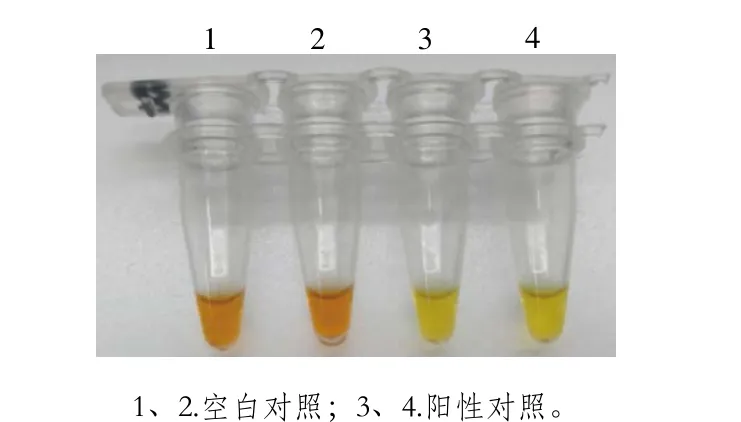
图2 预实验结果Fig. 2 Pretest results
如图2所示,反应60 min后空白对照未变色呈橘红色,阳性对照完全变色,呈明黄色。
2.3 LAMP温度优化实验结果
如图3所示,在56 ℃时,作为空白对照的1变为明黄色,出现假阳性,不是最适温度。57 、58 ℃在60 min均为空白对照全不变色、阳性对照全部变色,结果均符合实验要求,因此选择反应时间较短的57 ℃为最适反应温度。

图3 温度优化实验Fig. 3 Temperature optimization
2.4 LAMP体系优化实验结果

图4 Mg2+优化实验Fig. 4 Optimization of Mg2+ concentration
如图4所示,LAMP反应60 min后,仅Mg2+浓度3 mmol/L的未变色,出现假阴性结果,而Mg2+浓度3、3.5、4、4.5、5 mmol/L均为空白对照不变色、阳性样品全部变色。Mg2+是较为重要的试剂之一,反应过程中起到降低反应所需要的活化能的作用,较高时容易出现假阳性,较少时混合溶液颜色偏淡难以区分,Mg2+浓度4 mmol/L变色时间较3.5 mmol/L组少10 min且颜色对比更明显。因此选择Mg2+较少、对比明显、反应时间较短,即Mg2+浓度4 mmol/L为最适Mg2+浓度。
综上,LAMP猪肉成分检测最优体系如表2所示。
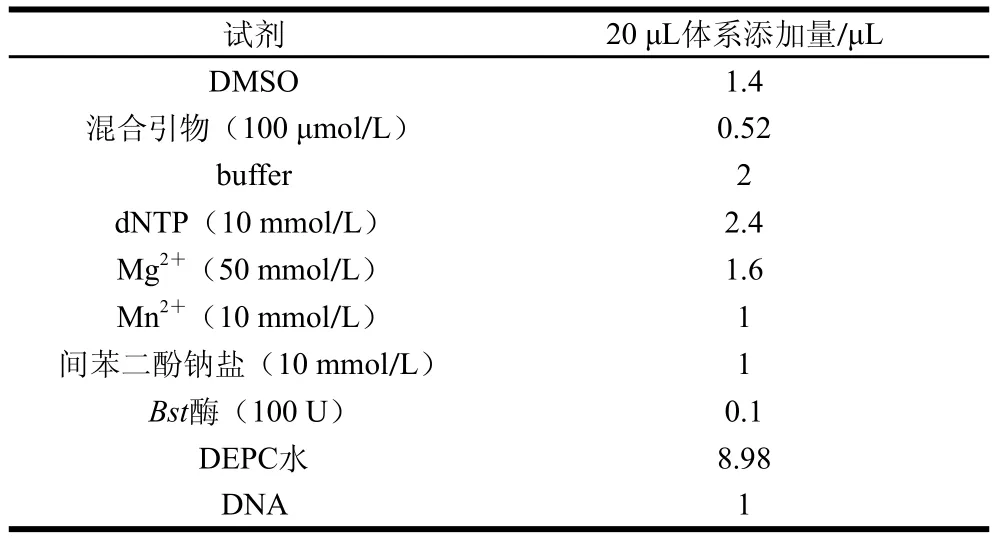
表2 LAMP反应最优体系Table 2 Optimal system of LAMP reaction
2.5 LAMP特异性实验结果

图5 LAMP特异性实验Fig. 5 Specificity evaluation of LAMP
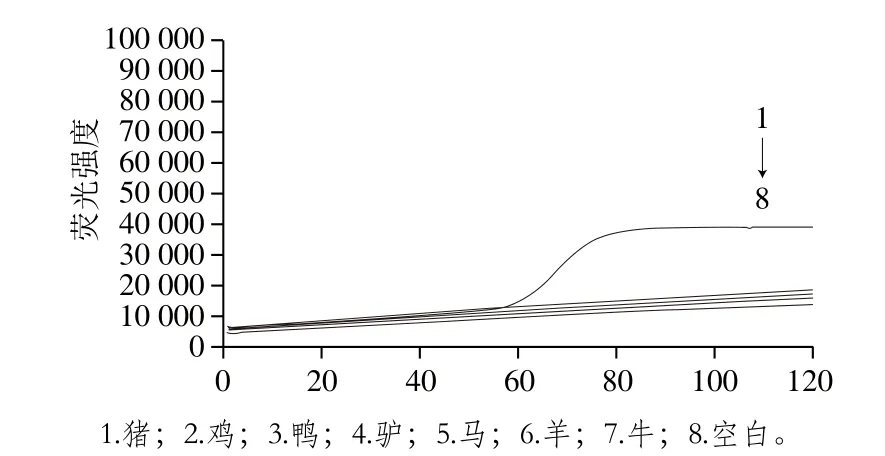
图6 实时荧光定量LAMP特异性实验Fig. 6 Results of real-time fluorescent quantitative LAMP detection
如图5、6所示,LAMP反应60 min后,只有加入猪DNA的1和2变色,而空白对照15、16以及阴性对照3~14均不变色,且荧光定量LAMP实验表明,仅加入猪DNA的1有明显的扩增曲线,其他组均未出现,说明该引物特异性良好,实验能有效区分猪DNA与其他DNA,不受其他动物线粒体DNA的干扰。
2.6 LAMP灵敏度实验结果

图7 模拟样品猪LAMP灵敏度实验Fig. 7 Sensitivity of LAMP to model porcine samples
模拟样品的灵敏度实验结果见图7,在57 ℃反应60 min后,1~4均为明黄色,呈阳性结果,而5~6为橘红色为阴性结果;不同模板DNA浓度的灵敏度实验结果见图8,57 ℃水浴加热60 min后,2、3、4均变色且变色明显,1、6、7、8完全不变,5微变,说明该方法可以有效检测DNA质量浓度10 pg/μL以上掺假样品,检测1 pg/μL则不稳定,难以检测DNA质量浓度在1 pg/μL以下的样品。因此,此方法能检测猪肉含量1%及其以上的样品,灵敏度为10 pg/μL。
2.7 LAMP稳定性、适应性实验结果

图9 猪肉制品LAMP实验Fig. 9 Detection of pork products by LAMP
猪肉制品LAMP实验结果见图9,含猪肉制品的各类反应均显示阳性结果,证实该方法能有效检测常见状态的猪肉成分。经过长时间、多次实验,在60 min的实验时间内,该体系能且只能对猪线粒体DNA进行扩增,对其他常见各种肉类均无扩增,且实验过程中未出现假阳性,表明该LAMP法稳定性良好。
2.8 其他方法比较验证
由图10可知,当实验进行到45 个循环(即22.5 min)时,阳性组开始扩增,到75 个循环(即37.5 min)达到扩增峰值,随后进入平台期,阴性实验组在120 个循环内均未出现明显的扩增,反应曲线平缓,未出现峰值。
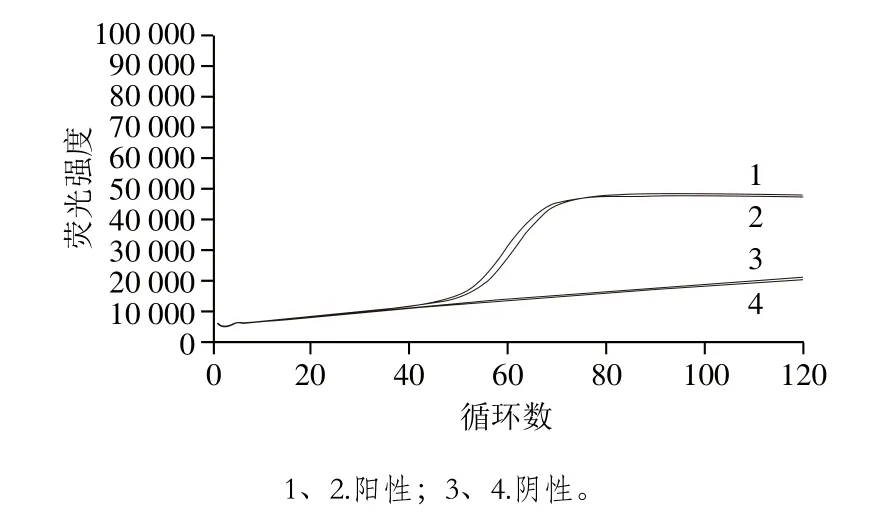
图10 实时荧光定量LAMP扩增曲线Fig. 10 Real time fluorescence quantitative LAMP amplification curves
2.9 实时荧光定量PCR分析
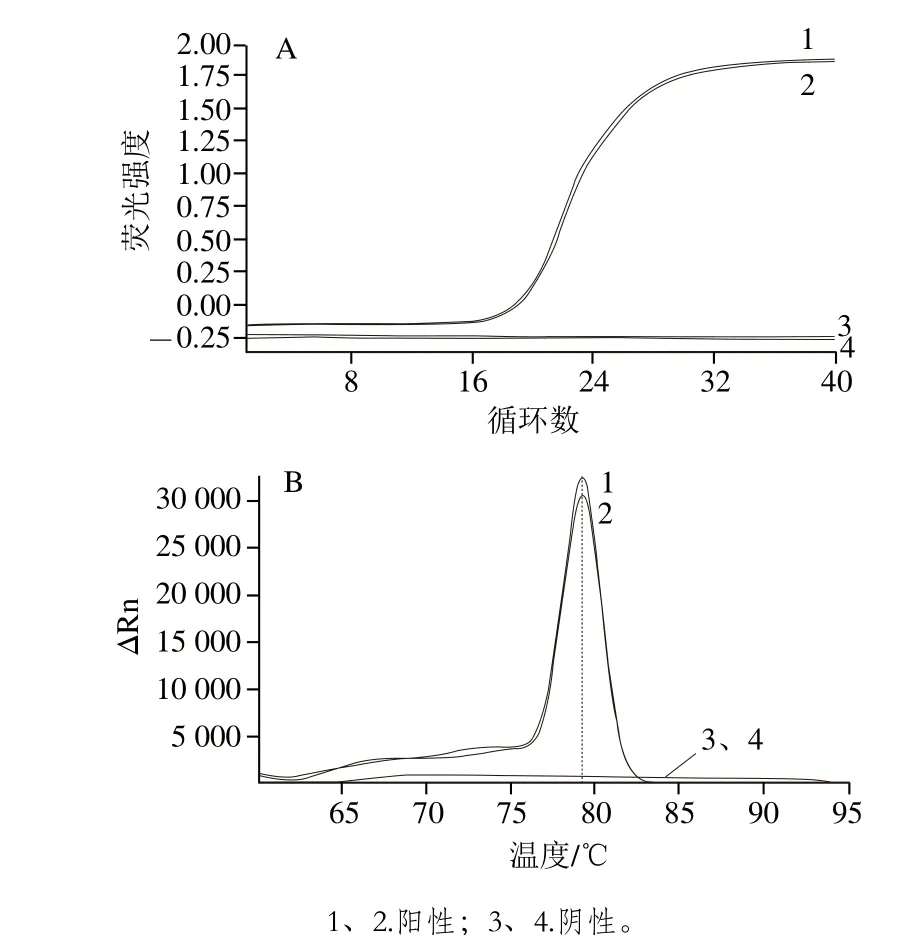
图11 实时荧光定量PCR扩增曲线(A)和熔解曲线(B)Fig. 11 Real-time fluorescence quantitative PCR amplification curve (A) and melting curve (B)
如图11所示,阳性实验组在40 个循环内完成扩增,熔解曲线Tm为79.25 ℃,与阴性实验组对比明显,阴性实验组未扩增,且无Tm值,进一步证明了引物特异性良好。
3 讨 论
提取DNA的方法有很多,如磁珠法、离心柱法、苯酚氯仿抽提法、CTAB法、差速离心法等,不同提取方法优缺点较为明显,在实际使用时实验人员往往根据实验室条件进行改良[23-25],如刘昊等[26]在检测开心果过敏原成分中提DNA用改良后的CTAB法提DNA,本实验前期所用为商品化的试剂盒法,其原理是先通过差速离心提取目的基因,后用离心柱法进行纯化,其优点是安全、所提DNA纯度较高,常用于PCR实验,缺点是较为繁琐、耗时较长、成本较高,LAMP技术较PCR技术等常规其他核酸扩增技术特异性更强,大量文献表明LAMP实验只需要几十个拷贝甚至几拷贝模板即可扩增[27-29],在实际实验过程中LAMP无需高纯度的模板DNA,本实验将提取过程简化改良,原理是用差速离心法提取线粒体,而后通过超声振荡破碎线粒体直接释放目的基因,此方法提取出来的DNA可在4 ℃稳定保存1 d,-20 ℃稳定保存7 d,如需长时间保存,依然需要用步骤1.3.2.1节和1.3.2.2节方法(即试剂盒法)提取DNA并于-20 ℃保存。
本实验1.3.2.3节所提线粒体DNA未经过纯化,因此用于检测模拟掺假样品的检测限仅有1%,相较Shi Ya等[30]建立的LAMP鸭源掺假检测方法低一个数量级,但考虑到实际应用方面,低于1%的掺假率难以产生经济价值,因此1%已满足现场快速定性检测,若需要更低的检测限,可用步骤1.3.2.1节和1.3.2.2节提取纯化样品DNA,本方法用纯化提取的DNA灵敏度为10 pg/μL,优于Taqman探针实时荧光PCR检测方法[31](0.5 ng/μL)、实时荧光PCR法[32](0.5 ng/μL)。
快速、冰浴、充分研磨是保证提取线粒体DNA成功的关键要素,其中最为关键的是充分研磨,在掺假率较低时(1%),未能充分研磨很可能导致猪肌肉组织中的线粒体无法充分释放,从而导致提取量少,产生假阴性。
自Notomi等[9]发明LAMP检测技术到如今已有近20年的发展,最初通常以检测焦磷酸镁沉淀或凝胶电泳检测扩增基因判断结果,然而焦磷酸镁沉淀难以肉眼观测因此随后发明了实时浊度仪用于检测扩增,实时浊度仪用途狭窄、价格昂贵不利于推广;而凝胶电泳耗时长且必须开盖容易污染产生假阳性,因此部分学者开发出加入染料通过变色反应来检测基因是否扩增,此方法具有低成本、耗时短、不易受到污染等优点,目前常用的染料有 SYBR Green I[33]、钙黄绿素[34]、叠氮溴化丙锭[35]以及羟基萘酚蓝等,然而以上染料也有明显的缺点限制,例如SYBR Green I是荧光染料,需要在特殊环境下进行观察结果,而且这些都有较大的毒性,处理不慎容易对人体造成损害或是污染环境,4-(2-吡啶偶氮)间苯二酚钠盐是一种金属离子显色剂,本实验以间苯二酚钠盐为染料,与Mn2+螯合作为LAMP实验的指示剂,可与LAMP反应产物焦磷酸根反应,从原来的橘红色变为明黄色,此染料具有颜色变化明显,易于保存,毒性相较更低且价格低廉等优点,在实际使用中较其他染料有明显优势。
目前从事LAMP研究的专家学者除了研究对象的创新外,其主要创新点为检测结果方法的改良,LAMP扩增的直接表现为焦磷酸根和目的基因的大量扩增,二者都无法通过肉眼直接观测,如今一类方法通过观察焦磷酸根的变化量判断LAMP反应是否发生,如实时浊度仪等;另一类通过观察目的基因是否扩增,如凝胶电泳、加入荧光染料等,目前这两类改良研究颇多、较为成熟,然而目前针对LAMP技术的前处理方面研究较少,LAMP技术在食品检测方面的实际应用一大难点是前处理复杂,目的微生物的培养和模板基因的提取存在提取时间长、纯化步骤复杂、试剂毒性大等缺点,此类问题的出现并非LAMP技术本身的问题,而是因为现有的基因提取纯化技术起初是针对PCR技术设计的,PCR对提取液纯度要求较高,众所周知,LAMP技术相较于PCR技术最大的优点是灵敏度更高、特异性更强,本实验证明了LAMP不需要过于复杂的DNA提取纯化方法,纯度不高的提取液依然可以用于LAMP实验。简化后的提取方法有效缩短整体实验时间,提高了效率。可应用于本实验建立起的猪肉成分LAMP检测法,至于是否通用于其他LAMP检测实验还待进一步研究。
4 结 论
本实验建立了检测常见肉制品中猪肉成分的可视化LAMP检测方法,并针对该方法进行了模板基因提取方法的简化,极大地简化了实验过程,降低了实验时间和条件,灵敏度为10 pg/μL,避免了常规LAMP法易出现假阳性的问题。进一步降低了成本,缩短了实验时间,简化实验条件。猪肉成分掺假检测中,从提取DNA到观测结果时间最短为2 h,并且重复性和稳定性效果良好,相较于其他猪肉检测方法具有成本更低、操作更简单、特异性强、灵敏度高等优点,相较于其他LAMP检测法具有可视化、不易污染、基因提取方便的特点,适用于多种常见肉制品猪肉掺假快速检测。
