益生菌发酵猕猴桃汁工艺优化及香气成分动态解析
2019-07-05罗心欣成雨阳王周利岳田利袁亚宏
罗心欣,成雨阳,王周利,岳田利,蔡 瑞,袁亚宏*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
现今越来越多的消费者追求低脂、低糖、低胆固醇的健康饮食,益生菌发酵果蔬汁逐渐成为大众喜爱的新型功能性健康食品。以非乳原料作为益生菌载体不但健康低脂,且为乳糖不耐受人群摄入益生菌提供了新途径。开发新的非乳原料作为益生菌载体是功能性食品的发展趋势。益生菌,活菌数在106CFU/mL以上能够抑制致病菌的生长,维持人体肠道菌群平衡,主要应用于乳制品、乳饮料等产品中[1]。目前应用于功能保健性食品中的益生菌主要包括双歧杆菌和乳杆菌类乳酸菌群[2]。猕猴桃营养丰富,深受人们喜爱,但采后不易贮藏,利用乳酸发酵既能延长贮藏期,减少经济损失,又能赋予产品丰富的风味,且对人体有益。
有关果蔬汁发酵的研究主要在工艺优化方面。李维妮等[3]以动物双歧杆菌、副干酪乳杆菌、嗜酸乳杆菌、嗜热链球菌共同发酵苹果汁,优化发酵条件为菌种比例1∶1∶1∶1、接种量2%、发酵24 h、发酵温度37 ℃。Zheng Xin等[4]用干酪乳杆菌发酵荔枝汁,活菌数可达到8.57(lg(CFU/mL))。宋苏华[5]筛选出1 株耐酸、耐胆盐的植物乳杆菌NCU116,并利用该菌发酵香蕉汁。杨玉红等[6]利用双歧杆菌、保加利亚乳杆菌和嗜热链球菌发酵软枣猕猴桃,正交试验优化得到发酵条件:猕猴桃起始pH值为6,接种量为0.07%,38 ℃发酵8 h。
发酵果蔬汁的挥发性风味成分的检测主要利用气相色谱质谱法[7-8],但结果不能反映样品的整体信息,难以与人的嗅觉作系统化、科学化的对照[9]。电子鼻也称人工嗅觉系统,是基于半选择性的气敏传感器阵列对挥发性气体进行检测的多学科交叉技术,通过多个性能彼此重叠的气敏传感器和适当的模式分类方法实现对单一及复杂气味的检测和区分[10-12]。主要应用于检测食品掺假[13]、品种区分[14]、果蔬成熟[15]、贮藏[16]、腐败[17]、保质期[18]、发酵[19]等方面。
目前鲜见乳酸菌发酵天然猕猴桃汁的报道,发酵期间整体挥发性风味物质变化亦没有研究。本研究筛选适宜发酵猕猴桃汁的两株乳酸菌进行混合发酵,设计单因素试验并进行响应面优化,得到最优发酵参数并利用电子鼻监控发酵过程中的挥发性风味物质变化。旨在为乳酸发酵猕猴汁的研制提供指导,为进一步解释发酵猕猴桃汁特征香气物质的形成机理提供理论支持。
1 材料与方法
1.1 材料与试剂
徐香猕猴桃,购于周至县西峪乡,10月中旬采摘,8 分熟,无损伤和腐烂。
菌种:植物乳杆菌(Lactobacillus plantarum)21805、21801,嗜酸乳杆菌(Lactobacillus acidophilus)20250、6074,干酪乳杆菌(Lactobacillus casei)23185,副干酪乳杆菌(Lactobacillus paracasei)22709、20241,嗜热链球菌(Streptococcus thermophiles)6247,动物双歧杆菌(Bifidobacterium animalis)6165、6174,肠膜明串珠菌肠膜亚种(Leuconostoc mesenteroides subsp.mesenteroides)22184,均购于中国工业微生物菌种保藏管理中心,均保存于西北农林科技大学食品科学与工程学院健康食品制造与安全控制实验室。
MRS肉汤培养基 北京陆桥技术股份有限公司。
1.2 仪器与设备
2000JP-1离心果汁机 南通金橙机械有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;YXQ-LS-70A立式压力蒸汽灭菌器 上海博迅实业有限公司;PEN3便携式电子鼻(各传感器响应特性如表1所示) 德国Airsense公司;YT-CJ-2ND型超净工作台 北京亚泰科隆仪器技术有限公司。
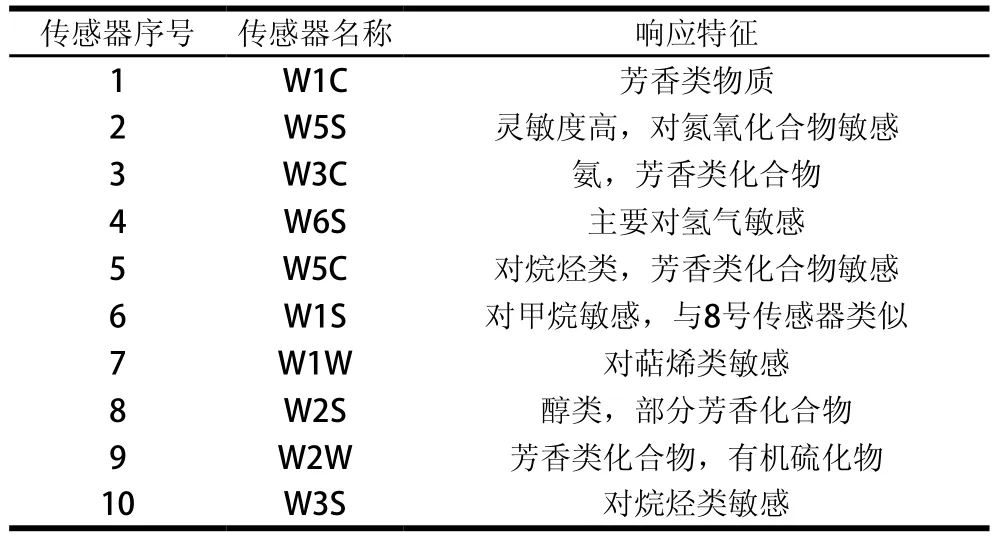
表1 PEN3电子鼻传感器阵列的响应特征Table 1 Response characteristics of the sensors used in electronic nose
1.3 方法
1.3.1 猕猴桃汁制备工艺流程
挑选→清洗→去皮→切块→榨汁→酶解→灭酶→离心→抽滤
1.3.2 益生菌菌株筛选[20]
将1.1节中的11 株乳酸菌分别于MRS液体培养基中活化培养1 代,第2代MRS液体培养基分别用盐酸调节pH值至3.00,以0.5%的比例添加牛胆盐,按1%接种量分别接种培养3 h后计活菌数,筛选活菌数大于106CFU/mL的菌株,即得到耐酸、耐胆盐菌株进行后续实验。
1.3.3 发酵菌群筛选
将筛选得到的乳酸菌分别于MRS液体培养基中活化培养2 代,再分别接种于100 mL猕猴桃汁中36 ℃培养24 h,作为发酵种子液。控制种子液活菌数达1×107CFU/mL,以1∶1(2 株菌共同发酵)、1∶1∶1(3 株菌共同发酵)的比例,3%的接种量接种于500 mL猕猴桃汁中,以活菌数和感官评分为指标确定发酵菌群。
1.3.4 猕猴桃汁的发酵
按照1.3.3节方法制备植物乳杆菌21805和嗜酸乳杆菌20250的发酵种子液,以不同的发酵条件接种于500 mL猕猴桃汁中,发酵完成后于-20 ℃冻存。
1.3.5 猕猴桃汁活菌数测定和感官评定
活菌数测定采用倾注平板法。
感官评定:18 名受过训练的老师和学生组成感官评定小组,从色泽、组织状态、香气、口感4 个方面对各组猕猴桃果汁进行评分,评分细则如表2所示。

表2 感官评分标准Table 2 Criteria for sensory evaluation of fermented kiwifruit juice
1.3.6 发酵猕猴桃汁的单因素试验
1.3.6.1 发酵温度的选择
猕猴桃汁初始糖度为12.2 °Brix,pH值为3.45(下同)。以1∶1的菌种比例,3%的接种量接入猕猴桃汁中,分别在30、32、34、36 、38、40 ℃发酵24 h,测定各发酵组的感官评分和活菌数。
1.3.6.2 发酵时间的选择
以1∶1的菌种比例,3%的接种量接入猕猴桃汁中,在36 ℃分别发酵16、20、24、28、32、36 h,测定各发酵组的感官评分和活菌数。
1.3.6.3 接种量的选择
以1∶1的菌种比例,接种量分别为1%、2%、3%、4%、5%、6%接入猕猴桃汁中,在36 ℃发酵24 h,测定各发酵组的感官评分和活菌数。
1.3.6.4 菌种比例的选择
分别以植物乳杆菌-嗜酸乳杆菌菌种比例0∶1、3∶1、1∶3、1∶1、2∶1、1∶2、1∶0,接种量为3%接入猕猴桃汁中,在36 ℃发酵24 h,测定各发酵组的感官评分和活菌数。
1.3.7 响应面优化试验
对单因素试验结果进行分析,采用中心组合设计方法,选择对感官评分和活菌数影响显著的因素设计3因素5水平响应面试验,如表3所示。以感官评分和活菌数为评价指标,两个指标各占权重50%[3]。

表3 中心组合试验设计因素与水平Table 3 Coded levels for factors used in central composite design
1.3.8 电子鼻测定
按照1.3.4节方法,以最优条件发酵猕猴桃汁。期间每4 h取样品200 mL,共7 组样品,每组设18 个平行,设置电子鼻进气量为400 mL/min,每秒采集一个数据,检测60 s,清洗240 s。
1.4 数据分析
用Origin 8.0作图,SPSS18.0进行单因素方差分析,电子鼻所测得的数据使用自带软件Winmuster进行线性判别分析(linear discriminant analysis,LDA)和载荷分析。
2 结果与分析
2.1 益生菌菌株筛选与发酵菌株的确定

表4 乳酸菌的耐酸、耐胆盐活菌数Table 4 Tolerance of lactic acid bacteria to low pH and bile salt conditions 106 CFU/mL
表4结果显示,在耐胆盐实验中,1、2、5、8、9和10号的活菌数均没有达到106CFU/mL,表明这些菌株均无法耐受胆盐环境,无法作为益生发酵菌株。在耐酸实验中,除2号和11号,其余组3 h的活菌数与0 h相比有所减少,表明大部分菌株生长受抑制,但活菌数均大于106CFU/mL,表明这些菌株均能够耐受酸性环境。6号在酸性环境中生长3 h后活菌数达到107CFU/mL,约为0 h活菌数的3 倍,表明这株菌能适应酸性环境并迅速生长。3、4、6、7和11号在pH 3.0和添加牛胆盐的培养基中培养3 h后活菌数均高于106CFU/mL,表明这5 株菌可以耐受人体胃液酸性和胆盐汁的环境发挥益生性能。发酵实验结果如表5所示,9 个发酵组的感官评分和活菌数之间差异明显,混菌发酵组的感官评分、活菌数普遍高于单菌发酵组。在单菌发酵组中,20241的感官评分最高,21801、6074发酵的猕猴桃汁感官评分较低,发酵后有刺鼻异味。选择21805、20250和20241进行两两组合发酵和3 株菌共同发酵,在混菌发酵组中,菌株21805与20250共同发酵的猕猴桃汁感官评分最高;3 株菌共同发酵组的口感过酸,适口性不好,刺激气味明显,所以感官评分较低。混菌发酵能够提高活菌数,改善单菌发酵单一的风味,综合选择菌株21805与20250共同发酵猕猴桃果汁。

表5 不同菌种发酵结果Table 5 Fermentation results with different strains
2.2 猕猴桃汁发酵条件的单因素试验结果
2.2.1 发酵温度对猕猴桃汁感官评分及活菌数的影响

图1 发酵温度对感官评分和活菌数的影响Fig. 1 Effect of fermentation temperature on sensory evaluation and viable count
如图1所示,在34~38℃时,感官评分没有显著差异(P>0.05),而温度过高会降低猕猴桃汁的感官评分。活菌数随着发酵温度的升高而增加,当温度高于34 ℃时,猕猴桃汁的活菌数没有显著变化(P>0.05)。当发酵温度为36 ℃时,活菌数达到最高值为2.13×108CFU/mL,此时感官评分为81.06 分。综合选择36 ℃为最佳发酵温度。由于温度过低或过高会影响发酵果汁品质,在34~38 ℃时发酵温度对感官评分和活菌数影响均不显著,因此不列为响应面试验中的因素。
2.2.2 发酵时间对猕猴桃汁感官评分及活菌数的影响
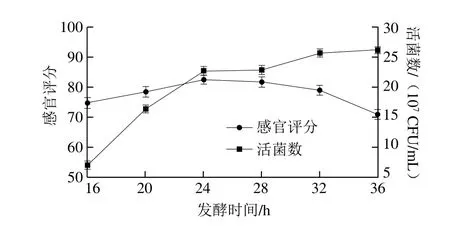
图2 发酵时间对感官评分和活菌数的影响Fig. 2 Effects of different times on sensory evaluation and viable count
由图2可以看出,活菌数随发酵时间的延长而显著增大,感官评分随发酵时间的延长先增大后减小,说明发酵时间过长会影响猕猴桃汁的感官风味。发酵24 h时,感官评分达到最大值82.3分;发酵28~36 h时,活菌数增加,但感官评分显著下降,这是由于发酵猕猴桃汁的乳酸积累过量,口感过酸导致感官评分明显降低。综合考虑,选择发酵时间24 h为最佳水平。
2.2.3 接种量对猕猴桃汁感官评分及活菌数的影响
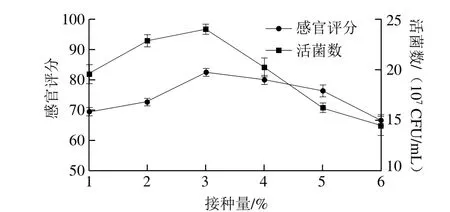
图3 接种量对感官评分和活菌数的影响Fig. 3 Effect of inoculum amount on sensory evaluation and viable count
接种量的大小会影响发酵果汁的品质,接种量过低会延长发酵时间,样品产酸速度慢易受杂菌污染;接种量过高发酵速度会加快,但由于果汁中积累的酸过高会加速乳酸菌的死亡,从而影响果汁品质。由图3可以看出,当接种量为3%时,感官评分和活菌数都达到了最高值,分别为82.33 分和2.393×108CFU/mL。当接种量为1%~3%时,感官评分和活菌数都显著增加(P<0.05),当接种量为3%~6%时,感官评分呈下降趋势,活菌数显著降低(P<0.05)。选择接种量3%为最佳水平。
2.2.4 菌种比例对猕猴桃汁感官评分及活菌数的影响

图4 菌种比例对感官评分和活菌数的影响Fig. 4 Effect of ratio between probiotic strains on sensory evaluation and viable count
由图4可以看出,当植物乳杆菌-嗜酸乳杆菌菌种比例2∶1时,活菌数达到最高值2.57×108CFU/mL,当植物乳杆菌-嗜酸乳杆菌菌种比例1∶1时感官评分达到最高值86.17 分。单因素方差分析得到不同菌种比例对活菌数和感官评分均有显著影响(P<0.01),综合选择植物乳杆菌-嗜酸乳杆菌2∶1为最佳比例。
2.3 响应面中心组合设计优化
2.3.1 响应面优化结果和方差分析
响应面试验设计与结果如表6所示,利用Design Expert 8.0.6软件分析得到感官评分(Y1)和活菌数(Y2)对自变量A(发酵时间)、B(接种量)、C(菌种比例)的回归方程分别为:Y1=78.31+0.86A-0.69B-0.69C+2.15AB+1.75AC-0.28BC-0.18A2-1.32B2-1.55C2;Y2=22.85-1.51A+0.60B-0.75C+0.48AB+2.37AC+1.85BC-3.60A2-4.06B2-3.94C2。

表6 中心组合试验设计及结果Table 6 Central composite design with experimental values of response variables
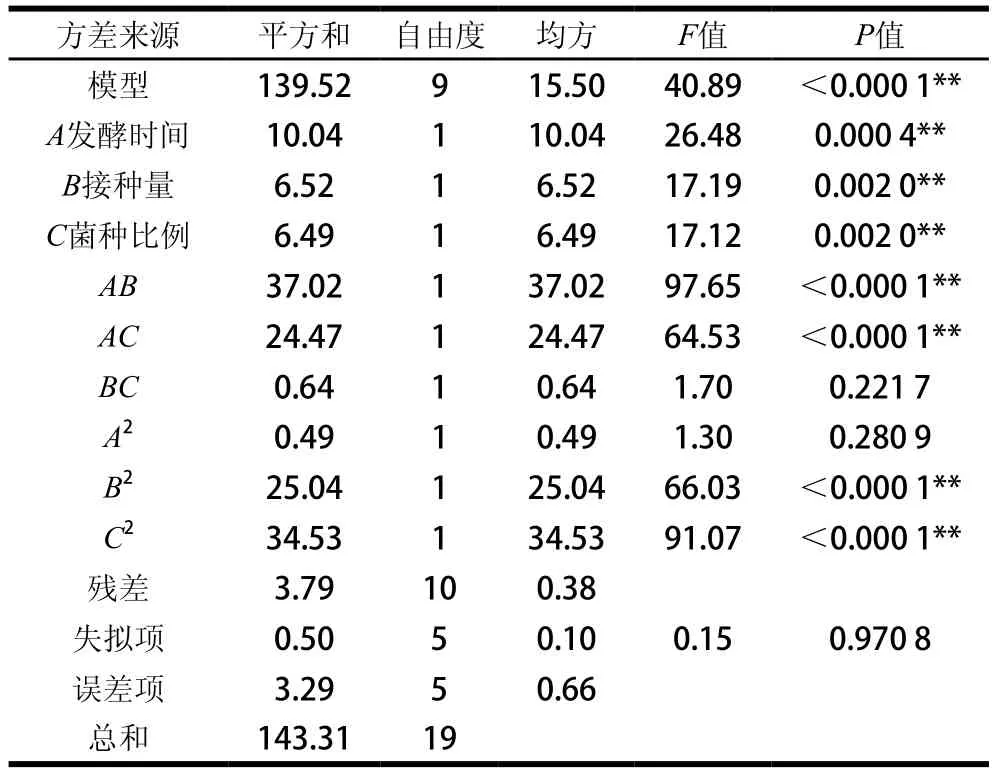
表7 感官评分方差分析Table 7 Analysis of variance of sensory evaluation
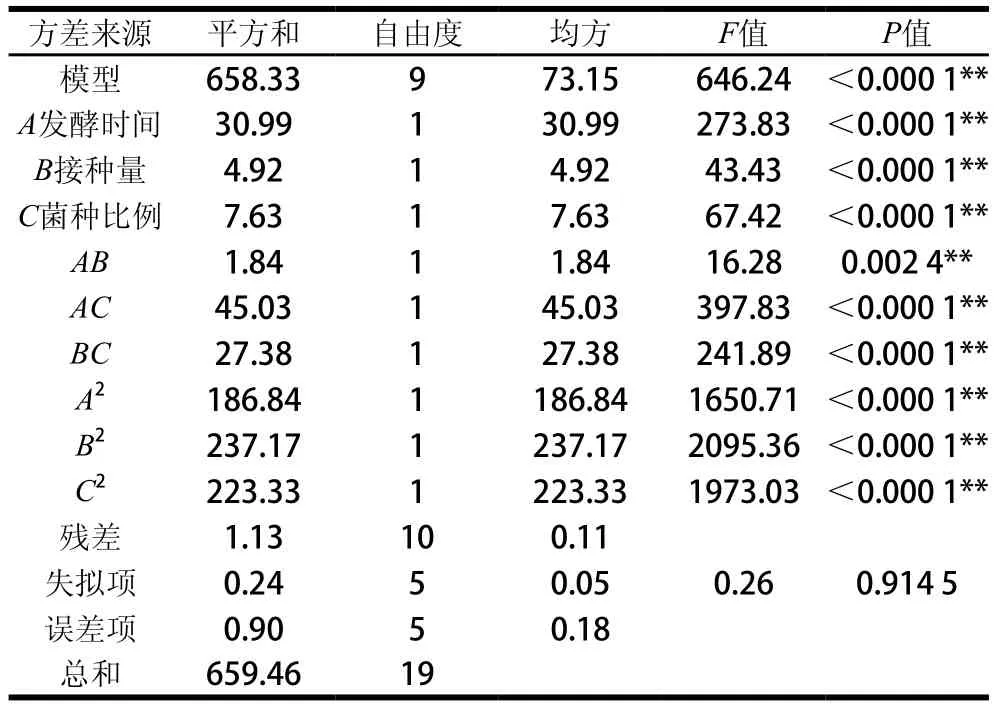
表8 活菌数方差分析Table 8 Analysis of variance of viable count
由表7和表8可知,两个模型均达到极显著水平(P<0.000 1),且失拟项不显著(P>0.05),表明方程与实际数据拟合性良好,试验设计可靠,适用于发酵猕猴桃汁工艺参数的优化。感官评分与活菌数信噪比的值分别为24.255和65.136,均远大于4。感官评分决定系数R2为0.973 5,活菌数R2为0.998 3,说明感官评分和活菌数的实测值与预测值之间具有较好的拟合度,可以用此模型分析和预测乳酸菌发酵猕猴桃汁的发酵工艺。A、B、C及AB、AC的交互作用及B2、C2对猕猴桃汁感官评分均有极显著影响(P<0.01),BC、A2则影响不显著。A、B、C及AB、AC、BC的交互作用及A2、B2、C2对猕猴桃汁活菌数均有极显著影响(P<0.01)。
2.3.2 因素间交互作用分析
由图5可知,发酵时间与接种量、发酵时间与菌种比例之间的交互作用对感官评分有显著影响,发酵时间、接种量、菌种比例两两因素交互作用对活菌数有显著影响。
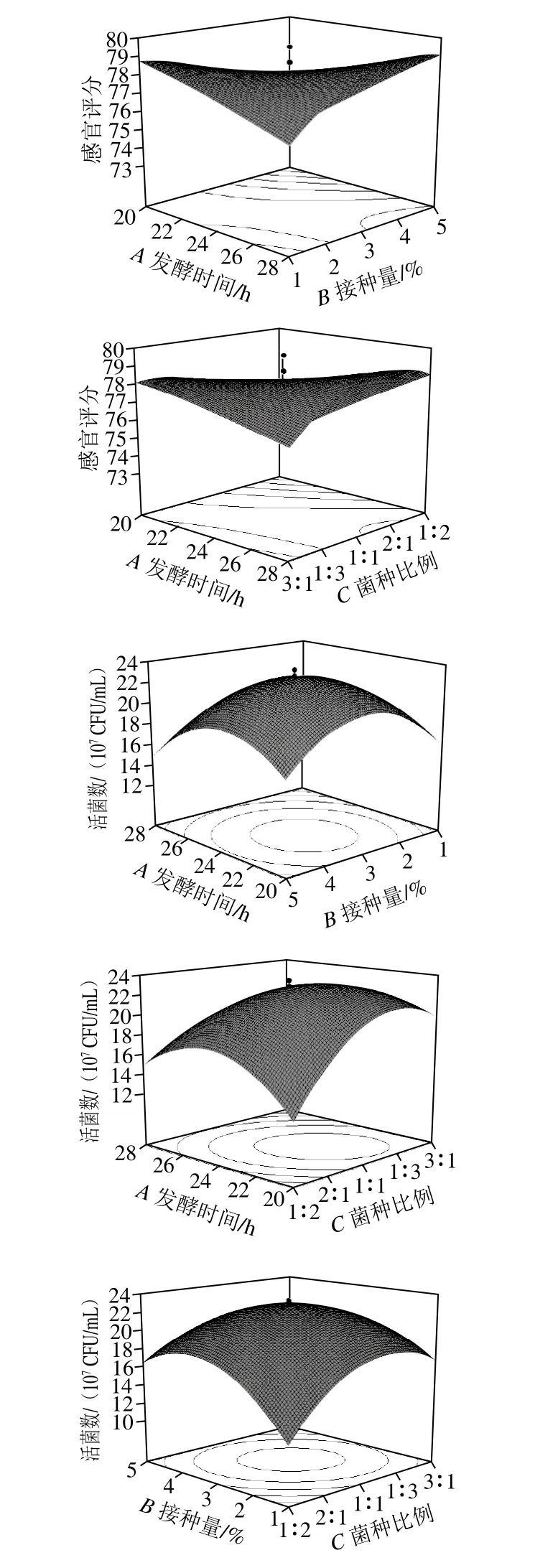
图5 不同因素交互作用对猕猴桃汁感官评分和活菌数的影响Fig. 5 Interactive effects of different factors on sensory evaluation and viable count of fermented kiwifruit juice
2.3.3 模型验证
利用Design-Expert 8.0.6预测猕猴桃汁发酵最佳工艺条件为发酵温度36 ℃、发酵时间22.86 h、接种量2.67%、菌种比例1∶1,预测感官评分为78.43 分,活菌数为2.3×108CFU/mL。为便于实践操作,对优化条件的参数取整后得到发酵温度36 ℃、发酵时间24 h、接种量3%、菌种比例1∶1。以此条件发酵猕猴桃汁进行验证,得到实际活菌数为2.185×108CFU/mL(误差5%),感官评分为81.45 分(误差3.8%)。可以看出优化得到的工艺条件是可靠的。
2.4 不同发酵阶段猕猴桃汁香气成分的电子鼻分析
2.4.1 电子鼻对不同发酵阶段猕猴桃汁的特征响应

图6 传感器对发酵前后猕猴桃汁挥发性气味响应图Fig. 6 Response curves of electronic nose sensors to kiwifruit juice before and after fermentation
如图6所示,所有传感器响应值变化均显著(P<0.01)。S7、S6、S2、S9和S8对猕猴桃汁有较大响应,S7和S9响应值均迅速增大至最高值后缓慢下降,最后逐渐趋于稳定,S6、S2和S8的响应值均迅速增大至最高值后逐渐趋于稳定,其余传感器响应值变化相对平缓。S7号响应值最高,说明发酵猕猴桃汁中该传感器代表的物质浓度越高,其余5 个传感器响应值都在1左右且无明显变化,说明这些传感器对发酵猕猴桃汁的香气不敏感,这与马婷等[21]利用电子鼻检测猕猴桃汁的结果一致,当检测至40 s之后,所有传感器的响应值都趋于稳定,选取40 s处的信号作为分析时间点。

图7 传感器对不同发酵阶段的猕猴桃汁挥发性气味响应值变化的影响Fig. 7 Changes in response curves of electronic nose sensors to kiwifruit juice at different fermentation stages
如图7所示,5 个传感器的响应值发酵后较发酵前明显升高(P<0.01),说明发酵使猕猴桃汁香气成分增多。S7的响应值在0~8 h减小,8 h至发酵结束响应值不断增大至最大值;S6的响应值在0~8 h内先增大后减小,8 h至发酵结束响应值不断增大至最大值;S2的响应值在0~8 h内先减小后增大,8 h至发酵结束响应值不断增大至最大值。S9和S8的响应值在发酵期间呈波动状态。从8 h开始各传感器响应值较发酵前期均明显增大。猕猴桃汁在不同发酵阶段呈现风味的不同可能来自于传感器代表物质的变化,因此发酵猕猴桃汁的特征风味均可能来源于萜烯类、烷类、氮氧化合物、芳香化合物、醇类等,这些物质含量动态变化影响整体风味的变化。
2.4.2 LDA
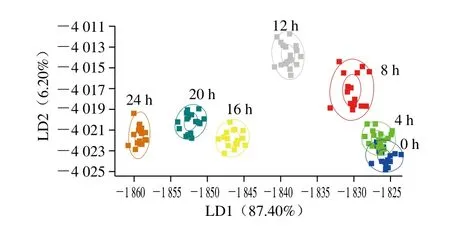
图8 不同发酵时间的猕猴桃汁的LDA图Fig. 8 LDA score plot of fermented kiwifruit juice samples
LDA是将高维的模式样本投影到最佳鉴别矢量空间,以达到抽取分类信息和压缩特征空间维数的效果,投影后保证模式样本在新的子空间有最大的类间距离和最小的类内距离,使得组间的投影尽可能分开[22]。图8结果显示,LD1贡献率为87.40 %,LD2贡献率为6.20 %,总贡献率为93.60 %。发酵期间LD1呈现递减的趋势,LD2呈现先上升后下降的变化趋势。总体来看,0 h的猕猴桃汁样品与发酵后的样品距离较大,说明接种乳酸菌对猕猴桃汁香气影响较大,这与束文秀等[23]利用电子鼻检测乳酸发酵胡柚汁的结果一致。电子鼻可以很好区分发酵4~24 h的猕猴桃汁样品,6 组样品之间的位置相隔较远。0 h和4 h样品的位置有部分重叠,可能由于此时为乳酸菌的生长延滞期,果汁体系中的风味物质没有明显变化;发酵至8 h后的样品在LD1方向变化较大,说明发酵至8 h后体系的风味成分才明显变化,这与传感器响应值变化一致,可能由于乳酸菌进入对数生长期,乳酸菌代谢分解产生的风味物质相互作用,改变了体系香气成分和含量从而导致整体风味变化。12 h的样品与其他样品在LD1和LD2上都有明显区分,说明发酵12 h的发酵猕猴桃汁较其他组有明显的变化,是发酵过程中产生特殊香气成分的关键时期,具体成分还需要进一步检测。8~24 h的样品在LD1上变化较大,说明发酵后期是发酵猕猴桃汁产生风味的关键阶段。由此看出,经发酵的猕猴桃汁在不同发酵阶段风味成分有差异,且有一定变化趋势。发酵至8 h,发酵猕猴桃汁的挥发性香气成分开始形成,发酵12 h的果汁与其他发酵时间的果汁有明显差异,发酵后期的风味变化较大。
2.4.3 载荷分析
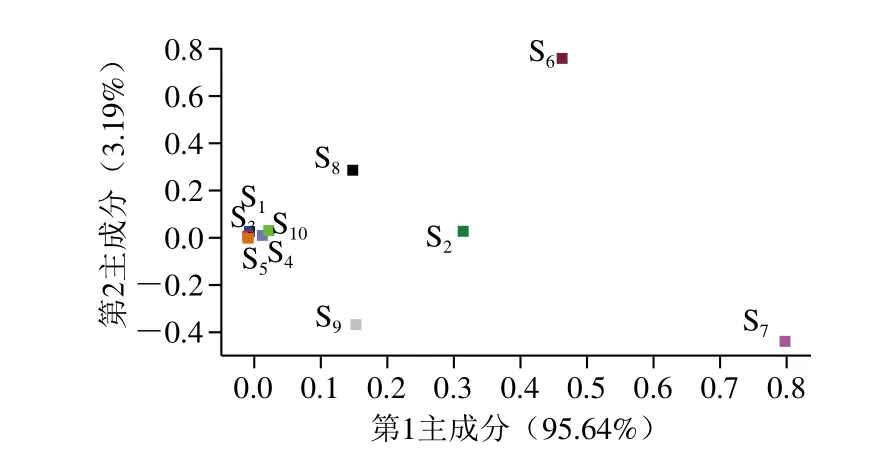
图9 不同发酵时间猕猴桃汁的载荷分析图Fig. 9 Loadings plot of fermented kiwifruit juice samples
图9 结果显示,第1主成分贡献率为95.64%,第2主成分贡献率为3.19%,总贡献率为98.83%。传感器S7在第1主成分贡献率占主要部分,传感器S6在第1主成分贡献率和第2主成分贡献率均占据了相当大的部分。图7显示传感器S7和S6对发酵猕猴桃汁响应值最高且随发酵产生明显变化,表明这两个传感器在识别和检测发酵猕猴桃汁样品中起着重要作用,说明发酵过程中萜烯类和烷类物质的动态变化对整体风味的变化有重要影响,是形成发酵猕猴桃汁特殊风味的关键类物质。传感器S8、S2、S9的贡献率较小,说明对样品的识别作用较小。
3 结论与讨论
本研究筛选出植物乳杆菌21805和嗜酸乳杆菌20250共同发酵猕猴桃汁,通过单因素试验和响应面法优化得到猕猴桃汁发酵最佳工艺条件为发酵温度36 ℃、接种量3%、发酵时间24 h、菌种比例1∶1,此时活菌数为2.185×108CFU/mL,感官评分为81.45 分。
乳酸菌发酵猕猴桃汁的挥发性风味物质主要来自猕猴桃原料本身和乳酸菌发酵的代谢产物,在香气成分相互作用下形成发酵猕猴桃汁的独特风味。电子鼻模拟人的嗅闻方式获得样品整体信息,避免感官评价的主观误差,检测结果重复性好[24]。有研究[25]通过模拟葡萄酒发酵的糖消耗和产乙醇动力学模型,验证电子鼻能够有效监控发酵过程。电子鼻对发酵红茶[26]、草鱼[27]、羊奶[28]、石榴酒和乳酸发酵石榴饮料[29]以及腌渍的榨菜[30]和带鱼[31]区分效果好,是一种快速、灵敏、无损的技术。在本研究中,电子鼻对发酵猕猴桃汁的挥发性风味物质感应灵敏,能够检测其挥发性风味物质的变化,香气成分包括萜烯类、醇类、烷类、氮氧化合物、芳香类化合物等。电子鼻能够较好识别不同发酵时间的猕猴桃汁,发酵时间是影响发酵猕猴桃汁风味的重要因素。发酵8 h开始形成发酵香气;12 h时香气成分变化明显,是产生香气物质的关键时间点;发酵后期是生成发酵猕猴桃汁风味的关键阶段。发酵12 h和24 h的猕猴桃汁较其他组差异较大,可能是在发酵过程中响应值变化较大和模式识别贡献率较大的两个传感器S7和S6所敏感的物质引起的。芳香化合物广泛存在于水果中,是水果的主要香气成分。其中萜烯类化合物呈现特殊的香气,是水果特征香气主要贡献者[32],代表物芳樟醇具有花香,松油醇有水果香,它们的阈值都很低[33],对发酵猕猴桃汁的香气起着关键作用。通过电子鼻的快速检测方法,可以监测猕猴桃汁的发酵进程,控制发酵果汁的品质。
