水相体系中磷脂酶A1酶解南极磷虾磷脂制备溶血磷脂的分析
2019-07-05俞博凯丁玉庭刘书来
胡 劼,俞博凯,吕 飞,丁玉庭,3,刘书来,3,*
(1.浙江工业大学海洋学院,浙江 杭州 310014;2.国家远洋水产品加工技术研发分中心(杭州),浙江 杭州 310014;3.浙江工业大学海洋研究院,浙江 杭州 310032)
南极磷虾巨大的生物量已受到人们广泛关注,目前对于南极磷虾的商业开发局限于动物饲料等的加工,经济效益低下[1]。研究发现,南极磷虾磷脂的主要成分是磷脂酰胆碱(phosphatidyl cholines,PC),还有少量磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)和磷脂酰肌醇(phosphatidylinositol,PI)等[2]。磷虾油中约60%~70%的ω-3长链多不饱和脂肪酸,主要是二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),并且与磷脂结合存在(位于Sn-2位居多)[3],是目前自然界中发现的唯一一种以磷脂形态结合的多不饱和脂肪酸,而鱼油中的DHA、EPA主要以甘油酯形式存在,因而比鱼油具有更为重要的生理功能[4]。海洋源ω-3多不饱和脂肪酸(polyunsaturated fatty acid,PUFA),已被证明在预防心血管疾病中发挥有益作用[5-6]。除此之外,ω-3 PUFA还被证实可降低收缩压、缓解血小板聚集、消炎以及预防心律失常[5]。ω-3 PUFA通常以甘油三酯(triglyceride,TG)的形式通过鱼油或者补充剂摄入,而磷虾油中ω-3 PUFA以磷脂的形式存在,能被更有效地吸收并掺入细胞膜中[7],还可减少血浆脂质[8]、提高EPA和DHA的生物利用度及抗炎和抗氧化活性[9-10]。
溶血磷脂的乳化稳定性、抗氧化性、润湿性及亲水亲油平衡值(hydrophile-lipophile balance number,HLB)都优于磷脂,其乳化体系有抗酸、抗盐以及抗高温等优点[11]。同时,溶血磷脂的分子渗透能力、杀菌能力、溶血能力与药物亲和能力也引起生理药理学家的极大兴趣。目前磷脂酶解的原料主要为大豆和蛋黄等[12-13],国内外关于南极磷虾磷脂酶解改性制备溶血磷脂的报道较少,因此将其作为原料制备富含EPA和DHA的溶血磷脂,具有更重要的生理功能[14]。国内外溶血磷脂制备工艺通常采用非水相体系[15-16]或含缓冲液的水相体系[17]。非水相体系的酶改性工艺中有机溶剂的使用造成产品中溶剂残留,另外溶剂的易挥发性还导致溶剂消耗大,不符合绿色加工发展趋势;而含缓冲液的水相体系会影响产品的质量及后续处理难度。磷脂酶A1(phospholipase A1,PLA1)可用于水解磷脂酰胆碱制备溶血磷脂酰胆碱,且特异性地水解磷脂酰胆碱的Sn-1位,以制备Sn-2位富含EPA和DHA的溶血磷脂酰胆碱,但Sn-2-溶血磷脂酰胆碱(Sn-2-lysophosphatidylcholine,Sn-2-LPC)也会发生部分酰基位移生成Sn-1-溶血磷脂酰胆碱(Sn-1-lysophosphatidylcholine,Sn-1-LPC)[18-19]。在水相体系中PLA1催化南极磷虾磷脂制备富含EPA和DHA的溶血磷脂,国内鲜见文献报道。本研究以酸价衡量磷脂水解程度,通过高效液相色谱-紫外检测(high performance liquid chromatographyultraviolet,HPLC-UV)仪和高效液相色谱-示差检测(high performance liquid chromatography-refractive index detector,HPLC-RID)仪对酶解前后磷脂组分(PC、Sn-1-LPC、Sn-2-LPC)进行分析,通过高效液相色谱-蒸发光散射(high performance liquid chromatographyevaporative light scattering detector,HPLC-ELSD)仪检测甘油磷脂酰胆碱(glycerol phosphatidylcholine,GPC)含量以进一步证实酰基位移现象,并利用气相色谱-质谱(gas chromatography-mass spectrometer,GCMS)法分析磷脂酶解前后脂肪酸组成(尤其是EPA和DHA含量的变化),以期为南极磷虾磷脂的酶解改性技术提供基础数据。
1 材料与方法
1.1 材料与试剂
南极磷虾磷脂:以磷虾油(由辽渔集团提供,采用乙醇提取)为原料,经过多次丙酮沉降,磷脂含量90%左右,酸价10.7 mg/g;磷脂酶A1(Lectise Ultra,酶活力2 000 U/g) 丹麦诺维信公司;无水乙醇、乙醚、丙酮(均为分析纯) 上海凌峰化学试剂有限公司;氢氧化钾、邻苯二甲酸氢钾(分析纯) 国药集团化学试剂有限公司;正己烷、草酸(H2C2O4·2H2O)、异丙醇、95%乙醇、乙酸(均为色谱纯) 美国阿拉丁公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器 杭州博研仪器设备有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂;SHZ-D(III)循环水式真空泵 巩义市予华仪器有限责任公司;FA1004型电子天平 常州市幸运电子设备有限公司;KQ-300DE型数控超声波清洗器昆山市超声仪器有限公司;DHG-9075电热鼓风干燥箱上海一恒科学仪器有限公司;TRACE 1300 GC-MS谱仪赛默飞世尔科技公司;1525液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 PLA1酶解南极磷虾磷脂制备溶血磷脂
准确称取0.6 g南极磷虾磷脂于100 mL锥形瓶中,加30 mL去离子水均质分散,确保反应体系为水相,再加一定比例PLA1溶液,预混匀后,在一定温度、时间及搅拌速度下进行反应,反应完成后沸水灭酶3 min,留样待测定。
1.3.2 双相薄层色谱定性分析磷脂组成成分
参考AOCS Ja 7-86[20]的方法测定,稍作修改。点样:取样品50 mg溶解后定容于10 mL容量瓶中,使用10 μL微量进样器进行点样,样点距两边约1 cm,样斑直径不超过3 mm。层析步骤:将点过样的薄板挥干溶剂后放入盛有展开剂A(氯仿-甲醇-氨水,65∶30∶4,V/V)的层析槽中进行展开。展至距板上沿1 cm左右时取出,在室温下干燥30 min,挥干溶剂后再放入展开剂B(氯仿-甲醇-冰醋酸-水,170∶25∶25∶6,V/V)中展开,至顶边1 cm左右时取出,再次晾干。显色:将挥干溶剂的层析板放入碘缸中显色。薄层层析板定性分析:将磷脂实验产品按照上述步骤展开,显色。参照PC、PE、LPC标样图谱和资料中的图谱,对各磷脂组分进行定性。
1.3.3 磷脂酸价的测定
参考AOCS Ja 6-55[21]的方法测定,稍作修改。取干净250 mL锥形瓶,用天平称取0.5~3.0 g磷脂样品,加入乙醚-异丙醇混合液50~100 mL和3~4 滴百里香酚酞指示剂(2%),充分振荡溶解试样。再用标准氢氧化钾(0.1 mol/L)溶液进行手工滴定,当试样溶液变为蓝色时,且15 s内无明显褪色时,为滴定终点。记录下此时消耗的氢氧化钾的体积V。同时做一组空白实验作对照,记录体积V0,按公式(1)计算酸价:
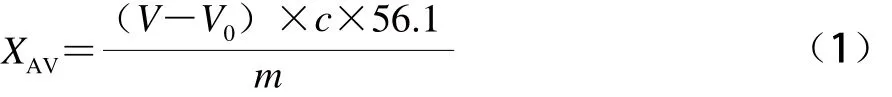
式中:XAV为酸价/(mg/g);V为试样测定所消耗的标准滴定溶液的体积/mL;V0为相应的空白实验所消耗的标准滴定溶液的体积/mL;c为标准滴定溶液的浓度/(mol/L);56.1为氢氧化钾的摩尔质量/(g/mol);m为油脂样品的称样量/g。
1.3.4 磷脂水解度的计算
磷脂水解度按公式(2)、(3)计算:

式中:X为磷脂Sn-1位脂肪酸水解度/%;A为水解产物酸价/(mg/g);B为原料酸价/(mg/g);C为磷脂Sn-1位完全水解产生的理论酸价/(mg/g); 为磷脂平均相对分子质量。
1.3.5 磷脂各组成成分的HPLC-UV分析[22]
色谱柱:Sunfire Prep Silica(250 mm×4.6 mm,5 μm);柱温30 ℃;流速1 mL/min;检测波长206 nm;流动相为正己烷-异丙醇-0.05%乙酸(6∶8∶1.38,V/V),过0.22 μm有机膜,超声脱气处理30 min;进样量10 μL。样品的定性分析采用标样保留时间比对,定量分析采用标样外标法。
1.3.6 磷脂酶解后GPC含量的HPLC-ELSD分析[18]
色谱柱:Sunfire Prep Silica(250 mm×4.6 mm,5 μm);柱温30 ℃;漂移管温度80 ℃;流速1 mL/min;梯度洗脱:流动相A为甲醇-水(8∶1,V/V),流动相B为甲醇。流动相A的梯度洗脱,开始10 min,以40%梯度增加到60%并保持5 min,最后3 min由60%降低到40%;进样量10 μL,样品的定性分析采用标样保留时间比对,定量分析采用标样外标法。
1.3.7 Sn-1-LPC和Sn-2-LPC含量的HPLC-RID分析
参考GB/T 22506—2008《酶改性磷脂中1-和2-溶血磷脂酰胆碱的测定》[23]中方法。色谱柱:Waters spherisorb NH2(250 mm×4.6 mm,5 μm);柱温25 ℃;进样量10 μL。等度洗脱,流动相为95%乙醇-草酸溶液(92:8,V/V),过0.22 μm有机膜,超声脱气处理30 min,流速1 mL/min。示差检测器检测峰面积,以峰面积为纵坐标(Y),标样质量浓度为横坐标(X,mg/mL)进行标准曲线的绘制。
样品处理:称取50~100 mg酶改性磷脂样品,用95%乙醇溶解稀释至25 mL,用高速离心机离心(8 000 r/min,10 min),取上清液用0.45 μm纤维膜过滤,现配现用。
1.3.8 磷脂脂肪酸组成测定[24-27]
采用薄层制备板分离磷脂和游离脂肪酸。带状点样后,以正己烷-乙醚-冰乙酸(80∶19∶1,V/V)为展开剂进行展层,显色,刮板收集磷脂层和游离脂肪酸层,用无水乙醇萃取硅胶中的磷脂和游离脂肪酸,氮吹挥干溶剂,得到样品。
样品甲酯化:在样品中加入1 mL 0.5 mol/L NaOH-甲醇溶液,摇匀后于80 ℃水浴振荡5 min,冷却至室温后,再加入1 mL 14% BF3-甲醇溶液和0.3 mL 0.1%对苯二酚溶液,在80 ℃水浴中振荡2 min,冷却至室温后加0.2 mL盐溶液,振荡10 s后加入1 mL正己烷,振荡摇匀后静置。待分层后取含脂肪酸甲酯的上层溶液,加入一定量无水硫酸钠脱除水分,使用0.22 μm孔径有机相滤膜过滤后进行GC-MS分析。
GC条件:HP-INNOWax毛细管柱(60 m×0.32 mm,0.25 μm);载气为高纯氦气;采用恒流模式;流速为2 mL/min,不分流;进样量1 μL;进样口温度240 ℃;检测器温度250 ℃;柱温以初始温度90 ℃保持5 min,先以15 ℃/min升至200 ℃,再以1 ℃/min升至240 ℃并保持10 min,整个分析过程为62.3 min。MS条件:GC-MS接口温度250 ℃;电子电离源;电离能量70 eV;离子源温度250 ℃;扫描周期,0.2 次/s;质量扫描范围m/z 35~450 u。
1.3.9 酶解前后磷脂乳化稳定性测定[28-29]
配制一定量1%酶解后磷脂水溶液,然后按一定油水比加入大豆油,经高速剪切机(10 000 r/min)分散2 min,得乳状液。将乳化液转移到100 mL具塞量筒中,间隔一定时间观察分层情况,并与磷脂原料作比较。以乳化层比例大小衡量乳化能力和乳化稳定性,乳化层比例越大,乳化能力和乳化稳定性越好,按公式(4)计算:

1.4 数据分析与处理
数据结果采用Origin 8.6进行处理。所有实验平行测定3 次以上,结果以±s表示。
2 结果与分析
2.1 南极磷虾磷脂的组成分析
用双相薄层色谱法对原料磷脂中的主要组分进行定性分析,结果如图1所示。采用乙醇提取的磷虾磷脂中主要含有PC、PE、LPC等物质,且从显色面积来看,PC为主要成分。
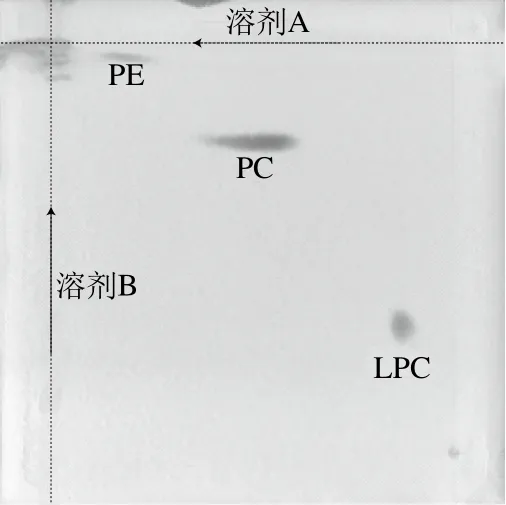
图1 原料磷脂双相薄层展开图Fig. 1 Two-dimensional TLC profile of phospholipids
用HPLC-UV对南极磷虾磷脂主要组分进行定量分析,由表1可知,实验室自提的南极磷虾磷脂中PC为主要成分,其含量为(90.90±1.55)%,PE和溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)含量分别为(3.20±1.03)%和(2.60±0.96)%。孙德伟等[30]用亚临界丁烷提取南极磷虾脂质,其磷脂含量较高,但磷脂酰胆碱仅占71.20%,其PE和PI含量相对较高。这是由于脂质提取所用溶剂不同,PE在乙醇中溶解度小,而磷虾中PI含量本就偏低,因此本研究以PC为实验主要原料进行分析。

表1 南极磷虾磷脂各组分的含量Table 1 Composition of Antarctic krill phospholipids%
2.2 反应时间对磷脂酶解的影响

图2 反应时间对磷脂酶解的影响Fig. 2 Effect of reaction time on phospholipid hydrolysis
考察反应温度30 ℃和加酶量20 U/g条件下不同反应时间对磷脂酶解过程的影响,如图2所示,随着反应时间的延长,酶和底物接触次数增多,磷脂逐步被水解产生溶血磷脂和游离脂肪酸,其酸价随之不断升高,30 min后反应趋于平衡状态,酸价增加不明显。PC经PLA1酶解后主要生成Sn-2-LPC,且随时间的延长,PC含量不断减少而Sn-2-LPC含量不断增加,30 min后两者含量趋于平衡,同时Sn-1-LPC含量随反应时间延长呈先升高后逐渐降低的趋势,这是由于酶解过程中部分Sn-2-LPC发生酰基位移生成Sn-1-LPC,而Sn-1-LPC又进一步被PLA1酶解生成GPC[18-19]。
2.3 加酶量对磷脂酶解的影响
一般情况下,酶添加量较低时酶活力随其添加量的增加而增多,底物与酶活性中心接触的机率也随之增加,酶反应速率加快,但随酶添加量增至一定值时,酶反应速率变化不大,甚至还会出现抑制反应的现象[31]。由图3可知,由于初始时加酶量较少,酶不能充分催化底物,当加酶量增加时,酶与底物的接触面积增大,酸价增加较快,而当加酶量达到20 U/g时达到饱和状态,反应处于平衡,继续增大加酶量,水解程度无明显提高。

图3 加酶量对磷脂酶解的影响Fig. 3 Effect of enzyme dosage on phospholipid hydrolysis
2.4 反应温度对酰基位移的影响

图4 反应温度对酰基位移的影响Fig. 4 Effect of reaction temperature on acyl migration

图5 PLA1水解PC示意图Fig. 5 Schematic of the hydrolysis process of PC by PLA1
图4 给出了不同反应温度下酶解反应过程中下Sn-1-PC和Sn-2-PC含量的变化。结合图2中反应时间对酶解影响的结果可知,在不同反应温度下,酶解过程中均发生酰基位移现象,PLA1水解PC示意图如图5所示。张康逸等[32]通过定量13C NMR证明了PLA1具有水解磷脂Sn-1位酰基脂肪酸的专一性,证实了Sn-2-溶血磷脂酰胆碱(Sn-2-lysophosphatidylcholine,Sn-2-LPC)的Sn-2位酰基会通过酰基转移到Sn-1位生成Sn-1-溶血磷脂酰胆碱(Sn-1-lysophosphatidylcholine, Sn-1-LPC)现象的存在,且研究了温度对酰基位移的影响,从实验结果可知随温度升高酰基位移程度逐步升高(反应时间6 h)。从图4可知不同温度下反应30 min后Sn-1-LPC含量几乎没有差异,且GPC含量也没有升高,说明在较短的酶解时间(30 min)内,温度对酰基位移的影响不是很大。
2.5 南极磷虾磷脂酶解前后脂肪酸组成分析
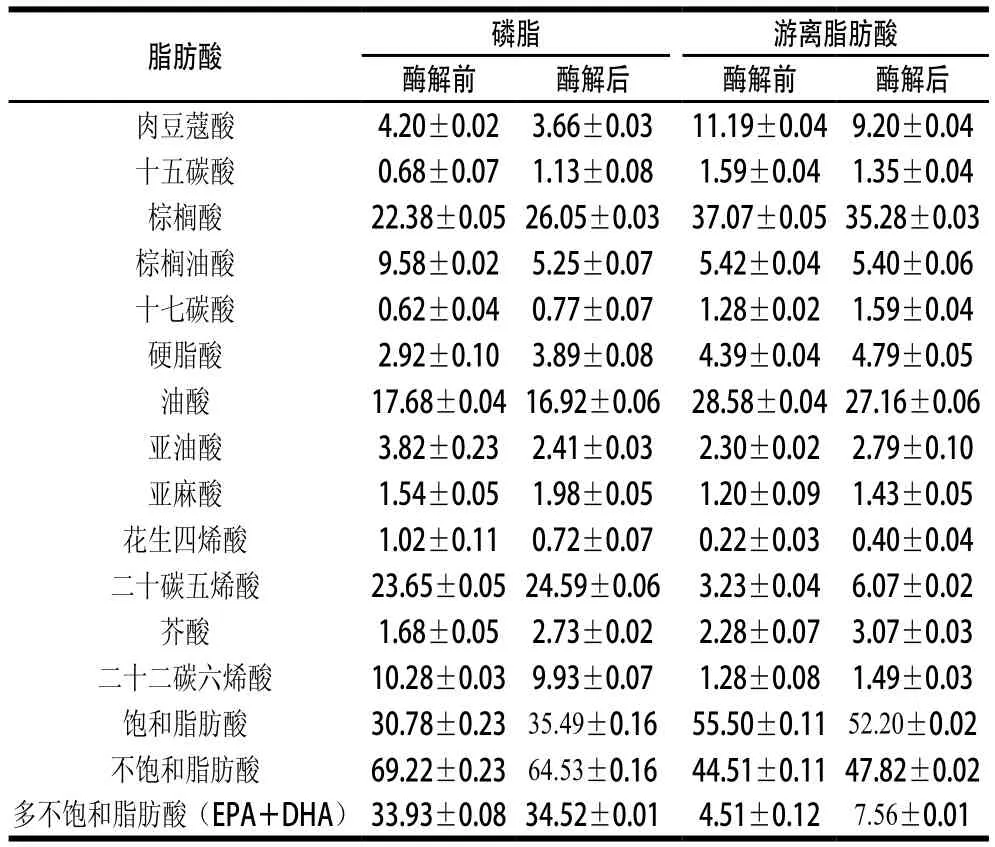
表2 南极磷虾磷脂酶解前后脂肪酸组成分析Table 2 Fatty acid composition of phospholipids before and after enzymatic hydrolysis%
从表2可以看出,酶解后磷脂的脂肪酸组成中EPA和DHA含量几乎没有变化,而游离脂肪酸(free fatty acid,FFA)中EPA和DHA含量有所上升,且酶解后磷脂的不饱和脂肪酸含量有所降低,饱和脂肪酸含量有所上升。说明在酶解过程中,有部分EPA和DHA被水解下来,但由于磷脂中EPA和DHA含量几乎没有变化,很有可能是结合在Sn-1位的EPA和DHA被酶解下来,也有可能是少量PE上的EPA和DHA被酶解下来,且其他不饱和脂肪酸也被酶解下来,所以导致酶解后磷脂中饱和脂肪酸含量升高。结合图2时间对酶解影响的结果,可以得出酶解后得到的Sn-2位溶血磷脂中EPA和DHA含量较高[25-27]。
2.6 酶解前后磷脂乳化稳定性

图6 酶解前后磷脂的乳化稳定性Fig. 6 Emulsion stability of phospholipids before and after enzymatic hydrolysis
从图6可以看到,酶解后磷脂的乳化稳定性得到提高,且随着时间的延长,稳定性优势越明显。这主要是由于磷脂被PLA1水解后生成了亲水性更强的溶血磷脂。这是由于酶改性南极磷虾磷脂保留了普通磷脂的双亲两性结构,并且由于非极性基团的减少而增强了亲水性能[33],由此溶血磷脂一定程度上改变了由于HLB值偏小而致普通磷脂应用范围受限制的状况,更加适合用作O/W型乳化剂[34]。
3 结 论
在水相体系中利用LPA1酶解南极磷虾磷脂得到富含EPA和DHA的溶血磷脂。结果表明:加酶量对酸价的影响呈现先上升后下降的趋势。随着酶解时间的延长,Sn-2-LPC含量先增加后趋于平衡(30 min),Sn-1-LPC含量先升高后降低,这是由于部分Sn-2-LPC发生酰基位移生成Sn-1-LPC,而Sn-1-LPC又进一步被LPA1酶解生成GPC,且在较短酶解时间内,温度对酰基位移的影响不大。最后通过GC-MS分析得出酶解产物Sn-2-LPC中EPA和DHA含量较高,且其乳化稳定性也得到提高。
