β-环糊精与香芹酮形成常数的测定及其包合物的制备及表征
2019-07-04薛硕董曼张璐璐尹凯静王琳任婧楠潘思轶范刚
薛硕,董曼,张璐璐,尹凯静,王琳,任婧楠,潘思轶,范刚*
1(华中农业大学 食品科技学院,环境食品学教育部重点实验室,湖北 武汉,430070) 2(湖北省食品质量安全监督检验研究院,湖北 武汉,430075)
香芹酮(carvone)是留兰香油的主要成分,香气清新,令人愉悦。可作为香精香料应用到食品(硬糖、口香糖和各种饮料等)以及日化品(肥皂、牙膏、洗发水和一些化妆品等)行业中[1]。主要作用为调节风味,并且香芹酮也具有一定的抗氧化性,所以也可以作为用于食品保藏的天然保鲜剂[2]。但是由于香芹酮易挥发,且水溶性较差,为了增强其在应用过程中的稳定性,可以将其包埋为性质较为稳定的包合物。而环糊精是最简单的包合材料之一,其具有亲水的外表面和中空疏水的内表面,无论在固体状态还是在水溶液中,都具有与疏水分子形成非共价包合物的能力[3]。在食品科学领域,环糊精通常被用来提高热加工食品中风味的保留率,或者用于精油的缓释,或者用于改善不同果汁的颜色或者香气,此外,精油与β-环糊精制备的微胶囊也在烹饪学中被广泛应用,以期改善食品的感官特性[4]。若将香芹酮与环糊精制成固态包合物,则可在一定程度上提高香芹酮的稳定性、水溶性,降低其挥发性,且具有一定的缓释功能,从而提高其利用效率。然而在环糊精的实际应用中,应当考虑包合物的解离平衡和化学计量,当环糊精包合物溶解于水中时,它与包合物在平衡状态下分解成自由组分,而形成常数(Kf)是可以评价包合物的结合强度和理化性质的有用指标[5]。形成常数的测定方法有很多,比如紫外可见分光光度法[6]、静态顶空气相色谱法[7]以及相溶解度法[8]等,都可以用于测定环糊精与挥发性风味化合物形成包合物的形成常数。本研究选用了在静态顶空气相色谱法基础上改进的SPME-GC-MS法进行了香芹酮与β-环糊精之间的形成常数的测定,证明了香芹酮能与β-环糊精形成1∶1的包合物。并用共沉淀法制备了环糊精与香芹酮的包合物,对包合物进行一系列表征,进一步证实了包合物的形成。
1 材料与方法
1.1 材料与试剂
β-环糊精(分析纯),上海源叶生物科技有限公司;香芹酮(分析纯),美国Sigma-Aldrich公司;无水乙醇,国药集团化学试剂有限公司。
1.2 仪器与设备
T-10000电子天平,美国双杰集团有限公司;5417R高速冷冻离心机,德国Eppendorf公司;KQ-300DE型数控超声波清洗机,昆山超声公司;Beta2-8LD真空冷冻干燥机,德国Christ公司;6890N气相色谱仪,美国Agilent公司;6890N/5975B气相色谱-质谱联用仪,美国Agilent公司;蔡司MERLIN Compact超高分辨率场发射扫描电镜,德国卡尔蔡司股份公司;Nexlus傅里叶变换红外光谱仪,瑞士Mettler Toledo公司;D8 ADVANCE多晶X射线粉末衍射仪,德国布鲁克仪器有限公司;热重分析仪,瑞士Mettler Toledo公司。
1.3 β-环糊精与香芹酮在水溶液中保留率和形成常数的测定
首先制备浓度为0、1、4、7、10 mmol/L的β-环糊精溶液,每个浓度制备3个平行。香芹酮的加入量保持不变(即将1 μL的香芹酮分别加入到100 mL不同浓度的环糊精溶液中),密封完全后,放置于25 ℃的恒温摇床中,以200 r/min的速度振荡30 min,振荡后吸取10 mL于22 mL的气相萃取瓶中,用聚四氟乙烯盖密封后将固相微萃取头通过隔垫插入顶空瓶,于磁力搅拌器中(25 ℃)平衡15 min,平衡后,推出纤维头顶空吸附40 min,萃取好后用GC-MS分析,测得香芹酮峰面积,每个浓度梯度的测定都进行3次。
GC-MS条件[9]:采用HP-5 MS弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);载气(He)流速1.2 mL/min;进样口温度250 ℃;升温程序:40 ℃保持3 min,以3 ℃/min升至160 ℃,保持2 min,最后以8 ℃/ min升至220 ℃,保持3 min。
质谱条件:接口温度250 ℃;离子源EI源;离子源温度230 ℃;四极杆温度150 ℃;电子能量为70 eV;扫描范围m/z50~550。
1.3.1 β-环糊精对香芹酮的保留率[10]
保留率可由公式(1)计算得出:
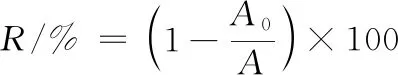
(1)
式中:A0和A分别代表在浓度为0和10 mmol/L的β-环糊精溶液中测出的香芹酮的峰面积;R为保留率。
1.3.2 β-环糊精与香芹酮的形成常数的测定
本研究中形成常数的测定参考了CIOBANU等[5]、BLACH等[11]、FOURMENTIN等[12]、LANDY等[13]的静态顶空气相色谱(static headspace gas chromatography, SH-GC)法,并进行了修改,实验中用顶空固相微萃取法代替了顶空萃取,用GC-MS代替了GC法。测出定量的香芹酮(1 μL)加入到100 mL的不同浓度(0、1、4、7、10 mmol/L) 的β-环糊精溶液中,测出香芹酮峰面积的大小,并根据以下推导过程计算出香芹酮与β-环糊精之间的形成常数。首先环糊精与香芹酮分子在水溶液中形成包合物是一个动态平衡过程。假设二者以化学计量比1∶1相互结合时,即公式(2):
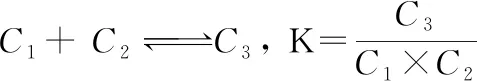
(2)
式中:C1,C2,C3分别代表香芹酮、β-环糊精及其包合物的平衡浓度,K为包合平衡常数。假设起始β-环糊精浓度为C0,香芹酮的起始浓度为C,所以公式(2)可以写为公式(3):

(3)
由于使用的β-环糊精的量远大于香芹酮的量,所以C0≈C2,则公式(3)可以写为公式(4) :

(4)
1.4 物理混合物和包合物的制备
由于香芹酮的挥发性强,普通条件干燥易脱包,因此选择了冷冻干燥法来制备,准确称取1.135 g的β-环糊精于锥形瓶中,加入100 mL蒸馏水后溶解,用移液枪准确移取165 μL香芹酮,使两者摩尔比为1∶1,将香芹酮逐滴加入环糊精溶液中,将得到的混合物放置于25 ℃的恒温摇床中,以300 r/min的速度振荡24 h,取出后将其置于4 ℃冰箱中放置24 h,使得包合过程充分进行,预冻后进行冷冻干燥,将最后得到的粉末密封完全后,置于4 ℃冰箱中待用[6]。
准确称量1.135 g的β-环糊精,吸取165 μL的香芹酮,使两者的摩尔比为1∶1,将两者置于玛瑙研钵中研磨,直到两者充分混合均匀,即得到了β-环糊精与香芹酮的物理混合物。
1.5 包合物中香芹酮包合率的测定[14]
1.5.1 标准曲线的测定
将适量的香芹酮加入到无水乙醇中,配制成0.1、0.2、0.3、0.4、0.5、0.6 μL/ mL的无水乙醇溶液。应用气相色谱法分析得出相应的峰面积,以香芹酮的体积浓度为横坐标,以测得香芹酮的峰面积(Y)与对应的香芹酮的体积浓度(X)进行线性回归,得相应回归方程为:Y=2 370.9X-205.32,R2=0. 994。
1.5.2 气相色谱条件
色谱柱:HP-5毛细管柱(30 m × 0.32 nm,0.25 μm);分流比为50∶1;检测器为FID;进样口温度和检测器温度分别为250、270 ℃。升温程序:40 ℃ 保持1 min, 以6 ℃/min升至220 ℃,保持1 min,再以30 ℃/min升至250 ℃,液体进样量为1.0 μL。
1.5.3 包合物中香芹酮的提取
准确称量20 mg的包合物,加入5 mL无水乙醇,密封后混匀,并于60 ℃条件下超声处理30 min,使得香芹酮从β-环糊精的空腔中转移到无水乙醇中。然后4 200 r/min离心处理5 min以获得澄清的上清液,过滤膜后用气相色谱分析得出相应的峰面积,使用回归方程计算出包合物中香芹酮的含量。
1.5.4 包合率的计算
包含率计算如公式(5)。

(5)
1.6 包合物的表征
1.6.1 扫描电镜
对单纯的β-环糊精以及包合物进行扫描电镜测试[15]。将样品固定在样品台上,喷镀铂金后3.0 kV条件下进行观察,放大倍率为600、6 000倍。
1.6.2 红外光谱分析
红外光谱分析用溴化钾压片法进行[16],β-环糊精、物理混合物及包合物粉末在干燥状态下用玛瑙研钵充分研磨并与KBr混合均匀。压成1 mm厚的薄片后进行扫描。香芹酮液体的测定采用KBr涂膜法,即滴加少量香芹酮于2片空白溴化钾片中,压成薄膜后进行扫描。扫描波数为400~4 000 cm-1。
1.6.3 X-衍射分析
分别对β-环糊精、物理混合物及包合物进行X-衍射测试[15]。测定条件为Cu Kα射线、管电压40 kV、管电流200 mA,扫描3~40°、扫描速率8°/min、步长0.02°。
1.6.4 热重分析
分别对香芹酮液体、β-环糊精、物理混合物及包合物进行TGA分析[17-18]。升温:40~500 ℃,升温速率:10 ℃/min,N2保护;实验前对TG装置进行校准,每次运行前用N2清洗30 min。
1.7 数据处理
由3次平行实验测定得到的各实验平均值及标准偏差采用Microsoft Office Excel 2016进行计算,并用Origin 85软件作图。
2 结果与分析
2.1 香芹酮与环糊精的保留率及其形成常数
2.1.1 香芹酮与β-环糊精的保留率
在相同实验条件下进行了3次实验,保留率分别为80.7%、85.91%、82.16%,平均值为82.94%,平均偏差为0.26%,由此可以表明,香芹酮与β-环糊精有形成包合物的趋势,因为β-环糊精对香芹酮表现出了较好的保留能力。
2.1.2 香芹酮与β-环糊精之间的形成常数
用Origin进行方程拟合发现,根据理论,测试点构成一条回归直线(Y=1 066.7X+1),R2=0.99。说明β-环糊精与香芹酮形成了1∶1的包合物。而形成常数Kf等于回归直线的斜率,则Kf=1 066.7 mol-1(图1)。

a-实际数据点;b-包含物的理论曲线图1 实验实际测出的数据点与当Kf=1 066.7 mol-1时β-环糊精与香芹酮形成1∶1的包合物时的理论曲线Fig.1 Representation of the experimental points obtained for carvone and β-cyclodextrin compared with theoretical titration curve for a 1∶1 complex
2.2 固体包合物的表征
2.2.1 包合率的测定
在相同实验条件下进行了3次实验,包合率分别为74.75%、72.3%、78.0%,平均值为75.04%,平均偏差为2.89%,由此可以表明,香芹酮与β-环糊精的匹配性良好,由冷冻干燥法得到的包合物包合效果良好,用β-环糊精作为香芹酮的包埋壁材有很好的发展前景。
2.2.2 扫描电镜分析
通过扫描电镜我们可以观察到单纯的β-环糊精与包合物的大小以及表面形态有很大差异。在相同的放大倍数下,2种物质都表现出明显的晶体状态,但是包合物的体积明显比单纯的β-环糊精小;而且两者的表面形态也完全不同,包合物的晶体聚集程度更高一些。单纯的β-环糊精的表面较为松散、大多不规则,而且表面有些凸凹不平,恰好适合对小分子物质进行包合[19]。而包合物的表面更加光滑平整,且呈现出规则的立方体形态,这些说明包合物是一种新的物相,而且存在状态比较稳定[20]。
2.2.3 红外光谱分析
图2为香芹酮、β-环糊精、物理混合物及包合物的红外光谱图。从香芹酮的红外光谱可以看出,香芹酮在2 922.28 cm-1处有C—H的伸缩吸收振动峰;在1 669.90 cm-1处有C═O的特征峰,在1 365.88、1 245.57 cm-1处有C—C的伸缩振动峰,在1 109.81 cm-1处有C—C的伸缩振动吸收峰。β-环糊精主要在3 375.1cm-1处有缔合O—H的伸缩振动吸收峰;在2 929.18 cm-1处有C—H的伸缩振动吸收峰;在1 643 cm-1左右有H—O—H吸收峰;在1 156.91和1 028.46 cm-1处有C═C的伸缩振动吸收峰[21]。
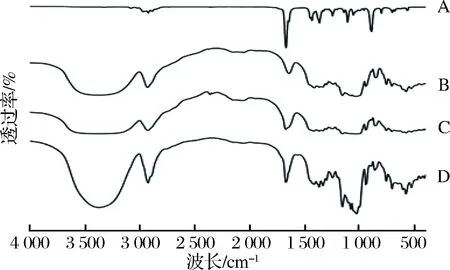
A-香芹酮;B-β-环糊精;C-物理混合物;D-包合物图2 香芹酮、β-环糊精、物理混合物及包合物红外光谱图Fig.2 IR spectrums of carvone, β-cyclodextrin, physical complex and their inclusion complex
物理混合物与单纯的β-环糊精相比,吸收峰的位置基本相同,吸收强度有所差异(可能是由于压片过程中取样的多少导致的),而没有香芹酮的特征峰出现可能是因为香芹酮极易挥发,取样量又很少,在制样过程中几乎全部挥发导致的。而β-环糊精包合物的红外光谱图表现与单纯的β-环糊精相似,而与对应的单纯的香芹酮的红外光谱图存在很大差异。
与单纯的香芹酮相比,包合物中香芹酮在1 365、1 246 cm-1处吸收减弱,这可能是因为客体分子在环糊精包合物中的质量分数较小,吸收峰被大量的环糊精吸收峰遮蔽,红外光谱图吸收的变化说明,β-环糊精与香芹酮主客体间虽然形成了包合物,但是未发现新的吸收峰,说明β-环糊精与香芹酮之间是物理性结合而不是化学性结合[22]。同时,在结合后香芹酮的特征峰发生了一定程度的偏移,说明包埋过程对香芹酮产生了影响[23]。
2.2.4 X-衍射分析
由图3可以看出,3种物质皆有多且尖锐的衍射峰,说明它们都包含多种不同拟晶态的物质。其中单纯的β-环糊精与物理混合物的衍射峰除了衍射峰的强度有些差别外,衍射峰的位置及数量几乎没有差异,这可能是由于本次试验中的客体分子香芹酮为挥发性的液体,不会产生衍射峰,因此物理混合后并不会改变β-环糊精的结晶状态,而比较β-环糊精及其包合物的谱图发现,包合物的衍射峰却明显不同于环糊精。环糊精在2θ=4.50、8.88、10.6、12.46、16.96、20.72、22.7、24.28、27.05°等处出现衍射峰,而包合物并没有这些峰且在2θ=6.52、9.38、14.88、18.1、25.7、30.1°等处出现新的衍射峰,说明香芹酮与β-环糊精形成包合物后晶态发生了变化,新的物相产生[24]。而且由图3还可看出,包合物的衍射峰数量没有β-环糊精的多,但是峰较宽,可以判断包合物的结晶程度低于β-环糊精。
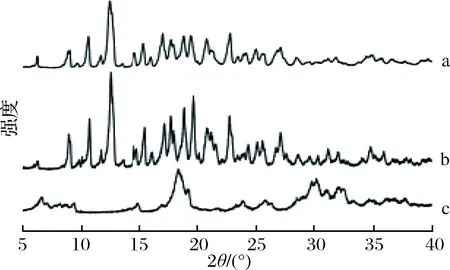
a-β-环糊精; b-物理混合物;c-包合物图3 β-环糊精、物理混合物及包合物的X-射线衍射图Fig.3 X-ray diffraction patterns of β-cyclodextrin, physical complex and inclusion complex
2.2.5 热重分析
热重分析(TGA)主要是用于评价包合物中香芹酮的热稳定性和挥发性[25],由图4可知,香芹酮在40~220 ℃迅速损失质量,质量损失高达99.59%,这是由于香芹酮极易挥发的性质导致。β-环糊精存在2个失重阶段,分别为50~100 ℃和325~375 ℃。

a-香芹酮; b-β-环糊精; c-物理混合物和d-包合物;A-TGA图;B-DTG图图4 香芹酮、β-环糊精、物理混合物和包合物的TGA和DTG分析图Fig.4 The TGA and DTG profiles of carvone, β-CD, physical mixture and inclusion complex
第一个是水分的蒸发(损失13.59%),第二个是由于β-环糊精的分解引起的。而物理混合物在40~130 ℃存在2个失重阶段,第一个阶段比单纯的β-环糊精中水的蒸发引起的失重温度要低,速度也更快一些,证明是由于β-环糊精的水分蒸发与香芹酮的挥发共同引起的(损失14.43%),第二个阶段是香芹酮的继续挥发引起的(损失5.92%),这2个阶段的损失比单纯的β-环糊精在此温度范围内的质量损失增加了6.76%,而且混合物在280 ℃开始分解,最大分解温度为312 ℃,与单纯的β-环糊精基本相同,说明香芹酮与β-环糊精只是简单的物理混合,没有形成包合物。而虽然包合物也有3个失重阶段,但是失重阶段的范围却和物理混合物有所差别,130 ℃前是水分蒸发,130~325 ℃阶段的失重是由于香芹酮的挥发引起的,而单纯的香芹酮和物理混合物中的香芹酮的失重分别发生在60~220 ℃和100~150 ℃。且包合物中β-环糊精最大分解温度(280 ℃)比单纯β-环糊精低32 ℃,这可能是因为香芹酮进入了β-环糊精空腔内,影响了β-环糊精在加热过程中的稳定性导致,这些变化表明,香芹酮与β-环糊精发生了作用,形成了包合物[26]。
3 结论
根据实验结果,确定冷冻干燥法制备的包合物的保留率为75.05%,β-环糊精与香芹酮之间的形成常数为1 066.7 mol-1,证明香芹酮与β-环糊精之间形成了1∶1的包合物。由气相色谱法确定冷冻干燥法制备的包合物的包合率为(75.04±2.89)%,证明冷冻干燥法制备的包合物包埋效果良好。对所制备的香芹酮包合物进行扫描电镜、红外光谱、X-衍射以及热重分析,结果均表明,包合物与单纯的β-环糊精的特性不同。通过扫描电镜得知,β-环糊精包埋前后晶体的大小以及表面形态都发生了变化,通过红外光谱分析得出,包合物中既没有香芹酮的特征吸收峰,也未出现新的吸收峰,表明香芹酮与环糊精的包合物的形成没有发生化学反应;通过X-衍射分析得出,环糊精与包合物的结晶状态不同,表明包合物是一种新的物相。热重分析结果表明,β-环糊精与香芹酮发生了作用,不是简单的物理混合,而是形成了包合物,香芹酮的热稳定性得到了提高。
