诃子多酚清除DPPH自由基的光谱学研究
2019-07-03李晓芬熊华斌张海芬字园丽张言高云涛张艳丽
李晓芬 熊华斌 张海芬 字园丽 张言 高云涛 张艳丽

摘要:对天然抗氧化活性成分诃子多酚和DPPH自由基的紫外-可见吸收光谱特征进行了研究。确定了诃子多酚清除DPPH自由基反应体系的测定波长和反应时间。研究了诃子多酚清除DPPH自由基的活性,获得了诃子多酚清除DPPH自由基的半数抑制浓度IC50值为没食子酸(0.000 92 mg/mL)<咖啡酸(0.003 43 mg/mL)<香草酸(0.55 mg/mL)<对香豆酸(2.27 mg/mL),其中没食子酸和咖啡酸的活性明显优于芦丁。表明没食子酸和咖啡酸是诃子多酚中主要的抗氧化活性成分。
关键词:诃子多酚;DPPH自由基;紫外-可見吸收光谱;抗氧化活性
中图分类号:Q5 文献标识码:A
文章编号:0439-8114(2019)08-0121-05
DOI:10.14088/j.cnki.issn0439-8114.2019.08.028 开放科学(资源服务)标识码(OSID):
Abstract: The UV-Vis absorption spectrum of Terminalia polyphenol which is natural antioxidant and DPPH free radicals was investigated,and the determination wavelength and the time for the reaction of Terminalia polyphenol with DPPH free radicals were optimized. Furthermore,the DPPH free radical scavenging activity of Terminalia polyphenol was evaluated. In the optimized systems,the half inhibitory concentration (IC50) of four Terminalia polyphenol against DPPH was ranked as follows: gallic acid(0.0009 2 mg/mL)﹤caffeic acid(0.003 43 mg/mL) Key words: Terminalia polyphenol; DPPH free radicals; ultraviolet-visible absorption spectrum; antioxidant activity 自由基氧化损伤是现代许多重大疾病的源泉,也是引起机体衰老的根本原因[1-3]。天然产物清除自由基的抗氧化剂活性研究是目前研究的热点[4,5]。国内外报道的测定抗氧化物质清除自由基的方法主要包括分光光度法、化学发光法、电子自旋共振法、电化学检测法、气相色谱法、荧光法和高效液相色谱串联质谱法等[6-11]。DPPH自由基(1,1-diphenyl-2-picrylhydrazyl)是一种稳定的人工合成自由基,在517 nm处有一典型的特征吸收峰,当反应体系中有抗氧化剂存在时,能与未成对的电子配对而使其特征吸收逐渐消失,褪色程度与其所接受的电子数成定量关系,因而可用分光光度法进行定量分析[12]。通常利用DPPH自由基的褪色反应计算自由基清除率,目前,DPPH自由基清除试验被广泛用于天然植物抗氧化活性的研究,具有稳定、快速、简便、可靠等优点[13-19]。 诃子(Terminalia),又名诃黎、诃黎勒、随风子,为使君子科榄仁树属植物,主要分布于中国云南、广东、广西以及缅甸[20]。在藏药学经典著作《晶珠本草》中,诃子被称为“藏药之王”[21]。诃子醇提物主要富含多酚类物质,具有良好的抗氧化活性以及明显的抑菌、抗癌和抗衰老等功效[22,23]。利用DPPH自由基褪色反应研究植物多酚的抗氧化研究已有报道[24,25],但诃子多酚清除DPPH自由基反应体系的的研究尚未见报道。 本研究以富含植物多酚的藏药诃子为研究对象,对天然抗氧化活性成分诃子多酚和DPPH自由基的光谱学特征进行了研究,并利用光谱法研究没食子酸与DPPH自由基反应的动力学过程,优化了反应体系,并测定了植物多酚(没食子酸、咖啡酸、香草酸对香豆酸)的DPPH自由基清除活性,为诃子的药理活性研究提供了科学依据。 1 材料与方法 1.1 试验材料 1.1.1 材料 诃子购于菊花村中药材市场(产于缅甸),经筛选除杂质后粉碎过80目筛。 1.1.2 仪器 Agilent 1200 Series HPLC(美国安捷伦公司);8453型UV-Vis分光光度计;AS3120A型超声清洗器(天津奥特赛恩斯仪器有限公司);旋转蒸发仪(上海亚荣生化仪器厂);层析柱(40 mm×10 mm);恒温水浴锅。
1.1.3 试剂 DPPH(1,1-二苯基-2-苦基肼),芦丁标准品购于Sigma公司。标准品没食子酸、咖啡酸、香草酸和对香豆酸(国药集团,纯度>98%);AB-8型大孔吸附树脂(南开大学化工厂);所用试剂均为分析纯。
1.2 试验方法
1.2.1 诃子多酚粗提取液的制备[26] 准确称取10.0 g诃子粉末,按1∶27的料液比加入270 mL 60%乙醇室温下超声浸提60 min,将提取液抽滤,滤液蒸发浓缩后得诃子多酚提取物浸膏,真空低温干燥至恒重备用。
1.2.2 訶子多酚精提取液的制备
1)AB-8树脂的预处理[27]。大孔树脂用95%乙醇浸泡24 h,溶胀后用乙醇冲洗至无白色浑浊液流出,用去离子水洗尽乙醇后分别用5% HCl和5% NaOH浸泡8 h,再用去离子水洗至中性,浸泡于去离子水中备用。
2)诃子粗多酚的分离纯化。将诃子多酚粗提取物加适量蒸馏水溶解后过柱,上柱料液浓度1.0 mg/mL,pH 6.0。用80%乙醇进行洗脱,解吸速率为4.0 BV/h,洗脱体积为3.0 BV。洗脱液经抽滤后蒸发浓缩,真空干燥至恒重备用。
1.2.3 标准储备液的配制 准确称取没食子酸1.0 mg、咖啡酸1.0 mg、香草酸0.5 g、对香豆酸0.5 g,用无水乙醇溶液分别稀释定容至10 mL,摇匀,4 ℃保存备用;准确配制5.0×10-3 mol/LDPPH储备液,-20 ℃保存备用。
1.2.4 诃子醇提物主要成分分析 色谱条件:色谱柱:Agilent XDB-C18(4.6 mm×150 mm i.d,5 μm);柱温:25 ℃;流动相A:甲醇;流动相B:乙酸/水(1.0%,v/v);梯度洗脱程序:0~10 min(5% A),10~25 min(10% A),25~26 min(50% A),26~35 min(80% A),35.0~35.1 min(100% A)。溶剂A在40 min内由5%上升到80%,然后变为100%,并维持5 min,最后再返回到初始状态。流速:1.00 mL/min;进样量:20 μL;紫外检测器检测波长:280 nm。
1.2.5 DPPH稳定性试验 准确配制3份相同浓度的DPPH溶液,分别测定配制时及在室温下曝光触氧放置5 h和10 h后的紫外-可见吸收曲线。
1.2.6 DPPH自由基清除试验 准确移取4.5 mL DPPH标准液于10 mL比色管中,分别加入相同浓度不同体积的样品,空白管以4.5 mL DPPH标准液,分别用无水乙醇定容至5.0 mL,摇匀,置于室温下避光静置30 min,测定溶液在517 nm处的吸光度,并扫描UV-Vis光谱。清除率按下式计算:
式中,A0为空白管的吸光度;A样为样品管的吸光度。
2 结果与分析
2.1 诃子多酚提取物的成分分析
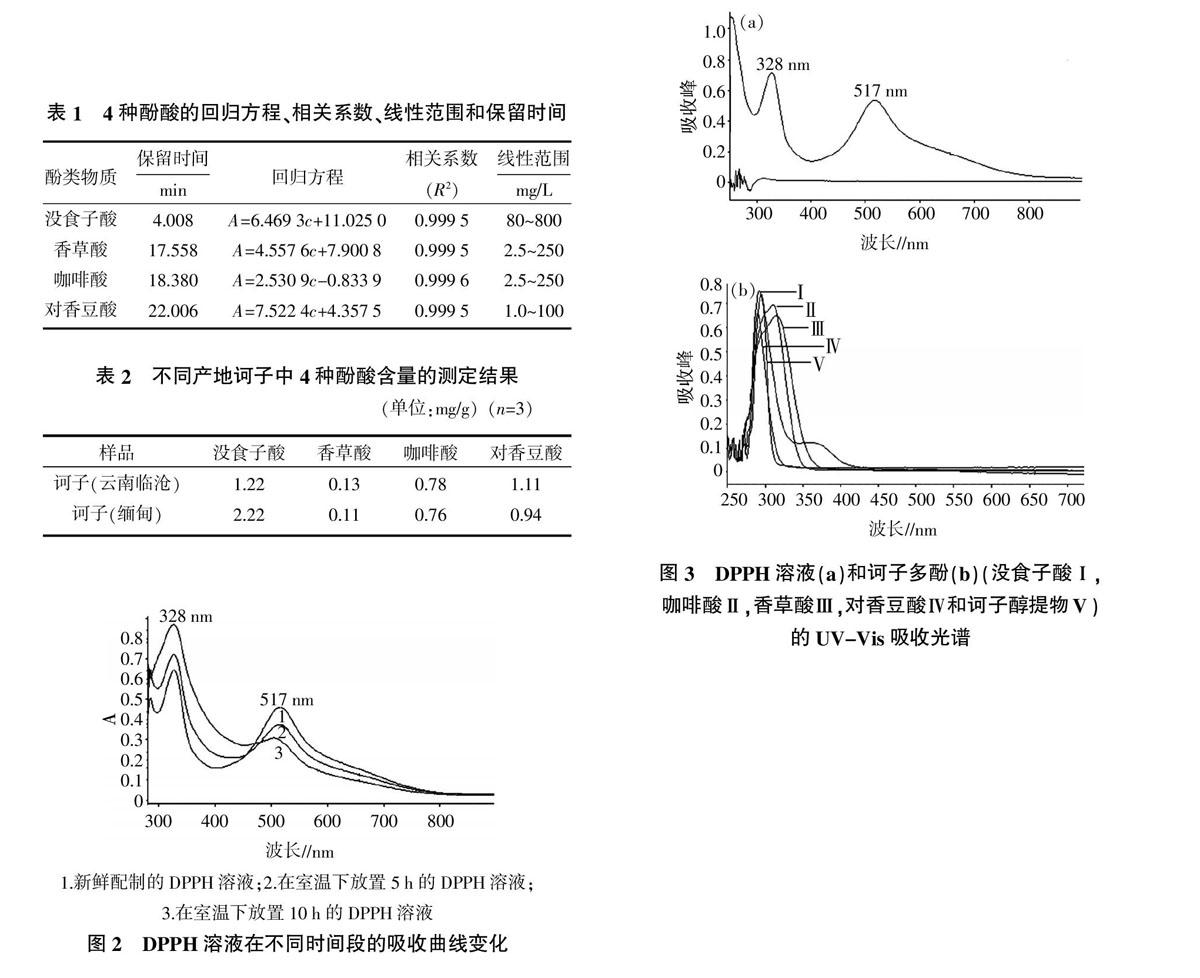
2.1.1 诃子多酚提取物的定性分析 在最佳色谱条件下测定4种酚酸标准品溶液的色谱图如图1(A)所示,诃子提取物的标准色谱图如图1(B)所示。结果表明,4种酚酸能够成功的彼此分离,所有的化合物在一定的浓度范围内具有较好的线性关系(R2>0.999)。
2.1.2 诃子多酚提取物的定量分析 准确称取不同产地的诃子多酚制备成供试品溶液,取20 μL滤液测定,用表1中的线性回归方程计算。对不同产地的诃子进行4种酚酸含量的测定,结果见表2。
2.2 DPPH稳定性试验
如图2所示,新配制的DPPH溶液吸收曲线(曲线1)在波长为328 nm和517 nm处有很强的特征吸收峰,517 nm处的吸光度随放置时间延长而迅速下降(放置10 h后降低了0.16),328 nm处吸光度随放置时间延长而上升(放置10 h后增加了0.22)。研究发现,DPPH溶液在1 h内具有良好的稳定性,但若在室温下放置过长,并且接触光和氧气后紫红色的DPPH溶液颜色会随着放置时间的增长而变浅,517 nm处的吸光度降低会更加显著。结果表明,光照和温度都会影响DPPH溶液的光吸收。因此,DPPH溶液的保存和测定都必须在低温避光条件下进行。
2.3 DPPH反应体系的UV-Vis吸收光谱研究
对DPPH自由基溶液和诃子多酚进行UV-Vis光谱扫描。结果如图3(a)所示,诃子多酚的吸收峰都集中在300 nm附近,与DPPH溶液在328 nm处的吸收峰存在叠加作用。但诃子多酚大于450 nm部分无吸收,因此不会对DPPH在517 nm处的吸收峰形成叠加,测定过程不产生光谱干扰。
在DPPH溶液中加入不同浓度诃子多酚,结果见图4,DPPH的A517 nm随诃子多酚浓度的增加而呈线性降低。而在328 nm处的吸收峰,不仅存在诃子多酚吸收峰的干扰,而且加入诃子多酚之后吸收度并没有变化,综合上述结果,选择517 nm作为DPPH自由基的测定波长。
2.4 诃子多酚清除DPPH自由基反应的动力学研究[28]
图5为反应时间对诃子多酚清除DPPH自由基反应速率的影响,在5.0×10-6 mol/L DPPH溶液中分别加入诃子醇提物和诃子酚酸后,对于抗氧化活性较强的样品如没食子酸、咖啡酸,体系的特征吸收峰A517 nm在10 min内呈显著下降趋势,10 min后基本趋于平衡,至30 min时A517 nm达到稳定状态,说明对于抗氧化活性较强的抗氧化剂,30 min是一个合适的、稳定的反应时间点;对于抗氧化活性较弱的样品如香草酸,对香豆酸,体系的特征吸收峰A517 nm在20 min内呈显著下降趋势,到30 min后体系基本趋于平衡,至60 min时,A517 nm达到稳定状态,说明对于抗氧化活性较弱的抗氧化剂,60 min是一个合适的、稳定的反应时间点。
4种酚酸达到最大清除率的时间为没食子酸(10 min)<咖啡酸(20 min)<香草酸(30 min)<对香豆酸(35 min)。
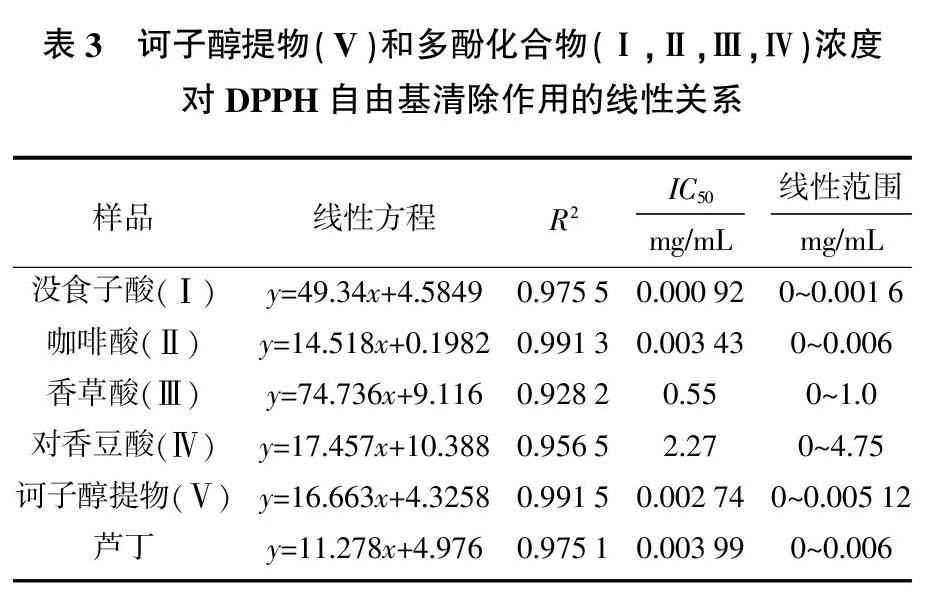
2.5 诃子多酚清除DPPH自由基活性
根据优化的测定波长和反应时间,测定系列浓度的诃子醇提物和多酚化合物对DPPH自由基的清除率,计算相应抗氧化剂的IC50值,并以芦丁作对比,评价其抗氧化活性。对于DPPH(图3)反应体系,在相应的质量浓度范围内,诃子醇提物和4种多酚化合物对自由基清除率有良好的线性关系,据此可计算其IC50值。
如表3所示,诃子醇提物和4种多酚化合物的IC50值分別为0.002 74、0.000 92、0.003 43、0.55、2.27 mg/mL,芦丁的IC50值为0.003 99 mg/mL,结果表明,诃子多酚对DPPH自由基具有良好的清除作用,其中没食子酸、咖啡酸和诃子醇提物的抗氧化活性优于芦丁。
3 结论
本文研究了诃子中3种多酚类物质清除DPPH自由基的能力及其光谱学特征。研究表明,分光光度法测定诃子多酚清除DPPH自由基的测定波长为517 nm,体系稳定时间分别为30 min(没食子酸、咖啡酸)和60 min(香草酸、对香豆酸)。诃子多酚具有良好的抗氧化活性,能有效、快速地抑制溶液中DPPH自由基的形成及其特征吸收峰。在优化的反应体系中,诃子醇提物和4种多酚化合物(没食子酸、咖啡酸、香草酸、对香豆酸)的IC50值分别为0.002 74、0.000 92、0.003 43、0.55、2.27 mg/mL,其中没食子酸和咖啡酸的活性明显优于芦丁,证明没食子酸和咖啡酸是诃子中主要的抗氧化活性成分。
参考文献:
[1] 方允中,郑荣梁.基生物学的理论与应用[M].北京:科学出版社,2002.1-58.
[2] 贝玉祥,郭 英,范逸平,等.诃子多酚清除活性氧自由基及体外抗氧化作用研究[J].云南民族大学学报(自然科学版),2009,18(1):51-54.
[3] LIU X F,ARDOB S,BUNNING M,et al.Total phenolic content and DPPH radical scavenging activity of lettuce (Lactuca sativa L.) grown in Colorado[J].LWT,2007,40(3):552-557.
[4] 戴 云,邱晓燕,何耀莹,等.齐墩果酸和熊果酸对DPPH自由基的清除作用[J].云南民族大学学报(自然科学版),2012,21(6):395-398.
[5] COTELLE N,BERNIER J L,CATTEAU J P,et al.Antioxidant properties of hydroxy-flavones[J].Free radical biology & medicine,1998,20(1):35-43.
[6] 文 镜,刘 璇,赵 建.荧光法及化学发光法在保健食品抗氧化体外实验中的应用[J].中国酿造,2009(11):130-133.
[7] 陈培榕,李景虹,邓 勃.现代仪器分析实验与技术[M].北京:清华大学出版社,2006.30-48.
[8] 丛建波,孙存普,莫 简.自旋捕集短寿命自由基的低温保存[J].生物化学与生物物理进展,1993,20(4):326-327.
[9] 程宏英,曹玉华.毛细管电泳-电化学检测法测定硫酸铜-维生素C反应体系中的羟基自由基和菊花的抗氧化活性[J].色谱,2007,25(5):681-685.
[10] ONO R,ODA T.Measurement of hydroxyl radicals in pulsed corona discharge[J].Journal of electrostatics,2002,55(3-4):333-342.
[11] 方玲玲,肖作兵,牛云蔚,等.超高效液相色谱串联质谱法测定樱桃酒中的5种酚酸[J].食品与发酵工业,2011,37(6):172-176.
[12] ZHANG Y B,ZHENG W J,HUANG Z. Investigation of the antioxidant activity of a novel synthetic selenadiazole derivative SPO against DPPH and ABTS free radicals[J].Spectroscopy and spectral analysis spectrometric,2010,30(7):1866-1871.
[13] 彭长连,陈少薇.用清除有机自由基DPPH法评价植物抗氧化能力[J].生物化学与生物物理进展,2000,27(6):658-661.
[14] 许申鸿,杭 瑚.一种筛选自由基清除剂的简便方法[J].中草药,2000,31(2):96-97.
[15] CALDWELL C R.Alkylperoxyl radical scavenging activity of red leaf lettuce (Lactuca sativa L.) phenolics[J].Journal of agriculture and food chemistry,2003,51(3):4589-4592.
[16] CAO G,SOFIC E,PRIOR R L.Antioxidant capacity of tea and common vegetables[J].Journal of agriculture and food chemistry,1996,44(7):3426 -3231.
[17] ZHENG S Y,CHEN T F,ZHENG W J.Spectrometric investigation of the antioxidant activities of Dangcong tea aqueous extracts against DPPH and ABTS free radicals[J].Spectroscopy and spectral analysis,2010,30(9):2417-2423.
[18] 王毅红,方玉梅,谭 萍,等.车前草黄酮类化合物清除DPPH自由基的作用[J].贵州农业科学,2010,38(8):50-52.
[19] 唐远谋,李明元,徐 坤,等.啤酒花多酚的提取及对DPPH自由基的清除作用[J].西华大学学报(自然科学版),2010,29(4):105-109.
[20] 江苏新医学院.中药大辞典[M].上海:上海人民出版社,1997.
1484-1485.
[21] 藏药之王-诃子[J].中国中医药杂志,2004,2(12):35.
[22] 赵扬帆,郑宝东.多酚类物质及其功能学研究进展[J].福建轻纺,2006,11(2):107-110.
[23] CHMIH H,CLLARD J,CLLARD P,et al. Peroxyl and hydroxyl radical scavenging activity of some natural phenolic antioxidant[J].Journal of the American oil chemical society,1991,68(2):307-312.
[24] 郭丽萍,卢家炯,仇宏伟,等.香蕉皮多酚清除自由基作用的初步研究[J].食品科技,2007,8(6):131-134.
[25] 唐远谋,李明元,徐 坤,等.啤酒花多酚的提取及对DPPH自由基的清除作用[J].西华大学学报(自然科学版),2010,29(4):105-109.
[26] 贝玉祥,郭 英,范逸平,等.诃子中总多酚含量的测定及其超声提取工艺的研究[J].生物技术,2008,18(2):82-84.
[27] 刘硕谦,刘仲华,黄建安,等.大孔吸附树脂分离富集水皂角多酚[J].食品科学,2004,25(3):55-60.
[28] LIN L Z,ZHAO M M.Effect of reaction time on DPPH and ABTS+radical scavenging assays for antioxidant capacity evaluation[J].Food chemistry,2010,31(5):63-65.
收稿日期:2018-09-14
基金項目:云南省应用基础研究计划项目(2017FD118);国家自然科学基金项目(201367025)
作者简介:李晓芬(1986-),女,云南大理人,讲师,硕士,主要从事民族药抗氧化研究,(电话)13577062851(电子信箱)wjplxf24@163.com; 通信作者,高云涛,教授,(电话)0872-65913041(电子信箱)2314972096@qq.com。
