鹿角DNA提取方法研究
2019-07-03王磊张然然王洪亮李洋胡鹏飞帕尔哈提邢秀梅
王磊,张然然,王洪亮,李洋,胡鹏飞,帕尔哈提,邢秀梅
(中国农业科学院特产研究所特种经济动物分子生物学重点实验室,长春 130112)
鹿茸是现今发现的唯一一种可以完全周期性脱落再生的哺乳动物器官,每年春天鹿角脱落,鹿茸开始生长,春末夏初进入快速生长阶段,生长速度可达2cm/d,入秋后骨沉积速度明显增加,茸皮逐渐脱水收紧失去光泽,最终脱落成为干角,至下一年春天鹿角脱落,完成一次生长周期。鹿角为硬骨组织,加之9月茸皮脱落后已经彻底骨化成为死组织,直至来年3月才开始脱落,DNA含量少且降解严重,提取难度大。目前,骨、牙齿以及古DNA主要提取方法有Chelex-100法、酚仿抽提法、碱裂解法、二氧化硅(硅粒)法、试剂盒法[1-2]。贾东涛等[3]以1~16年骨骼为材料,用高温进行脱钙处理,经SDS-PK、GUSCN裂解后,用硅珠纯化得到高质量DNA,STR分型成功率高达95.5%。刘冉冉等[4]采用改进异丙酮沉淀法提取4300~3900年前猪牙DNA,经尿嘧啶糖苷酶(UNG)清除损伤DNA,得到优质DNA模板。吴微微等[5]用十六烷基三甲基溴化铵(CTAB)提取23例骨骼DNA,获得14个STR分型。宋振等[6]用Handy-EcoKingfsher法、Freeze-millKingfsher法分别提取345例和32例骨、牙齿DNA,获得优质DNA,成功率99.42%、96.97%。试剂盒法主要有Identifilerplus试剂盒、MiniFiler试剂盒、GodeneyeTM20A试剂盒[7]、TissueLyser-II组织破碎仪和PreFilerExpress BTATM法医DNA提取试剂盒[8]、QIAampDNA Mini Kit[9],均有较高的DNA提取率,并且DNA模板质量大多符合后续试验要求。
本实验旨在通过化学试剂提取法(酚-氯仿、改良酚-氯仿)、试剂盒提取法〔DNeasyBlood & Tissue Kit(50)、QIAampDNA Investigator Kit(50)〕提取鹿角不同部位DNA,以DNA电泳条带优劣为依据,确定鹿角DNA取样部位以及最适提取方法,为鹿角DNA的提取工作提出合理化建议。
1 材料与方法
1.1 材料
2018年8月,自吉林省辽源市东丰县采购鹿角,共计63支。清水刷净表面污垢,75%乙醇擦拭后置于阴凉通风处,编号备用。
1.2 仪器与试剂
1.2.1 主要试剂 Tris饱和酚、50 TAE缓冲液(Sangon Biotech公司);氯仿、异丙醇(北京试剂公司);无水乙醇(国药集团化学试剂有限公司);组织试剂盒〔DNeasyBlood & Tissue Kit(50),NO.69504〕、骨试剂盒〔QIAampDNA Investigator Ki(t 50),NO.56504〕(Qiagen公司);Marker 15000bp(TaKaRa公司);Agarose(Transgen Biotech 公司)。
1.2.2 主要仪器 离心机(Sigma公司);电泳仪(Junyi公司);恒温混匀仪(Eppendorf公司)。
1.3 方法
1.3.1 取样 用钢锯从YC 1~17、YC 19~25号鹿角基部取样,分别编号为 YC基1~17、YC基19~25;从YC1~17、YC19~25,D1、3、4,D6~10,L2~7,TH,W1、2、7,Z1~5,Z7~14,Z18~24,Z27号鹿角中部取样,分别编号为YC中1~17,YC中19~25,D1、3、4,D6~10,L2~7,TH,W1、2、7,Z1~5,Z7~14,Z18~24,Z27。所有样品用液氮研磨后备用。
1.3.2 化学试剂提取法 酚-氯仿法:分别取 YC基1~17,YC基19~25,YC中1~17,C中19~25,D1、D 3、D 4、D 6~10,L2~7,TH,W1、W 2、W 7,Z 1~5 样品70 mg于1.5 mL离心管中,加入600L细胞裂解液、20L20 mg/mL蛋白酶K,900 r/min 56℃过夜消化。加入等体积酚∶氯仿(1∶1),混匀,室温12 000 r/min离心5min,取上清于新1.5mL离心管中,重复操作2次。加入1倍体积异丙醇,混匀,室温12 000 r/min离心2 min,弃上清。加入1 000L冰浴70%乙醇,颠倒混匀,室温12000r/min离心1min,弃上清。开盖,65℃干燥5min,加入60L去离子水,65℃溶解15min,取4L进行1%琼脂糖凝胶电泳(120V,30min),剩余样品 20℃保存。
改良酚-氯仿法:分别取YC中1~17、YC中19~25号样品70 mg于1.5 mL离心管中,加入600L细胞裂解液、20L 20 mg/mL蛋白酶K,900 r/min 56℃过夜消化。室温12 000 r/min离心10 min,取上清于新离心管中,加入等体积Tris-饱和酚,混匀10 min,12 000 r/min离心10 min。取上清于新离心管中,加入等体积酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀10 min,12 000 r/min离心10 min,取上清于新离心管中,重复 1次。上清中加入等体积氯仿∶异戊醇(24∶1),颠倒混匀,10 min,12000r/min离心10min,取上清于新离心管。上清中加入0.6~1.0倍体积的异丙醇,颠倒混匀至出现白色絮状沉淀,12000r/min离心5min,弃上清。加入1000L预冷75%乙醇洗涤沉淀,12 000 r/min离心3 min,弃上清,65℃干燥5 min,加入60L去离子水,65℃水化15min,取4L进行1%琼脂糖凝胶电泳(120V,30min),剩余样品 20℃保存。
1.3.3 试剂盒法 DNeasyBlood & Tissue Kit法:分别称取 YC中1~17、YC中19~25、Z 1~5、Z 7~14、Z 18~24、Z 27、D6、D 7、W2 号样品 70 mg 于 2 mL 离心管中,加入500LATL、20L蛋白酶K,900r/min56℃过夜消化。加入556LAL,混匀,900r/min56℃30min。12000r/min离心5min,上清转移至新2mL离心管中,加入556L无水乙醇,颠倒混匀,转入试剂盒中自带吸附柱内,吸附柱置于收集管中,8000r/min离心2min,吸附柱转入新收集管。加入700LAW1,8000r/min离心2 min,吸附柱转入新收集管。加入700L AW2,8 000 r/min离心2 min,吸附柱转入新收集管,12000r/min离心5min。吸附柱转入自备1.5mL离心管,开盖,室温干燥10 min。加入60L去离子水,水化10 min,12 000 r/min离心5 min,取4L进行1%琼脂糖凝胶电泳(120 V,30 min),剩余样品 20℃保存。
2 结果与分析
2.1 鹿角取样部位分析
由图1 可知,YC基1、3、4、19、21、22、23、25 共 8个样品有明显条带,轻微胶孔杂质。由图2可知,除YC中5、9、11、13、14、17外,共18 个样品均有DNA条带,存在轻微胶孔杂质。由此表明,鹿角中部较基部DNA含量更高,适合作为鹿角DNA提取的取样部位。
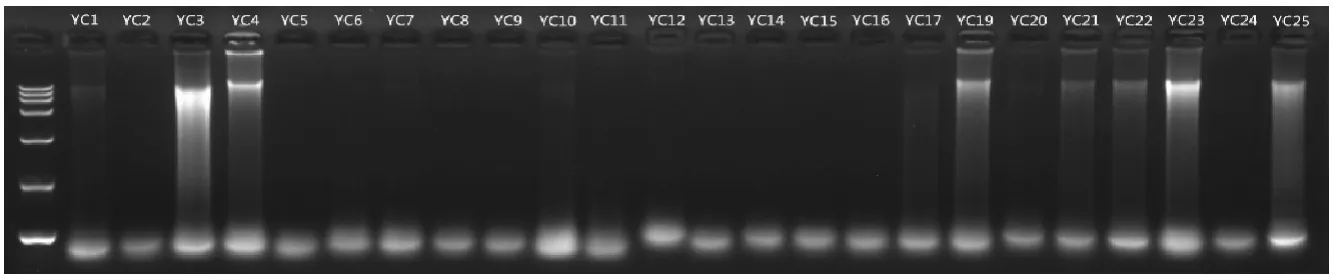
图1 酚-氯仿法提取YC基DNA电泳结果Fig.1 Electrophoresis results of extracting YC-based DNA by phenol-chloroform method
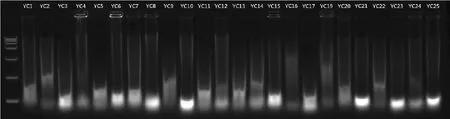
图2 酚-氯仿法提取YC中DNA电泳结果Fig.2 Electrophoresisresults of extracting YC-middle DNA by phenol-chloroform method
2.2 鹿角DNA提取方法分析
图2~3显示,酚-氯仿法和改良酚-氯仿法进行鹿角DNA提取,胶孔都有杂质污染,提出率相仿,但酚-氯仿方法除去过夜消化时间,40min完成DNA提取,改良酚-氯仿方法提取时间是酚-氯仿方法的3倍,即120min。图2条带不如图3整齐,但酚-氯仿方法得到的图1、4条带均优于图3。图1~4总体情况表明,酚-氯仿方法较改良酚-氯仿方法更适合用于鹿角DNA提取。

图3 改良酚-氯仿法提取YC中DNA电泳结果Fig.3 Electrophoresis results of extracting YC-middle DNA by modified phenol-chloroform method
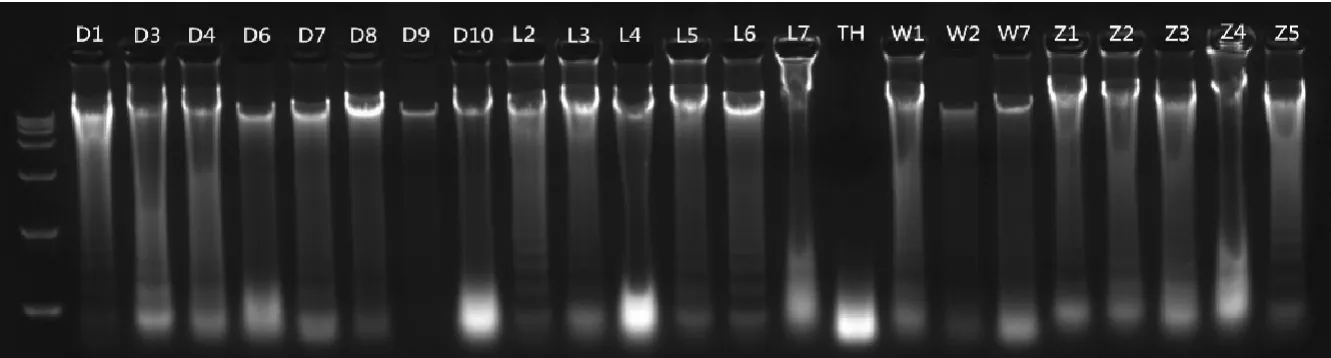
图4 酚-氯仿法提取鹿角中部DNA电泳结果Fig.4 Electrophoresis results of extracting antler-middle DNA by phenol-chloroform method
D1、D3、D4、D6~10、L2~7、TH、W1、W2、W7、Z1~5共24个样品,通过酚-氯仿方法提取DNA(图4),24个样品拥有清晰大片段条带,耗时40min。用骨试剂盒进行提取,75min得到16个能看清拥有大片段条带的DNA样品(图5),虽然条带干净,泳道底端基本没有降解小片段,但大部分条带模糊,DNA含量低,加之骨提取试剂盒价格昂贵(>2 000元),所以酚-氯仿方法较骨试剂盒更适合用于鹿角DNA提取。
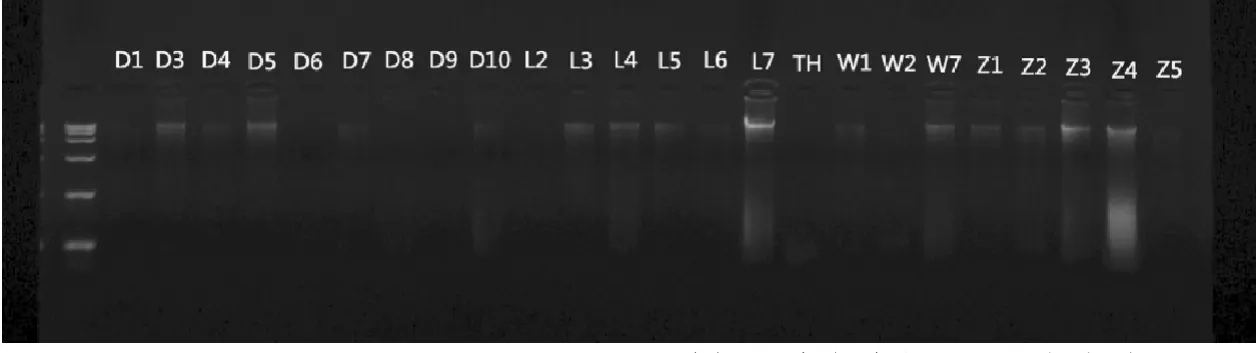
图5 QIAamp DNA Investigator Kit法提取鹿角中部DNA电泳结果Fig.5 Electrophoresis results of extracting antler-middle DNA by QIAamp DNA Investigator Kit
YC中1~17、YC中19~25,先后采用酚-氯仿(图2)、改良酚-氯仿(图3)、组织试剂盒(图6)3种方法提取DNA,图2、3中的胶孔杂质亮度均高于图6。图2中5、9、11、13、14、17共6个样品电泳条带质量差,图3中5、11、17 共 3 个样品电泳条带质量差,图 6 中 5、9、11、16共4个样品电泳条带质量差,提取DNA耗时分别为40、120、60min,结合图6以及图7电泳条带均比图2~3干净工整,推断组织试剂盒更适合提取鹿角DNA。
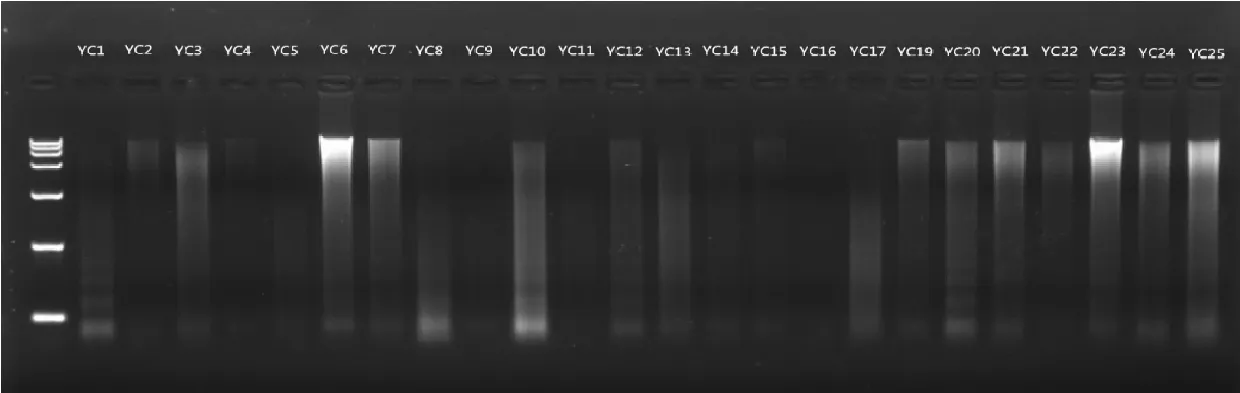
图6 DNeasy Blood & Tissue Kit法提取YC中DNA电泳结果Fig.6 Electrophoresis results of extracting YC-middle DNA by DNeasy Blood & Tissue Kit
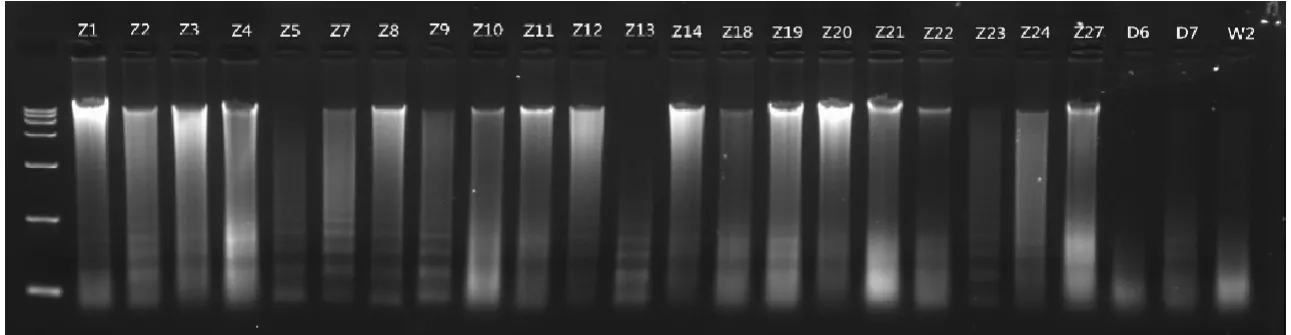
图7 DNeasy Blood & Tissue Kit提取鹿角中部DNA电泳结果Fig.7 Electrophoresisresults of extracting antler-middle DNA by DNeasy Blood & Tissue Kit
3 结论
本实验通过对63支鹿角不同取样部位以及不同DNA提取方法进行研究。结果表明,鹿角中部DNA含量高于基部,更适合作为提取DNA的取样部位;从DNA提取时间以及电泳条带方面考虑,酚-氯仿法优于改良后方法;在鹿角DNA提取中组织试剂盒比其他3种方法更适合用于提取鹿角DNA。综上,以鹿角为原材料进行DNA提取中,建议从鹿角中部取样,液氮研磨后,用组织试剂盒(QIAGEN NO.69504)进行DNA提取。
