食品和动物性饲料中沙门氏菌PCR检测方法的建立
2019-07-03刘艳环朱言柱王玉方王长凤苗利光李海涛
刘艳环,朱言柱,王玉方,王长凤,苗利光,李海涛
(中国农业科学院特产研究所,长春 130112)
沙门氏菌是一种常见的食物传播性人、畜共患病病原菌,可通过被污染的食品、饲料感染人和动物,临床表现为败血症、胃肠炎、妊娠中断及其他组织的局部炎症和食物中毒。不同动物的沙门氏菌病在世界各地广泛分布,对人和动物的健康构成了严重的威胁[1]。控制食品及饲料污染是预防和控制沙门氏菌病的重要环节。因此,快速、准确地检验食品、饲料中的沙门氏菌对防止人和动物沙门氏菌感染具有重要意义。
目前,对沙门氏菌的检验主要采用传统的病原分离鉴定方法[2-3],此种方法比较烦琐且费时费力,假阴性率较高,已不能满足疫病控制和经济发展的需要。随着科学技术的进步,一些新的细菌检测方法在沙门氏菌检验中得到尝试和运用,这些方法不仅弥补了病原分离鉴定方法的不足,同时加快了检验速度,得到人们的广泛关注[4-6]。分子生物技术,特别是聚合酶链式反应(PCR)技术的迅猛发展为建立快速、准确的沙门氏菌检验方法提供了技术支持[7]。但运用PCR技术快速检验食品及动物饲料中的沙门氏菌,国内至今没有一种有效的方法问世。PCR技术的关键是引物的筛选及样品的处理。沙门氏菌是由一大群血清型(2 000多种)相关的革兰氏阴性、蒹性厌氧杆菌组成,为引物的筛选带来了一定的困难[8],另外,食品及动物性饲料成份比较复杂,寻找一种即不影响正常PCR反应又简便、经济、快速的样品处理方法有一定的难度。本项研究建立了一种适合于食品和动物性饲料沙门氏菌污染检测的PCR方法。
1 材料
1.1 供试菌种
鸡白痢沙门氏菌(Salmonella pullorum)C79-13、鼠伤寒沙门氏菌(S.typhi)C77-32、猪霍乱沙门氏菌(S.cholerasuis)A72-32(中国兽医药品监察所);坏死杆菌(Fusobacterium necrophorum)、绿脓杆菌(Pseudomonas acruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、结核杆菌(Mycobacterium tuberculosis)、大肠埃希氏菌(Escherichiacoli)C600(中国农业科学院特产研究所疫病室分离或保存)。
1.2 实验仪器
PCR仪(MJResearch公司);离心机(Eppendorf公司)。
2 方法
2.1 沙门氏菌的培养、分离与鉴定
按沙门氏菌传统方法进行培养、分离与鉴定。
2.2 菌株DNA的提取
参照革兰氏阴性杆菌 DNA快速提取法提取DNA。
2.3 引物设计与合成
根据沙门氏菌毒力因子基因(AE008832.1)保守序列设计特异引物,由北京赛百盛公司合成。

2.4 样品处理
2.4.1 鱼粉 无菌取0.1~0.3g样品于1.5mLEppendorf管中,加TE至0.5 mL混匀,静置20 min。取全部上清,12000r/min离心5min,留沉淀,用50LTE悬浮。加1mol/L的Tris碱2L。100℃加热9min后冰浴1min。12000r/min离心5min。取5L上清于50LPCR反应体系中进行PCR反应。
2.4.2 肉骨粉和蛋制品 无菌取0.1~0.3g样品于1.5mL Eppendorf管中,加TE至0.5 mL混匀,静置20 min。取全部上清,12 000 r/min离心5 min,留沉淀,用50L TE悬浮。100℃加热9min后冰浴1min。12000r/min离心5 min。取5L上清于50LPCR反应体系中进行PCR反应。
2.4.3 鱼罐头 无菌取0.1~0.3g样品于1.5mLEppendorf管中,加TE至0.5mL混匀,静置20min。12000r/min离心5min,去上清。用STE混匀,吸出液体部分于另一Eppendorf管中。12000r/min离心5min,去上清。取20L灭菌水悬浮沉淀,100℃加热9 min后冰浴1 min。
2.4.4 残留 DNA的样品处理 一般样品:无菌取0.1~0.3g样品于1.5mLEppendorf管中,加TE至0.5mL混匀,静置20 min,12 000 r/min离心10 min。取全部上清,加入2倍体积的无水乙醇静置10 min。12 000 r/min离心5 min。沉淀干燥后加30L灭菌水溶解。
油脂含量高的样品:无菌取0.1~0.3g样品于1.5mL Eppendorf管中,加TE至0.5mL混匀,静置20min。取上清,加10L 1 mol/L 的 Tris碱,50℃2~3 min,仔细去油层。100℃加热10 min后冰浴1 min。加入等体积的酚摇匀,12000r/min离心5min。取上清,加入等体积的酚/氯,12 000 r/min离心5 min。取上清,加入2倍体积的无水乙醇,静置10 min,12 000 r/min离心10 min。沉淀干燥后加30L灭菌水溶解。
2.4.6 特异性试验 扩增由各种菌株提取的DNA,扩增人为污染样品,同时以非污染样品作对照。
2.4.7 PCR敏感性试验 用TE将沙门氏菌分别稀释成 5 10 cfu/mL、1 102cfu/mL、2 102cfu/mL、2 103cfu/mL、2 104cfu/mL、2 105cfu/mL与 0.1~0.3 g样品混合,经处理后取5L进行PCR,同时以非沙门氏菌与样品混合物作对照。
2.4.8 复合性试验 随机抽取鱼罐头、蛋制品、鱼粉、肉骨粉样品各10份,用该PCR方法检测,同时用传统的病原分离鉴定方法对样品进行检验,验证该PCR方法的应用效果。
3 结果与分析
3.1 特异性试验

图1 细菌DNA PCR特异性Fig.1 Bacterial DNA PCRspecificity
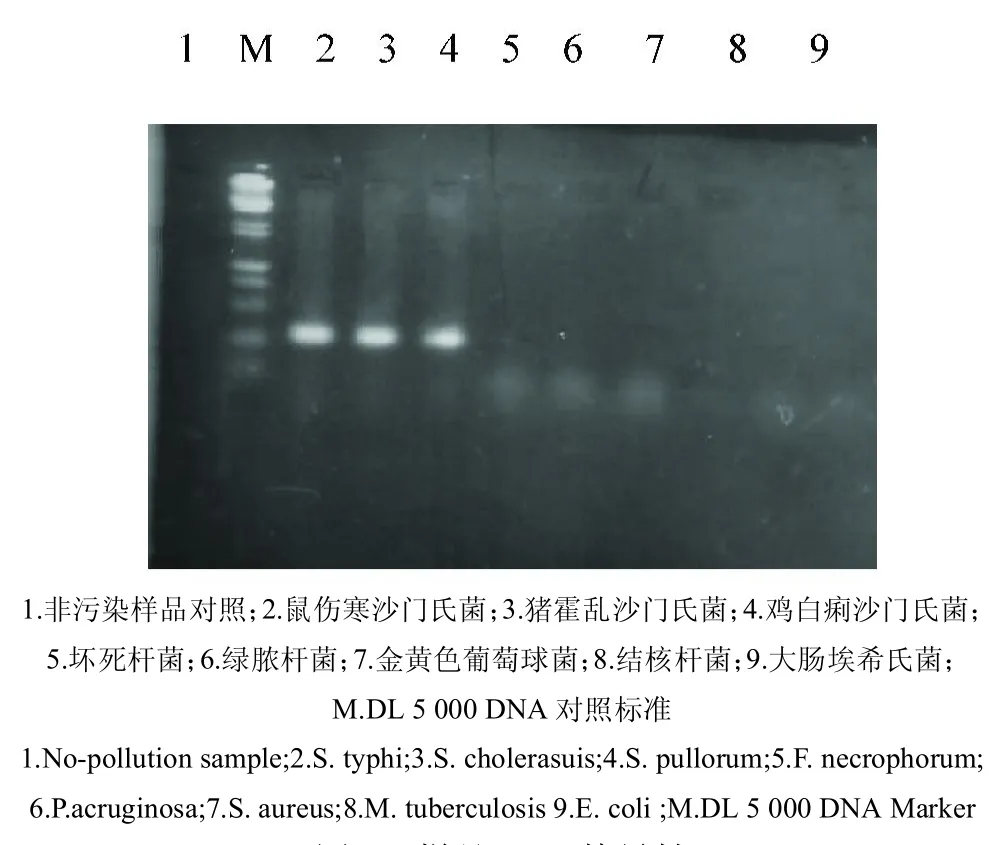
图2 样品PCR特异性Fig.2 Sample PCRspecificity
3.2 敏感性试验
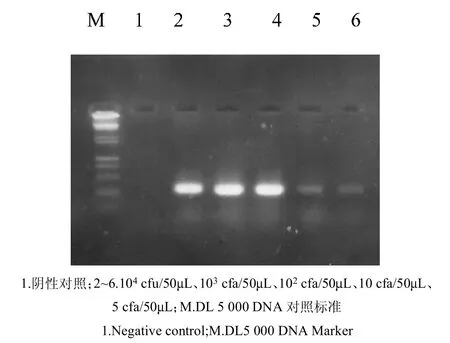
图3 鱼粉PCR敏感性试验Fig.3 PCRsensitivity of fish meal

图4 皮蛋、肉骨粉PCR敏感性Fig.4 PCRsensitivity of preserved egg,meat and bone meal
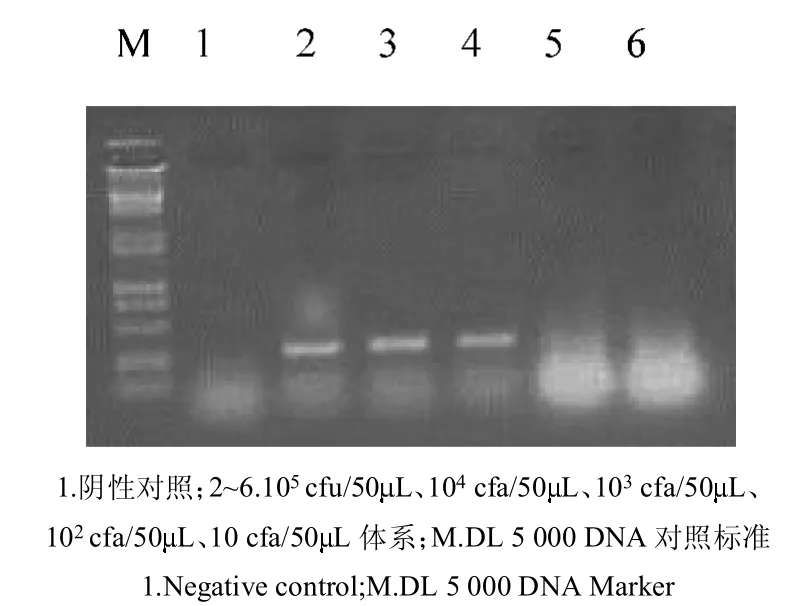
图5 鱼罐头PCR敏感性试验结果Fig.5 PCRSensitivity of preserved canned fish
3.3 复合性试验
用PCR方法在抽取的鱼粉中未检出阳性结果,而肉骨粉有3个为阳性;用传统的病原分离鉴定方法在鱼粉中未检出阳性结果,在肉骨粉中检出1份为阳性,该份样品是PCR检验3个阳性样品中的一份。实验证明,该PCR方法可以检出样品中已死亡的沙门氏菌,而病原分离鉴定法无法检出,说明PCR方法有更高的检出率。
4 讨论
沙门氏菌是食物中毒中最常见的致病菌,在我国占食物中毒的第一位。在被沙门氏菌污染的食品和饲料中,常有一些存活不能培养或死亡的沙门氏菌存在,这些沙门氏菌及其残留物用常规检测方法难以检出。而采用PCR方法,设计合适的引物,能够有效地检出沙门氏菌及其残留物。
本实验选取沙门氏菌污染较为严重的肉类和蛋类进行试验。为排除样品中蛋白质对提取模板DNA的影响,先用酚-氯仿进行粗提,之后用试剂盒纯化回收,取得较好效果。在试验中发现,121℃15min处理的样品的PCR检测灵敏度要比100℃10 min处理样品低10~100倍,说明高温处理导致一些模板DNA序列的裂解,从而降低了检测灵敏度,另外,在相同处理条件下,不同样品PCR检测灵敏度有很大差异,造成这种差异的原因还需进一步研究。
